胰十二指肠切除术(child术)后早期肠内营养的46例临床体会
夏 菁 陈坚
南京医科大学附属苏州市立医院东区普外科 苏州 215001
胰十二指肠切除术(child术)创伤大,术后患者营养的需要量大于供给量,处于消耗、应激状态,抵抗力、体质量下降明显,此时整体组织包括肠管在内将有所改变。维护手术后应激时肠道功能的方法很多,如增加肠系膜血流量、中和内毒素等,但目前最具有价值的方法是早期行肠内营养。我们对46例胰十二指肠切除术(child术)患者随机分为常规组与肠内营养组,进行了前瞻性治疗观察,以了解早期肠内营养的作用。现报告如下。
1 资料与方法
1.1 临床资料 46例均为我院2006—2010年胰头占位患者,术中穿刺活检,病理证实为胰头癌。其中男31例,女15例;平均年龄(59.8±7.3)岁。患者均行胰十二指肠切除术(child术)治疗并随机分为常规组与肠内营养组。
1.2 材料
1.2.1 管道:胃肠减压管及荷兰Nutricia公司生产的肠内营养管,肠内营养管长2 m,外径5 mm,内径3 mm,管腔内预置可拔出导丝。
1.2.2 营养制剂:荷兰Nutricia公司生产的百普力与能全力。
1.2.3 置管方法:常规组术中仅放置胃肠减压;肠内营养组术中经鼻孔插入胃管及肠内营养管,插入深度为55~65 cm,保留肠内营养管的导丝。术中完成胃肠吻合后,肠内营养管下送,术者将肠内营养管远端导引通过吻合口,留置于距吻合口下方远端小肠内约20 cm处后拔出导丝。
1.3 肠内营养方法 术后24 h给予百普力计划量125.5~146.4 kJ/(kg·d)的1/2,术后48 h加至计划量百普力,待肛门排气后,肠内营养制剂改为能全力。用输注泵持续缓慢滴注,术后第1天起始速度为21 mL/h,术后第2 d后以42 mL/h速度输注。行肠内营养时,患者取半坐位或坐位;冲洗管道3次/d,以防止管道堵塞;维持使用肠内营养的时间为10 d。
1.4 观察指标 常规组与肠内营养组患者分别于手术前、手术后第10天清晨抽血以自动生化仪测定血清白蛋白值。常规组与肠内营养组患者术后均仔细观察肠道功能恢复时间(以术后肛门排气时间表示),以天为单位。
1.5 统计学方法 所有数据均以均数±标准差表示,营养支持前后血清白蛋白变化的对比采用t检验。
2 结果
2.1 体质量 肠内营养组术后第10天的体质量与常规组比较有显著差异。
2.2 氮平衡 留24 h尿测定尿素氮,计算氮平衡的结果提示:术后第10天呈正氮平衡。
2.3 血浆白蛋白 白蛋白(Alb)浓度测定采用溴甲酚绿法,由BACKMAN自动化分析仪测定。结果见表1。
2.4 一般情况 46例患者均痊愈出院。治疗期间均能接受肠内营养,均未出现严重的腹胀、腹泻、胰漏及吻合口瘘。术后3~6 d肛门排气,肠内营养组治疗费用明显低于常规组,平均住院时间为(19.3 ±5.3)d。见表2、3、4。
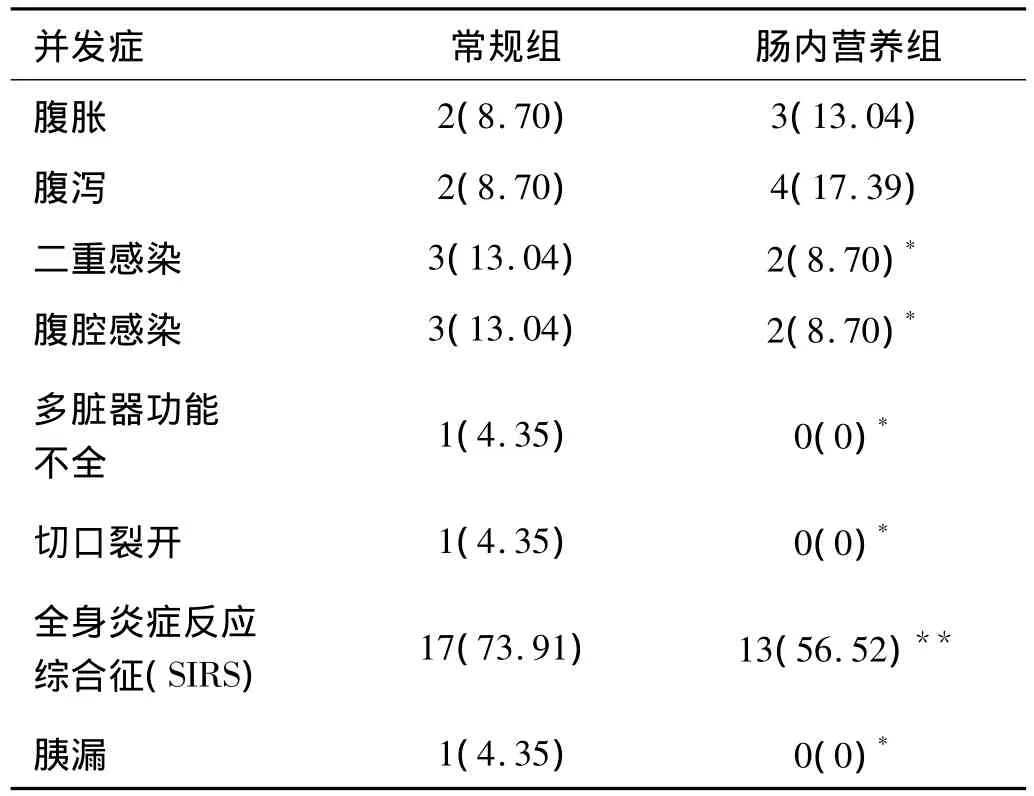
表2 2组并发症发生情况 [例(%)]
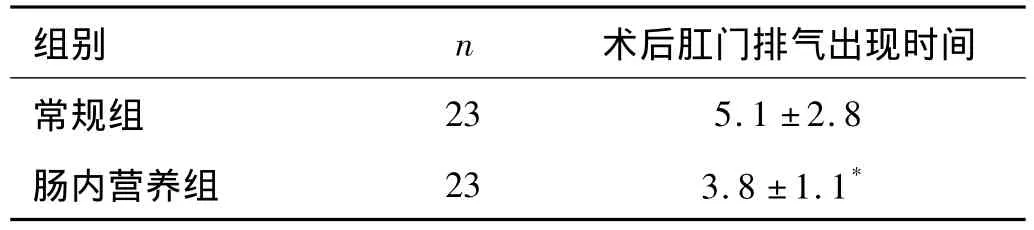
表3 2组患者术后肠鸣音出现时间的比较

表4 2组住院费用及住院时间比较
3 讨论
临床上行胰十二指肠切除术(child术)的患者,术后能量消耗增加而营养素摄入不足常出现营养不良,通常要待大肠功能恢复即肛门排气后才开始进食,常规组术后长期禁食,肠道失去食物机械刺激,导致肠黏膜萎缩;肠道相关淋巴网状内皮组织受抑,黏膜浆细胞计数及分泌性免疫球蛋白分泌减少,肠道菌群微生态失衡,肠屏障功能受损。手术后腹腔渗出,刺激胃肠壁使胃肠壁水肿、蠕动减弱而致肠胀气,可进一步导致肠道屏障功能衰竭,有助于细菌的繁殖和易位[1]。研究证明,腹部手术后胃的功能于术后1~2 d恢复正常,大肠的功能于术后3~5 a恢复正常,而小肠的蠕动、消化、吸收功能在开腹术后几小时即恢复正常[2],术后24 h就能接受营养物质输入。所以胰十二指肠切除术(child术)后第1天开始行肠内营养是可行的。早期肠内营养可增强肠道本身的吸收能力,与其促进肠黏膜Na+-K+-ATP酶活性有关,肠内营养通过改善葡萄糖和钠等物质的吸收而最大限度增加肠道功能[3],早期肠内营养可明显增加葡萄糖和脂肪的吸收量。故表1肠内营养组术后第10天体质量与常规组相比较有明显差异;氮平衡、血清白蛋白值(g/L)与常规组相比较有显著差异。
早期肠内营养通过食物刺激胃肠道,可激活肠道消化分泌系统,促进肠道激素的合成和释放,调节胃液、胆汁、胰液分泌,促进胃肠蠕动及黏膜生长,维持肠道及机体的免疫功能。研究表明,尽管喂养始于消化道近端,在喂养开始的数分钟内整个肠道的血流量均明显增加。这种肠道血流的快速增加,可能来自食物刺激引起的神经反射和内分泌激素的作用,也提示胃肠道对食物介导的机械与化学刺激存在着整体的调节机制[4],来维护肠道免疫功能,进而对全身免疫功能尤其是T淋巴细胞功能的改善亦十分有益,可明显减少全身炎症反应综合征(SIRS)的发生[5]。由于肠道血流量的增加,明显减少了胃肠吻合口瘘、胰漏的发生。上段空肠喂养,消除了胰分泌的胃相和部分肠相,也可以使残存胰腺继续处于休息状态。本文肠内营养组患者无发生吻合口瘘、胰漏(本组仅观察23例病例,样本量较少,更准确结论有待更大样本分析)。早期肠内营养对于手术后的康复及并发症的预防具有积极的作用。
肠内营养制剂在病人肛门排气前使用百普力,这是一种肽类要素膳,具有以下优点:(1)氮源为短肽链的蛋白和氨基酸单体;短肽不仅吸收较快,而且存在于短肽中的氨基酸被最大限度地均衡吸收;与以氨基酸为氮源的要素膳相比,由于降低了渗透压,从而提高了病人的耐受性。(2)脂肪来源为长链脂肪酸(植物油)/中链脂肪酸:中链脂肪酸的吸收不需脂肪酶、甘油三酯再合成便能被吸收,长链脂肪酸可提供必需脂肪酸。在病人肛门排气后,我们选择使用能全力,它是以酪蛋白、植物油、麦芽糊精为基质的等渗全聚合的胃肠内营养制剂,它包含有大豆、多糖、纤维素等六种纤维成分。纤维素对小肠、大肠的黏膜生长和细胞增殖均有刺激和促进作用,能更好地维持小肠黏膜细胞的形态和功能,增强肠道的蠕动,改善肠道排泄物的黏稠度,通过增加短链脂肪酸,改善结肠黏膜细胞功能,刺激大肠中水、电解质的再吸收[6]。由于消化道对肠内营养剂的机械与化学刺激的调节,促进了肠道运动功能恢复[7],表3提示早期肠内营养可明显缩短术后肛门排气时间。
肠内营养具有符合正常生理代谢的特点,操作简单,且药品价格低于肠外营养,经济实用。表4早期肠内营养组的术后住院日期明显少于常规组,患者术后恢复较快;肠内营养组治疗费用明显低于常规组,提示肠内营养是比较优越比较经济的治疗方案。
由上可见,胰十二指肠切除术(child术)后行早期肠内营养,有利于改善患者营养状况,有利于恢复患者肠道屏障结构和功能的完整性,防止菌群易位、继发感染和并发症的发生,有助于残存胰腺外分泌功能的“休息”和胰腺的自身修复,具有经济实用的优点。
[1]McClave SA,Ritchie CS.Artificial nutrition in pancreatic disease:what lessons have we learned from the literature[J].Clin Nutr,2000,19:1-6.
[2]Schroeder D,Robert B,Manolell LA.Effect of immediate postoperative enteral nutrition on body composition,muscle function and wound healing[J].JPEN,1991,15:376-383.
[3]郭丰,李宁,黎介寿.短肠综合征的残存肠道代偿及营养康复治疗[J].肠外与肠内营养,1999,6:158-164.
[4]Purcell PN,Barradas P.Continuous duodenal feeding restores gut blood flow and increases gut oxygen utilization during PEEP ventilation for lung injury[J].Am J Surg,1993,165(1):188-193.
[5]陈强谱,欧琨,刑雪,等.胃癌术后早期肠内营养对T淋巴细胞亚群的影响[J].中国现代普通外科进展,2000,3:27-29.
[6]邵继智.膳食纤维与肠内营养[J].普外临床,1996,11(4):202-208.
[7]吴文溪,许勤,华一兵,等.结直肠切除术后早期肠内营养的前瞻性研究[J].世界华人消化杂志,1999,7:1 024-1 028.