cPKCγ参与低氧预适应对小鼠脑缺血皮质内CRMP2水解和磷酸化的调节
刘燕燕,杨 璇,韩 松,苏吉儿,罗 宏,李俊发
(首都医科大学神经生物学系北京神经科学研究所,北京 100069)
cPKCγ参与低氧预适应对小鼠脑缺血皮质内CRMP2水解和磷酸化的调节
刘燕燕,杨 璇,韩 松,苏吉儿,罗 宏,李俊发*
(首都医科大学神经生物学系北京神经科学研究所,北京 100069)
目的 探讨经典型蛋白激酶Cγ(cPKCγ)在低氧预适应(HPC)调节小鼠脑缺血皮质内脑衰反应蛋白-2(CRMP2)水解和磷酸化中作用。方法 利用雄性BALB/c小鼠(18~22 g)HPC和大脑中动脉阻塞(MCAO)模型,借助蛋白印迹、免疫共沉淀和免疫组化等生物化学技术,观察cPKCγ激活对小鼠缺血脑皮质内CRMP2蛋白水解程度(BDP)和磷酸化水平(p-CRMP2)、cPKCγ-CRMP2相互作用和皮质缺血半影区内p-CRMP2阳性细胞数的影响。结果HPC显著提高缺血脑皮质半影区内p-CRMP2水平,降低BDP产物形成(P<0.05),而侧脑室注射cPKCγ抑制剂Go6983(6nmol/L)可明显解除HPC对半影区内CRMP2蛋白水解和磷酸化的调节作用(P<0.05);免疫共沉淀结果提示,cPKCγ激活程度参与HPC对缺血脑皮质半影区内cPKCγ-CRMP2相互作用的调节;同时,cPKCγ激活与HPC提高脑缺血半影区内p-CRMP2阳性细胞数有关(P<0.05)。结论cPKCγ参与HPC对小鼠缺血脑皮质内CRMP2水解与磷酸化的调节。
缺血/低氧预适应;大脑中动脉阻塞;经典型蛋白激酶C;脑衰反应蛋白-2
*通信作者(corresponding author):junfali@ccmu.edu.cn
脑卒中给人类健康和生命造成极大威胁,给患者带来极大痛苦,给家庭及社会造成沉重负担。因此,提高脑中风的治疗与预防水平、降低脑中风的发病率,和死亡率显得尤为重要。脑低氧预适应(hypoxic preconditioning,HPC)是一种内源性保护机制,能提高组织器官对缺血/低氧的耐受,对其机制及参与细胞信号传导通路的研究,对临床治疗脑缺血/低氧损伤具有重要指导意义。脑衰反应调节蛋白2(CRMP2)是最早被发现的CRMPs家族成员,被认为是semaphorin3A介导的生长锥塌陷信号通路中关键细胞内信号蛋白[1]。本实验室发现脑HPC后经典型蛋白激酶Cγ(cPKCγ)的激活水平增加,借助蛋白质组学技术曾发现HPC后cPKCγ-CRMP2相互作用明显增强[2];侧脑室注射 TAT-CRMP2可减少 CRMP2水解同时提高p-CRMP2水平,并在一定程度上减轻脑缺血损伤[3]。据此,本实验拟利用小鼠HPC和脑中动脉阻塞(middle cerebral artery occlusion,MCAO)脑缺血模型,探讨cPKCγ对脑HPC对小鼠缺血脑皮质内CRMP2水解和磷酸化的调节。
1 材料与方法
1.1 材料
清洁级 BALB/c小鼠[雄性,18~22 g,8~10周,首都医科大学动物部,许可证编号:SCXK-(军)2007-004];兔源性 cPKCγ、CRMP2 抗体(一抗,Santa Cruze公司)和p-CRMP2抗体(Abcam公司);鼠源性β-actin单克隆抗体(Sigma公司);辣根过氧化物酶标记的山羊抗兔抗体和山羊抗鼠抗体(二抗)和ECL反应底物(Chemicon公司)和Gel Doc凝胶成像分析系统(Bio-Rad公司);BCA蛋白定量试剂盒(Pierce公司);Kodak BioMaxMR X-光片(Kodak公司);蛋白酶抑制剂(AEBSF,Leupeptin,Aprotinin,Pepstatin A和Chymostrypsin)、磷酸酶抑制剂(KF,Okadaic acid,Sodium pyrophosphate 和 Sodium orthovanadate)、Sodium deoxycholate、DTT、NP-40、EDTA、EGTA和SDS等试剂(Sigma公司);小鼠线栓(头端直径为0.23 mm,沙东生物技术有限公司)。
1.2 实验动物和模型制备
按本室已建方法制备小鼠 HPC模型[4]。在HPC后1 h,行小鼠MCAO脑缺血模型制备以及侧脑室注射[5]。简述如下:腹腔注射戊巴比妥钠(0.6 g/kg)麻醉小鼠,显微镜下游离左侧颈总动脉、颈外动脉及颈内动脉,结扎颈总动脉的近心端和颈外动脉的远心端;将头端直径0.23 mm、主干直径0.18 mm的栓塞线,由颈外动脉插入至大脑中动脉 (深度约12.0 mm),并固定线栓。假手术组只进行手术操作,不插入线栓。整个手术过程平均20 min完成,此间保持小鼠体温,术后放入有清洁垫料的饲养盒中,自由饮水、进食。小鼠在麻醉后固定小鼠于脑立体定位仪上,局部用利多卡因局麻后行正中切口。按侧脑室的体表投影,以前囟为零点,在前囟后2.0 mm,左侧1.0 mm和3.5 mm深度用微量注射器将5 μL cPKCγ抑制剂 Go6983(6 nmol/L)或灭菌二甲基双砜 (DMSO)分别缓慢地注入到小鼠左侧脑室。将动物分为常氧假手术(sham)、缺血 (I)、低氧预适应 (HPC)+I、HPC 1 h后侧脑室注射Go6983或DMSO后再行缺血五组。小鼠饲养条件为22±2℃、相对湿度55% ±3%,自由进食进水,手术前12 h禁食。
1.3 免疫沉淀
选取小鼠皮质层组织不同蛋白组分,进行操作如下:首先取蛋白质 G-Agarose 30 μL进行预洗,加入IP缓冲液500 μL,轻轻摇洗,4℃ 12 000×g离心40 s后,弃上清,重复3次;然后,取总蛋白500 μg,蛋白质 G-Agarose 30 μL,加 IP 缓冲液至500 μL,于脱色摇床4℃孵育1 h;4℃ 12 000×g离心40 s后,保留上清 (以排除与蛋白质G-Agarose非特异性结合蛋白)。上清内加入相应抗体1~5 μg和蛋白质G-Agarose 30 μL,室温下脱色摇床上孵育过夜。4℃ 12 000×g离心40 s后,弃上清,在沉淀中加入 IP缓冲液500 μL轻轻摇洗,4℃12 000×g离心40 s后,弃上清,重复3次。最后,在沉淀中加入100 mmol/L甘氨酸 (pH=3.0)100 μL,轻 轻 震 荡,90℃ 加 热 变 性 5 min,12 000×g离心40 s,吸取上清,用1.5 mol/L Tris-Cl(pH=8.8)缓冲液调节上清液的pH至中性;或在沉淀中加入100 μL thiourea缓冲液,振荡5 min,离心取上清保存备用。
1.4 免疫组织化学(DAB法)
将小鼠用1%戊巴比妥钠进行腹腔麻醉,沿胸旁正中线切开皮肤、剪断肋骨、暴露心脏。在心尖处剪开左心室,插入灌流导管至升主动脉,剪开右心耳。先用0.9%NaCl溶液灌流,每只小鼠约20 mL;血液冲净后用4%多聚甲醛固定液灌流,每只小鼠100 mL,持续30 min。取脑,放入4%多聚甲醛固定液中后固定4~6 h,再放入20%的蔗糖溶液中脱水后,冰冻切片机中切片。DAB显色,镜下观察染色结果。
1.5 免疫组化p-CRMP-2阳性细胞计数方法
在高倍视野下对小鼠大脑皮质组织内染色完整细胞进行计数。每只动物选取5张脑片,每张脑片选取8个高倍视野,取平均值。计算出每高倍视野中染色完整细胞的细胞数。实验数据用SPSS for Windows11.5统计软件进行单因素发差分析,结果以均数±标准差(±s)表示。
1.6 统计学分析
Western Blot结果应用Quantity One分析软件进行半定量分析。所有实验数据均通过独立样本t检验和单因素方差分析进行统计学检验,以均数±标准差(±s)表示。
2 结果
2.1 cPKCγ参与了HPC对缺血皮质半影区内CRMP2水解及磷酸化的调节
MCAO 6 h后,各实验组CRMP2的总蛋白量未发现明显变化;I组小鼠的脑皮质半影区内CRMP2磷酸化水平下降,并且出现了大量剪切片段;HPC处理组脑缺血皮质半影区CRMP2剪切片段减少,磷酸化水平增高;应用Go6983(6nmol/L)则一定程度上了削弱了HPC对CRMP2磷酸化以及剪切片段的影响(图1)。
2.2 cPKCγ活性对cPKCγ-CRMP2相互作用影响
cPKCγ与CRMP2之间存在相互作用,缺血后二者相互作用减弱,而HPC一定程度上可能减轻缺血对二者相互作用影响;应用Go6983后,HPC对缺血所致cPKCγ与CRMP2之间相互作用的影响可能被部分消除,提示cPKCγ与CRMP2之间相互作用可能与cPKCγ激活水平有关(图2)。
2.3 HPC和cPKCγ抑制剂Go6983(6 nmol/L)对小鼠脑缺血皮质半影区内p-CRMP2阳性细胞数的影响
HPC可减轻因脑缺血所致的p-CRMP2阳性细胞数目减少;应用Go6983则可取消HPC对脑缺血皮质半影区p-CRMP2阳性细胞的影响(图3)。
3 讨论
HPC是一种内源性保护现象,人们发现PKCs的激活是预适应形成的关键因素[6]。cPKCγ是神经组织特有的蛋白激酶C家族成员,以往研究报道HPC能缓解缺血刺激引起的cPKCγ激活水平下降[7]。cPKCγ的激活在缺血中的作用在国际上是存在争议的,本实验既往研究结果证明cPKCγ的膜转位水平升高可能参与了HPC对脑缺血的脑保护作用,这可能是因为彼此之间研究的缺血时间点不同有关。
借助蛋白质组学技术发现,HPC后cPKCγ与CRMP2相互作用明显增加。CRMP2是最早发现的CRMPs家族成员,在成熟脑组织中的表达量最高,可以与多种蛋白发生相互作用[8-10],并可能参与神经系统疾病的发生发展。有报道CRMP2是Rho、CDK5和GSK3的底物,并参与了生长锥的塌陷,轴突生长,缺血和阿尔茨海默病等[11-12]。然而,对于CRMP2的正常生理和病理功能还不清楚。研究表明,脑内CRMP2可与神经纤维瘤蛋白存在相互作用,提示其可能在神经元的发生过程中起作用[13]。有多个研究小组初步探讨了CRMP2在脑缺血,神经毒性和外伤创伤中的变化。利用双向电泳技术分析了大脑中动脉阻塞24 h后缺血皮质内蛋白质组学的变化情况,发现CRMP2表达明显升高[14]。在神经毒素和创伤脑损伤过程中,CRMP2可被calpain-2所降解[15],其降解片段(BDP)随着损伤或处理时间的延长而增加。检测新生鼠脑经低氧-缺血(HI)处理后CRMP2的变化,发现HI可导致CRMP2的低磷酸化状态,其低磷酸化可能是由于上游的激酶CDK5被抑制所致[16]。利用缺血再灌注模型研究发现Ca2+/钙调蛋白依赖性蛋白激酶II(CaMKII)增加,p-CRMP2水平增加,可能介导脑缺血轴突的损伤作用[17]。本实验室既往研究发现小鼠脑缺血损伤6 h后CRMP2水解片段增加,磷酸化水平降低。本实验通过Western blot技术检测发现HPC可显著提高缺血脑皮质半影区内p-CRMP2水平,降低BDP产物形成,而侧脑室注射 cPKCγ抑制剂 Go6983(6 nmol/L)可明显解除HPC对半影区内CRMP2蛋白水解和磷酸化的调节作用;免疫共沉淀结果表明cPKCγ激活程度参与HPC对缺血脑皮层半影区内cPKCγ-CRMP2相互作用的调节;同时,免疫组化进一步证实,cPKCγ激活与HPC提高脑缺血半影区内p-CRMP2阳性细胞数有关。
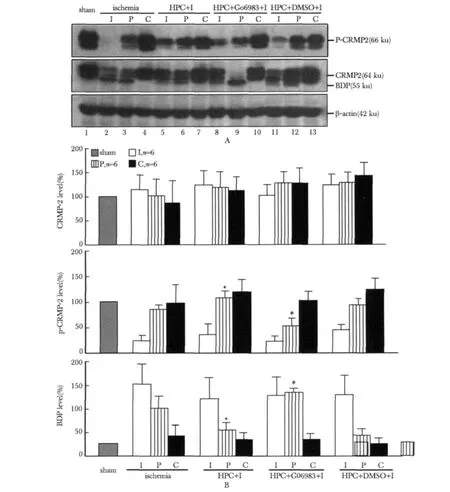
图1 cPKCγ参与HPC对缺血脑皮质半影区内CRMP2磷酸化和水解的调节Fig 1 cPKCγ involved in the regulation of hypoxic preconditioning on CRMP2 hydrolysis and phosphorylation in cerebral ischemic mice
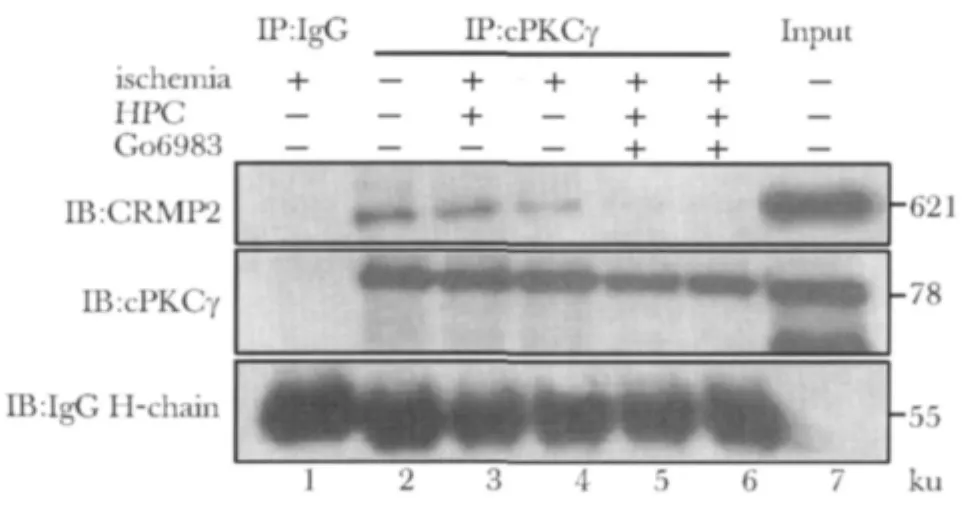
图2 小鼠脑皮质半影区cPKCγ活性对CRMP2-cPKCγ相互作用影响Fig 2 The activity of cPKCγ affect the interaction between cPKCγ and CRMP2 in the peri-infarct region of cerebral ischemic mice
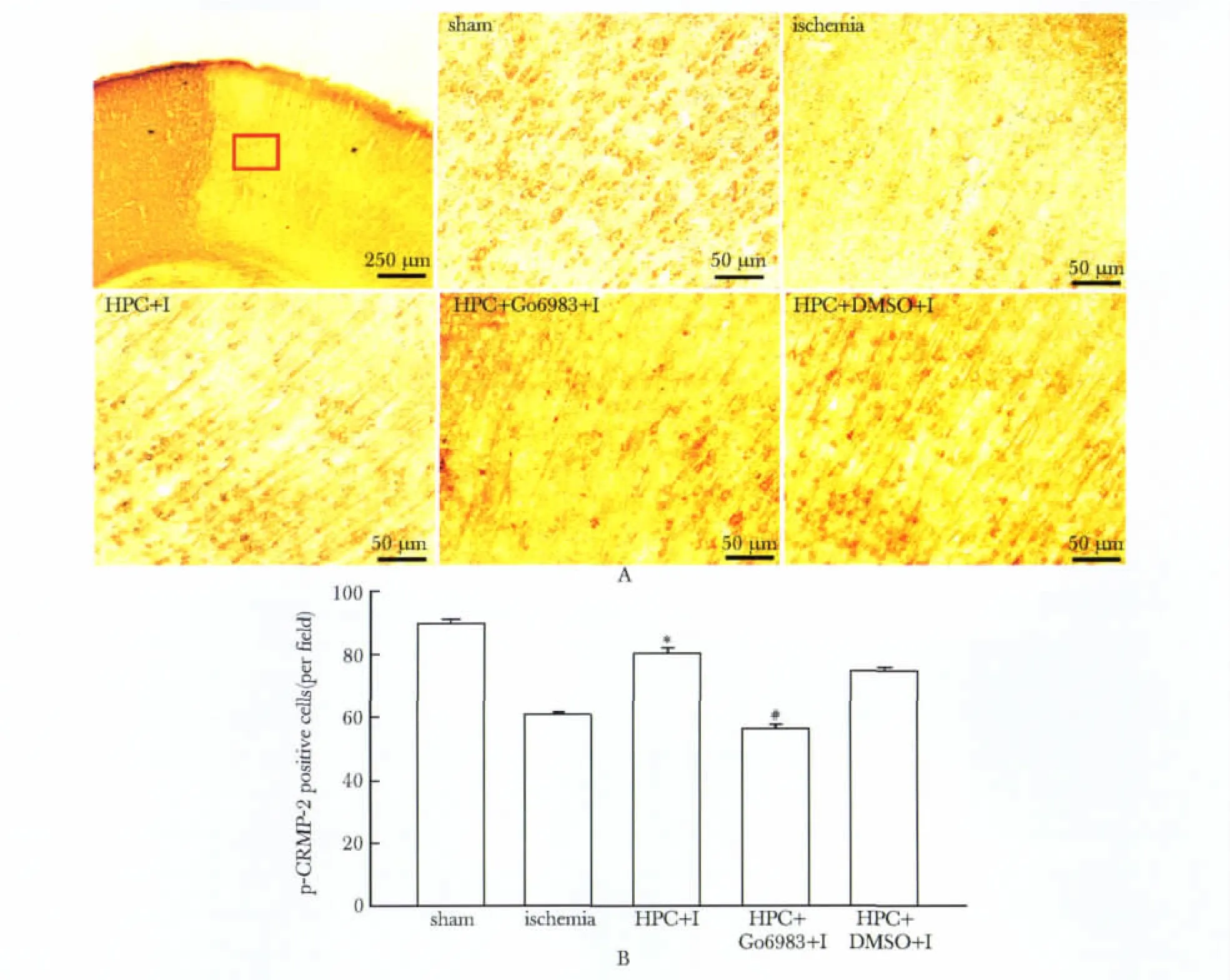
图3 HPC和cPKCγ抑制剂Go6983(6 nmol/L)对MCAO所致小鼠脑皮质半影区内p-CRMP2阳性细胞数的影响Fig 3 Effects of HPC and cPKCγ inhibitor Go6983(6 nmol/L)on the MCAO-induced p-CRMP2 positive cells loss in peri-infarct area of mice
本实验研究提示,cPKCγ参与低氧预适应对小鼠脑缺血皮层内CRMP2水解和磷酸化的调节,这种作用很可能是cPKCγ通过增加CRMP2磷酸化,减轻其水解来介导的。但是,cPKCγ是否可直接磷酸化CRMP2,cPKCγ-CRMP2信号通路在脑缺血/低氧性损伤和适应中的作用如何都有待进一步探讨。
[1]Uchida Y,Ohshima T,Yamashita N,et al.Semaphorin3A signaling mediated by Fyn-dependent tyrosine phosphorylation of collapsin response mediator protein 2 at tyrosine 32[J].J Biol Chem,2009,284:27393-27401.
[2]Zhang N,Yin YL,Han S,et al.Hypoxic preconditioning induced neuroprotection against cerebral ischemic injuries and its cPKCgamma-mediated molecular mechanism [J].Neurochem Int,2011,58:684 -692.
[3]Bu XN,Zhang N,Yang X,et al.Proteomic analysis of cPKCbetaII-interacting proteins involved in HPC-induced neuroprotection against cerebral ischemia of mice[J].J Neurochem,2011,117:346-356.
[4]Li JF,Niu CC,Han S,et al.Identification of protein kinase C isoforms involved in cerebral hypoxic preconditioning of mice[J].Brain Res,2005,1060:62 -72.
[5]Ma J,Zhao L,Nowak TS,et al.Selective,reversible occlusion of the middle cerebral artery in rats by an intraluminal approach.Optimized filament design and methodology[J].J Neurosci Methods,2006,156:76 -83.
[6]Marber MS,Ischemic preconditioning in isolated cells[J].Circ Res,2000,86:926 -931.
[7]Katsura KI,Kurihara J,Kato H,et al.Ischemic pre-conditioning affects the subcellular distribution of protein kinase C and calcium/calmodulin-dependent protein kinase II in the gerbil hippocampal CA1 neurons [J].Neurol Res,2001,23:751-754.
[8]Brittain JM,Piekarz AD,Yuying Wang,et al.An atypical role for collapsin response mediator protein 2(CRMP-2)in neurotransmitter release via interaction with presynaptic voltage-gated calcium channels[J].J Biol Chem,2009,284:31375-31390.
[9]Hensley K,Christov A,Kamat S,et al.Proteomic identification of binding partners for the brain metabolite lanthionine ketimine(LK)and documentation of LK effects on microglia and motoneuron cell cultures [J].J Neurosci,2010,30:2979-2988.
[10]Patrakitkomjorn S,Kobayashi D,Morikawa T,et al.Neurofibromatosis type 1(NF1)tumor suppressor,neurofibromin,regulates the neuronal differentiation of PC12 cells via its associating protein,CRMP-2[J].J Biol Chem,2008,283:9399-9413.
[11]Bretin S,Rogemond V,Marin P,et al.Calpain product of WT-CRMP2 reduces the amount of surface NR2B NMDA receptor subunit[J].J Neurochem,2006,98:1252-1265.
[12]Arimura N,Menager C,Kawano Y,et al.Phosphorylation by Rho kinase regulates CRMP-2 activity in growth cones[J].Mol Cell Biol,2005,25:9973 -9984.
[13] Lin YL and Hsueh YP,Neurofibromin interacts with CRMP-2 and CRMP-4 in rat brain,Biochem.Biophys[J].Res Commun,2008,369:747-752.
[14]Chen A,Liao W P,Lu Q,et al.Upregulation of dihydropyrimidinase-related protein 2,spectrin alpha II chain,heat shock cognate protein 70 pseudogene 1 and tropomodulin 2 after focal cerebral ischemia in rats——a proteomics approach[J].Neurochem Int,2007,50:1078 -1086.
[15]Zhang Z,Ottens AK,Sadasivan S,et al.Calpain-mediated collapsin response mediator protein-1,-2,and-4 proteolysis after neurotoxic and traumatic brain injury[J].J Neurotrauma,2007,24:460-472.
[16]Zhou Y,Bhatia I,Cai Z,et al.Proteomic analysis of neonatal mouse brain:evidence for hypoxia-and ischemia-induced dephosphorylation of collapsin response mediator proteins[J].J Proteome Res,2008,7:2507 -2515.
[17]Hou ST,Jiang SX,Aylsworth A,et al.CaMKII phosphorylates collapsin response mediator protein 2 and modulates axonal damage during glutamate excitotoxicity[J].J Neurochem,2009,111:870-881.
cPKCγ is involved in the regulation of hypoxic preconditioning on CRMP2 hydrolysis and phosphorylation in ischemic cortex of mice
LIU Yan-yan,YANG Xuan,HAN Song,SU Ji-er,LUO Hong,LI Jun-fa*
(Dep.of Neurobiology and Beijing Institute for Neuroscience,Capital Medical University,Beijing 100069,China)
ObjectiveTo explore the role of cPKCγ in hypoxic preconditioning(HPC)regulating hydrolysis and phosphorylation of collapsin response mediated protein 2(CRMP2)in the ischemic cortex of mice.MethodsUsing our established HPC and middle cerebral artery occlusion(MCAO)BALB/c mouse models(male,18 ~22 g),We applied Western blot,immunoprecipitation(IP)and immunohistochemisty to determine the effect of cPKCγ activation on CRMP2 hydrolysis and phosphorylation,cPKCγ-CRMP2 interaction and p-CRMP2 positive cells'number in the peri-infarct region of MCAO mice.ResultsHPC inhibited the decrease of p-CRMP2 level and the increase of BDP in peri-infarct region of ischemic cortex.Pretreatment of cPKCγ inhibitor Go6983(6nmol/L)could depress the HPC-induced inhibitory effect on CRMP2 dephosphorylation and hydrolysis in peri-infarct area of ischemic cortex;IP results showed that the activity of cPKCγ could affect the interaction between cPKCγ and CRMP2;in addition,the immunohistochemistry results also demonstrated the same effect of cPKCγ on p-CRMP2 positive cells in peri-infarct region of ischemic cortex.ConclusionscPKCγ is involved in the regulation of HPC on CRMP2 phosphorylation and hydrolysis in ischemic cortex of MCAO mice.
HPC;middle cerebral artery occlusion;cPKCγ;CRMP2
R339.5
A
1001-6325(2012)01-0025-06
2011-10-09
2011-11-23
国家自然科学基金(30871219,31071048,31171147);973计划前期专项(2011CB512109);教育部高等学校博士点科研基金(20091107110001);北京市属高等学校人才强教深化计划创新人才资助(PHR 200906116)

