AngⅡ促进大鼠血管平滑肌细胞增殖和迁移
刘 玉,王海军,温进坤,李爱英,李菁菁,韩 梅*
(河北医科大学1.基础医学研究所生物化学与分子生物学研究室河北省医学生物技术重点实验室,河北石家庄 050017;2.中医学院生物化学与分子生物学教研室,河北石家庄 050091;3.基础医学院细胞生物学教研室,河北石家庄 050017;4.河北大学附属医院普通外科,河北保定 071000)
AngⅡ促进大鼠血管平滑肌细胞增殖和迁移
刘 玉1,2,王海军4,温进坤1,李爱英2,李菁菁3,韩 梅1*
(河北医科大学1.基础医学研究所生物化学与分子生物学研究室河北省医学生物技术重点实验室,河北石家庄 050017;2.中医学院生物化学与分子生物学教研室,河北石家庄 050091;3.基础医学院细胞生物学教研室,河北石家庄 050017;4.河北大学附属医院普通外科,河北保定 071000)
血管平滑肌细胞(vascular smooth muscle cells,VSMCs)的增殖、迁移和细胞外基质的合成是高血压、动脉粥样硬化和血管成形术后再狭窄等血管重塑性疾病发生、发展的重要细胞病理学基础[1]。血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)的促生长作用参与了高血压、动脉粥样硬化、血管再狭窄等血管增殖性疾病的发生和发展。本实验观察AngⅡ对VSMCs细胞增殖及迁移的影响,进一步阐明血管增殖性疾病的发病机理,为临床防治提供理论依据。
1 材料与方法
1.1 细胞培养与试剂:80~100 g健康雄性SD大鼠,取胸腹主动脉血管中膜用贴块法分离、培养VSMCs[2]。取3~6代细胞进行实验。待细胞生长至70%~80%汇合后换用无血清培养液饥饿培养16 h,使细胞处于静止期,然后换用含2%FBS 的 培 养 液,分 别 加 入 不 同 浓 度 (10-8、10-7和10-6mol/L)的 AngⅡ(Sigma公司)孵育24 h,或10-7mol/L的AngⅡ孵育不同时间 (3、6、12、24和48 h),收集细胞用于实验。
1.2 细胞增殖活力分析:利用细胞计数方法进行细胞增殖活性分析[3]。
1.3 伤口愈合实验:将VSMCs接种于玻片上,于低倍镜下观察细胞伤口愈合情况。任意取3个视野,计数迁移细胞的数量,以此表示细胞的迁移活性。
1.4 总RNA提取及RT-PCR:按照Invitrogen公司的产品手册,采用 Trizol一步法,从不同处理组的 VSMCs中提取总RNA。经1%琼脂糖凝胶电泳鉴定RNA完整性,紫外分光光度计检测RNA的纯度和浓度。按照Promega公司M-MLV反转录酶试剂盒说明书进行反转录反应。继之,建立PCR反应体系,置PCR仪上进行扩增。PCR扩增产物用1%琼脂糖凝胶电泳分离,扫描成像,用凝胶成像分析系统进行密度分析。以β-actin作为内参照。
2 结果
2.1 AngⅡ对VSMCs增殖和迁移的影响:随着AngⅡ浓度增加,VSMCs增殖和迁移不断升高(图1)。其中,AngⅡ浓度为10-7mol/L时细胞增殖和迁移明显升高(图1A,C),在此基础上,选取10-7mol/L AngⅡ处理细胞,随着刺激时间的延长,VSMCs增殖和迁移逐渐升高(图1B,D)。具有明显的量-效和时-效关系。
2.2 AngⅡ对VSMCsSM22α和PCNAmRNA表达的影响:随着AngⅡ浓度增加,SM22α mRNA表达逐渐降低,在10-7mol/L时明显降低(P<0.01),随着AngⅡ刺激时间延长,SM22α表达逐渐降低,在12 h时降低较为显著(P<0.01)(图 2)。与SM22α的表达变化相反,PCNA表达在10-7mol/L时明显增高(P<0.01)(图2A)。PCNA表达在24 h明显升高(P<0.01)(图2B)。
3 讨论
VSMCs的增殖和迁移是导致许多心血管疾病的重要的病理学基础。生理条件下VSMCs存在着有序的增殖与凋亡,二者保持平衡。在许多病理情况下,外界环境造成某些生长因子增多,继而通过刺激信号转导网络,促进某些基因表达增多,从而使VSMCs的增殖失控,导致血管壁一系列的病理改变。因此,抑制VSMCs的增殖是有效治疗动脉粥样硬化、高血压与血管再狭窄等心血管疾病的重要措施之一。
本研究发现,AngⅡ刺激可诱导VSMCs发生表型转化,以浓度和时间依赖的方式促进VSMCs增殖。伤口愈合实验结果显示,AngⅡ同样以浓度和时间依赖的方式促进VSMCs的迁移活性,促进其向血管内膜下迁移。
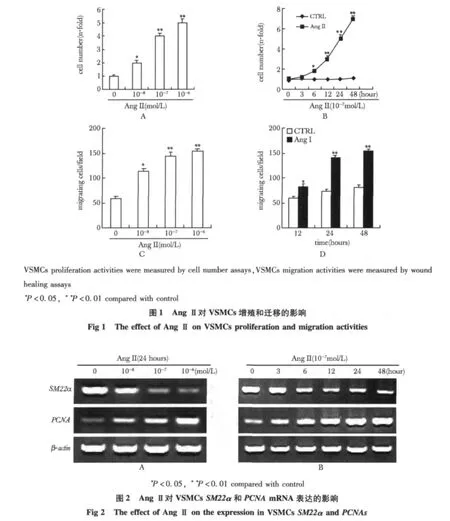
本研究采用RT-PCR方法,在转录水平证实,AngⅡ可抑制VSMCs分化标志基因SM22α的表达,同时促进增殖标志基因PCNA的表达,并且具有明显的浓度和时间依赖效应。
以上结果表明,AngⅡ可以通过影响VSMCs分化标志基因SM22α和增殖标志基因PCNA的表达而促进VSMCs增殖和迁移。本研究为揭示VSMCs增殖的发生机制,防治血管重塑和逆转增殖性血管病变具有重要的意义。
[1]Li HX,Han M,Michel B,et al.Krüppel-like factor 4 promotes differentiation by transforming growth factor-β receptor-mediated smad and P38 MAPK signaling in vascular smooth muscle cells[J].J Biol Chem,2010,285:17846-17856.
[2]Han M,Wen JK,Zheng B,et al.Serum deprivation results in redifferentiation of human umbilical vascular smooth muscle cells[J].Am J Physiol Cell Physiol,2006,291:C50-C58.
[3]Bishop-Bailey D,Hla T,Warner TD.Intimal smooth muscle cells as a target for peroxisome proliferator-activated receptor-gamma ligand therapy[J].Circ Res,2002,91:210-217.
R 3
A
1001-6325(2012)01-0089-03
2010-11-02
2011-05-30
国家自然科学基金(31071003);国家自然科学基金(青年基金)(30700405)*< class="emphasis_bold">通信作者(corresponding author):
(corresponding author):hanmei@hebmu.edu.cn
book=91,ebook=144

