4种猪瘟病毒抗体检测方法的比较
马超英
(青海省海西州乌兰县铜普兽医站,青海乌兰 817000)
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起猪的一种高度接触性、致死性的传染病,临床上主要以稽留高热、皮肤和黏膜出现大量出血点为主要特征[1]。猪瘟具有高度传染性,主要通过呼吸道和消化道传染,传播速度快,发病率和病死率高,给全球养猪业造成了巨大的经济损失,世界动物卫生组织(OIE)将其列为必须报告的动物传染病,我国也将其列为一类动物疫病,是严重危害我国养猪业的最重要的疫病之一[2-6]。近年来,我国猪瘟的流行和发病特点发生了很大变化,转变为隐性感染和亚病毒感染,在临床表现上也更加复杂,既有区域性流行,又有零星散发,既有高病死率的急性症状,又有持续感染的温和性症状趋于复杂化,出现了所谓“非典型猪瘟”、“温和型猪瘟”和“带毒母猪综合征”,在病理剖检上也常常不同于典型猪瘟的病理变化,给兽医临床诊断带来了很大困难[7]。目前,猪瘟的诊断方法主要包括病毒的分离与鉴定、血清学方法及分子生物学检测方法[8]。尽管血清学方法很难有效区分疫苗毒与野毒产生的抗体,但由于其具有使用方便、一次检测量大和血清容易保存等优点而被广泛应用,在猪瘟流行状态的监测和流行病学调查等方面有着重要的作用,也是免疫猪群抗体水平监测的主要方法,对疫苗免疫效果评价及免疫程序的制定均具有重要意义[9-11]。本研究应用正向间接血凝试验(IHA)、间接ELISA、Dot-ELISA、胶体金免疫层析试纸条(GICA)4种方法分别对142份猪血清样品进行检测,分析比较4种猪瘟病毒抗体检测方法的阳性检出率及敏感性,寻找适合基层兽医部门应用的抗体检测方法,为我国猪瘟的综合防控提供参考。
1 材料与方法
1.1 材料
1.1.1 试剂盒与血清 猪瘟病毒正向间接血凝试验抗体检测试剂盒购自中国农业科学院兰州兽医研究所;猪瘟病毒抗体Dot-EIISA检测试剂盒购自中国农业科学院哈尔滨兽医研究所;猪瘟病毒抗体间接ELISA检测试剂盒购自深圳市绿诗源生物技术有限公司;猪瘟病毒抗体金标检测卡购自深圳市康百得生物科技有限公司;检测用血清样品142份由鲁北兽医诊断中心实验室收集并保存。
1.1.2 主要仪器 8道加样器为Eppendorf公司产品;酶标仪(Model 680)为Bio-Rad公司产品。
1.2 方法
按照4种试剂盒说明书提供的方法(正向间接血凝试验(IHA)、间接 ELISA、Dot-ELISA、胶体金免疫层析试纸条(GICA))分别检测142份血清样品。
2 结果
如表1所示,142份血清样品经猪瘟病毒抗体间接ELISA检测出阳性119份,阳性率为83.8%;猪瘟正向间接血凝试验(IHA)检测出阳性117份,阳性率为82.4%;猪瘟病毒抗体Dot-EIISA检测出阳性115份,阳性率为81.0%;猪瘟病毒抗体胶体金试纸条(GICA)检测出阳性109份,阳性率为76.8%。
如表1所示,4种检测方法检测结果相同样品数为124份,总符合率达87.3%(124/142)。对检测结果不相同的18份血清样品进行比较分析,如表2所示,其中编号为A、B、C的9份血清样品符合间接ELISA、IHA、Dot-ELISA、GICA 阳性检出率(敏感性)由高到低的顺序。编号为D、E的共计6份血清样品分别经IHA和Dot-ELISA检测为阳性,间接ELISA检测为阴性;而编号为F、G的共计2份血清样品分别经IHA和Dot-ELISA检测为阴性,其余的检测方法检测为阳性,造成以上现象的主要原因可能是检测方法所用的抗原不同,IHA和Dot-ELISA采用全病毒作为抗原,间接ELISA采用基因工程重组蛋白作为抗原。由于全病毒抗原制备过程繁琐、受病毒纯化方面的限制,纯化效果较差,试验的稳定性和重复性均较差,往往导致假阳性和假阴性结果的产生。编号为H的1份血清样品经ELISA和Dot-ELISA检测为阳性,IHA和GICA检测为阴性,可能是由于血清分离的质量和试验操作造成了这一现象,但这一现象的出现率仅为0.70%(1/142),也在试验误差允许的范围内。
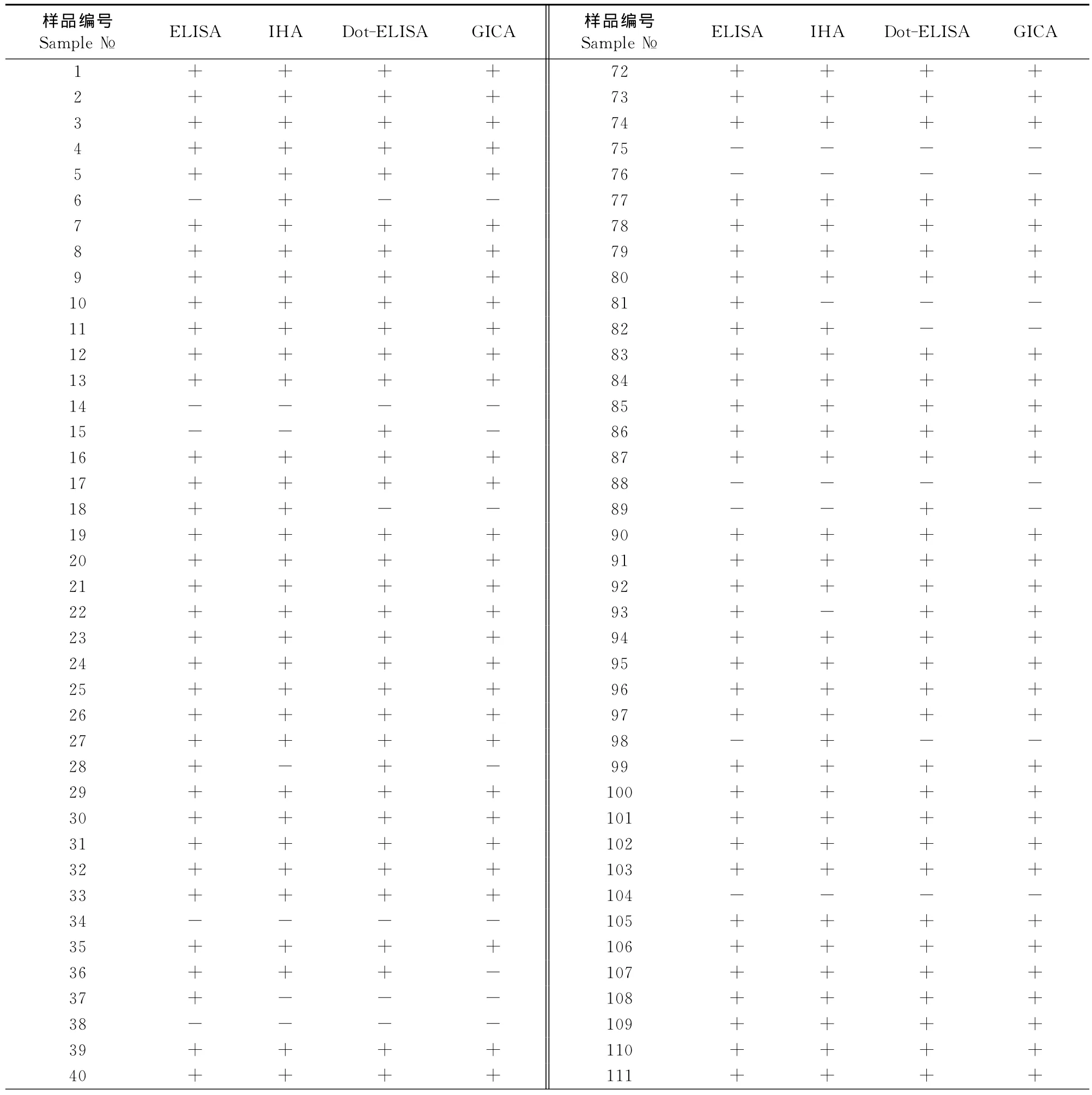
表1 4种检测方法检出阳性样品数比较Table 1 Comparative detection of four detection methods in clinical samples

(续表1)
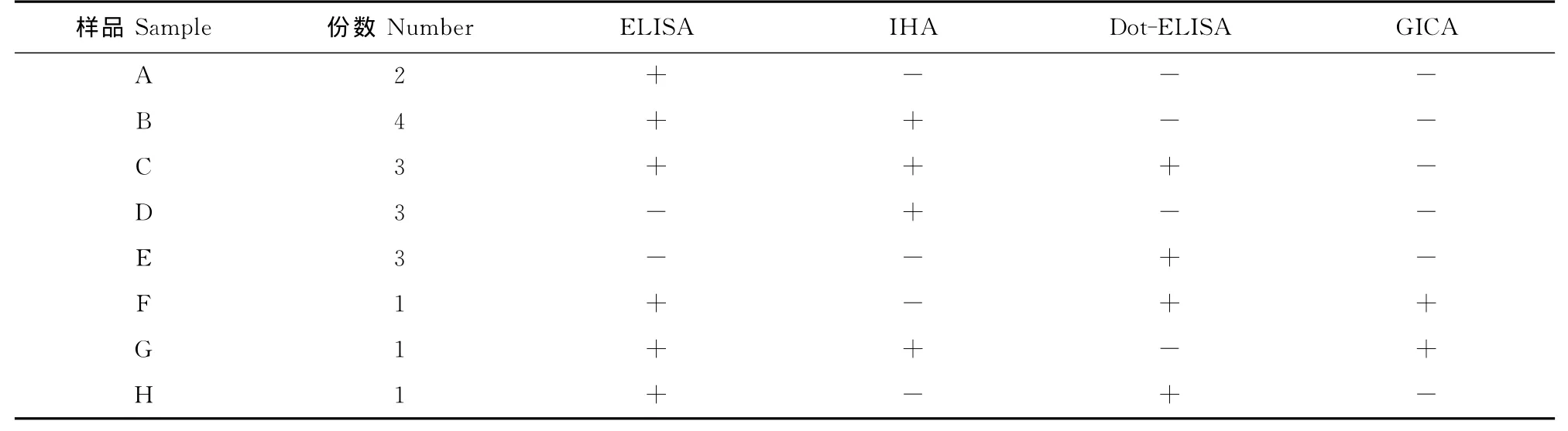
表2 检测结果不同的血清样品统计比较Table 2 Comparison of different results of serum samples detected by 4methods
3 讨论
在猪瘟病毒的抗体检测方法中,中国农业科学院兰州兽医研究所的正向间接血凝试剂盒被农业部推荐为猪瘟疫苗抗体检测的主要方法,也是我国猪瘟抗体检测的经典方法,在国内得到了广泛应用,为我国猪瘟的综合防控做出了巨大贡献,但该方法存在敏感性低,检测血清样品需经过灭活处理,增加了检测时间和检测难度,且血清的质量将严重影响检测结果,肉眼判读、误差大等缺点,不适合用于流行病学调查和规模化猪场的大范围、大面积检测,不适合在基层兽医部门广泛使用。
间接ELISA和Dot-ELISA方法因其具有微量、敏感、特异、高通量的优点,在猪瘟病毒的抗体水平检测上具有巨大的发展空间和广阔的应用前景,可用于规模化猪场免疫的抗体水平监测。间接ELISA和Dot-ELISA二者具有较高的符合率93.0%(132/142),间接 ELISA 敏感性略高于 Dot-ELISA,间接ELISA方法因其操作过程较繁琐,对操作人员要求专业性较高,适合于具有基本实验条件的基层实验室。Dot-ELISA因其不需要酶标仪等仪器设备,适用于基层兽医部门广泛使用。
胶体金试纸条特异性强、灵敏度高、检测反应时间短、操作简便、操作人员不需培训、样品不需预处理、无需特殊仪器设备、特别适合于基层兽医部门和规模化养殖场的快速诊断,为基层兽医部门和广大养殖户提供了简单、特异、敏感、快速的诊断方法。
本研究用4种方法同时检测142份血清样品,间接ELISA的敏感性最高,检测阳性样品119份;正向间接血凝次之,检出阳性样品117份;胶体金试纸条最低,检测阳性样品109份。当然,不排除存在假阳性问题,但在流行病学调查中,间接ELISA等敏感性高的检测方法存在明显的优势。在对18份检测结果不同的血清样品进行比较分析时发现,IHA和Dot-ELISA由于使用全病毒作为诊断抗原,受病毒培养、纯化方面的限制,导致IHA和Dot-ELISA的稳定性和重复性均较差,而间接ELISA采用基因工程重组蛋白作为诊断,这种人工抗原是病毒本身特定的蛋白成份,只能与该病毒特定成份所诱生的抗体发生反应,使间接ELISA的特异性和敏感性均较高。
[1]Moennig V,Floegel-Niesmann G,Greiser-Wilke I.Clinical signs and epidemiology of classical swine fever:a review of new knowledge[J].Vet J,2003,165(1):1-2.
[2]David D,Edri N,Yakobson B A,et al.Emergence of classical swine fever virus in Israel in 2009[J].Vet J,2011,190(2):146-149.
[3]Nandi S,Muthuchelvan D,Ahuja A,et al.Prevalence of classical swine fever virus in India:a 6-year study (2004-2010)[J].Transbound Emerg Dis,2011,58(5):461-463.
[4]Leifer I,Hoffmann B,Höper D,et al.Molecular epidemiology of current classical swine fever virus isolates of wild boar in Germany[J].J Gen Virol,2010,91(11):2687-2697.
[5]Backer J A,Brouwer H,van Schaik G,et al.Using mortality data for early detection of Classical swine fever in the Netherlands[J].Prev Vet Med,2011,99(1):38-47.
[6]胡永明,赵明秋,陈立军,等.猪瘟病毒感染对猪外周血T淋巴细胞亚群及TNF-α和IFN-γ的影响[J].中国预防兽医学报,2011,33(2):126-129.
[7]董 浩,李 菲,王 鑫,等.猪瘟病毒野毒株与疫苗株酶切检测方法的建立、优化及应用[J].中国畜牧兽医,2011,38(9):187-189.
[8]李 菲,赵立峰,高云航,等.猪瘟分子生物学诊断新进展[J].中国畜牧兽医,2010,37(6):168-170.
[9]Edwards S,Sands J J.Antigenic comparisons of hog cholera virus isolates from Europe,America and Asia using monoclonal antibodies[J].Dtsch Tierarztl Wochenschr,1990,97(2):79-81.
[10]王向鹏,孙 元,杨增岐,等.检测猪瘟病毒野毒株胶体金免疫层析方法的建立[J].中国预防兽医学报,2010,32(6):441-445.
[11]李 娇,王金良,祖立闯,等.猪瘟病毒重组E2蛋白PPAELISA抗体检测试剂盒的研制及应用[J].中国兽医学报,2011,31(10):1390-1394.

