知母皂苷对脂多糖引起星形胶质细胞炎症因子释放的影响及机制
刘 卓,隋海娟,闫恩志,刘婉珠,金 英
(辽宁医学院1.药理学教研室、2.机能实验中心,辽宁 锦州 121001)
星形胶质细胞(astrocyte,AC)是中枢神经系统内体积最大、分布最广泛的胶质细胞,对神经元起支持及分隔作用。同时,AC也是免疫活性细胞,能合成分泌多种神经递质、激素及神经营养因子,维持着神经元内外环境、免疫调节和信号转导等功能[1]。阿尔采末病 (Alzheimer’s disease,AD)的关键性特征之一是脑内炎症,炎症过程是由AC和小胶质细胞释放的细胞因子,如TNF-α和IL-1β,并产生其他细胞因子和神经毒性物质,其中一些炎症因子反过来诱导更多的胶质细胞趋化、活化,另一些则导致局部组织损伤,从而损害神经元。
知母为百合科植物知母的干燥根茎,其中知母皂苷(saponins from anemarrhena asphodeloides bge,SAaB)为知母的主要活性成分,在根茎中含约6%,且种类较多,作用广泛。研究表明SAaB能够明显抑制脂多糖(lipopolysaccharide,LPS)诱导的大鼠小胶质细胞的数目增多以及炎症因子IL-1β和NO的过度释放[2],并且SAaB能对抗淀粉样β蛋白片段25-35引起小鼠腹腔巨噬细胞炎症细胞因子TNF-α和NO的分泌[3-4],提示其有明显的抗炎作用。本研究采用LPS损伤模型,观察SAaB对培养的大鼠乳鼠皮质AC分泌TNF-α和NO的影响,并进一步探讨其调控c-Jun氨基末端激酶(c-Jun N-terminal kinases,JNK)信号转导通路的表达而发挥抗炎效应的可能机制。
1 材料与方法
1.1药品和试剂SAaB由成都普瑞法科技开发有限公司提供,批号S08039,HPLC分析纯度>98%,分子质量为416.64,临用时用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解。DMSO、LPS、DMEM、胰蛋白酶和L-多聚赖氨酸均购自Sigma公司;SP600125购于厦门励远有限公司;新生胎牛血清、HEPES、马血清购于北京华美转导科技有限公司;磷酸化ATF-2抗体(Thr69/71)、磷酸化 JNK1/2抗体(Thr183/Tyr185)和磷酸化c-Jun抗体(Ser63)购于Cell Signaling公司。TNF-α的ELISA试剂盒购于武汉博士德生物科技有限公司;NO检测Griess试剂盒购于碧云天生物技术研究所。
1.2大脑皮层AC的培养取出生1~2 d的Sprague-Dawley(SD)大鼠乳鼠,无菌条件下取出大脑皮层,剔除血管和软脑膜,剪碎后加入0.125%胰蛋白酶37℃消化。待细胞分散后,终止消化。200目筛网过滤、离心,用完全培养基制成细胞悬液,调整细胞密度为1 ×108~1 ×109cells·L-1,接种在75 cm2培养瓶中,置于37℃、5%CO2培养箱中培养。以后每3天换液1次,d 9将培养的AC置于水浴恒温振荡器上,37℃、260 r·min-1、18 h,舍弃含脱落细胞的细胞悬液,以去除少突胶质细胞和小胶质细胞,仍贴壁的细胞大部分为AC。用0.25%胰蛋白酶溶液消化后离心,完全培养基重悬,接种于两个75 cm2培养瓶中以传代。细胞传2~3代后进行实验。
1.3实验分组及给药方法取培养第2~3代AC接种于培养瓶或培养板,置于培养箱中培养3 d,待细胞增殖融合成单层,按加入药物不同分为①对照组:加入0.1%的DMSO;②LPS组:LPS用培养基新鲜配置,终浓度为10 mg·L-1,作用24 h;③ SAaB组:加入不同浓度的 SAaB 1、10、100 μmol·L-1作用1 h后再加入LPS继续作用24 h;④ SP600125组:加入 SP600125 10 μmol·L-1作用1 h 后再加入 LPS共同作用24 h或单独加SP600125作用24 h。
1.4ELISA法测定AC上清液中TNF-α含量AC传2-3代后进行分组,药物处理24 h后,收集细胞培养上清液,按TNF-α检测试剂盒说明书进行操作,在酶标仪上读取不同浓度TNF-α标准品相应的光密度值(A450),绘制出标准曲线,得出直线回归方程。测定各组上清液的光密度值,并代入相应的直线回归方程中,计算出TNF-α的含量。
1.5Griess法测定AC培养上清液中NO含量AC传2~3代后进行分组给药,收集各组细胞培养上清液,1 500 r·min-1,4℃,离心 10 min,分装,-80℃冻存。以NO的稳定性代谢产物——亚硝酸盐作为检测 NO的指标,根据Griess法测定培养液中NO的含量。
1.6Western blot法检测磷酸化JNK、磷酸化c-Jun蛋白表达水平细胞经实验因素处理后,离心收集。放入预冷的裂解缓冲液中,4℃超声粉碎后,12 000×g离心30 min,取上清,用BCA蛋白定量试剂盒进行蛋白定量。用10%~12%的SDS-PAGE分离蛋白质,电泳后将PAGE凝胶中的蛋白质电转移至PVDF膜上,取出后将膜放入3%BSA封闭液中,封闭60 min,再用TBST洗膜3次,每次10 min。将膜放入一抗中(1∶500),4℃孵育过夜。TTBS冲洗后,将膜放入相应二抗(1∶1 000)中,室温孵育1~2 h,漂洗3次。将膜在SuperSignal West Pico底物工作液中孵育5 min,吸干多余试剂,放置化学发光凝胶系统分析仪中进行ECL化学发光,分析结果。以每个条带的Area Density测得值与其相对应的总蛋白的比值表示蛋白的表达水平。实验重复3次。
1.7免疫荧光染色法检测AC的ATF-2表达AC经药物处理后,移去培养基,用冷的PBS漂洗2次。4%多聚甲醛室温固定30 min,PBS漂洗3次,每次10 min。0.3%Triton X-100作用30 min,PBS漂洗3次,每次10 min。3%山羊血清封闭30 min;加入磷酸化ATF-2抗体(1∶100)4℃过夜,PBS漂洗后,加入TRITC标记的二抗作用2 h,PBS漂洗。荧光倒置显微镜下观察,拍照。
1.8统计学处理实验结果数据用±s表示,采用one-way ANOVA和LSD’s post hoc test进行统计学分析。
2 结果
2.1SAaB对LPS诱导AC分泌TNF-α和NO的影响应用ELISA方法和Griess方法分别测定了AC培养液中TNF-α和NO的含量,结果表明LPS(10 mg·L-1)诱导后AC分泌TNF-α和NO明显增加,SAaB(1、10 和 100 μmol·L-1)可明显抑制由LPS诱导AC的TNF-α和NO的分泌。SP600125可对抗LPS诱导AC分泌TNF-α和NO增加,说明LPS诱导的TNF-α和NO产生增加与激活JNK信号转导通路有关,单独应用SP600125对AC正常分泌TNF-α和NO无明显作用(Tab 1)。
Tab 1 Effects of SAaB and SP600125 on LPS-induced release of TNF-α and NO in cultured medium of astrocytes(±s,n=6)

Tab 1 Effects of SAaB and SP600125 on LPS-induced release of TNF-α and NO in cultured medium of astrocytes(±s,n=6)
**P<0.01 vs control group;#P<0.05,##P<0.01 vs LPS group
Group TNF-α/ng·L -1NO/μmol·L -1 Control 1.95 ±0.26 5.78 ±0.94 LPS 11.89 ±1.51** 16.44 ±1.79**LPS+SAaB 1 μmol·L -1 9.86 ±1.12## 13.26 ±1.97#LPS+SAaB 10 μmol·L-1 5.99 ±1.39## 8.73 ±1.49##LPS+SAaB 100 μmol·L-1 3.45 ±0.68## 6.51 ±0.86##LPS+SP600125 10 μmol·L -1 4.23 ±0.41## 7.47 ±0.90##SP600125 10 μmol·L -12.15 ±0.32 5.37 ±0.68
2.2SAaB对AC磷酸化JNK和磷酸化c-Jun蛋白表达水平的影响Fig 1,2显示,LPS作用后,AC磷酸化JNK、c-Jun蛋白表达水平明显增加,SAaB(1、10 和100 μmol·L-1)可明显对抗 LPS 诱导 AC的磷酸化JNK和磷酸化c-Jun蛋白水平增加;但总量JNK(Total-JNK,T-JNK)和总量 c-Jun(Total-c-Jun,T-c-Jun)蛋白表达几乎没有改变。
2.3免疫荧光观察SAaB对LPS引起AC的磷酸化ATF-2表达水平的影响正常对照组AC内几乎没有染色,说明正常情况下AC的磷酸化ATF-2蛋白表达水平极低(Fig 3A);LPS刺激后荧光染色强度明显增加,说明AC的磷酸化ATF-2表达水平明显增加(Fig 3B),SAaB(10 和100 μmol·L-1)能明显抑制LPS的作用,使磷酸化ATF-2表达水平明显降低(Fig 3C、3D),SP600125(10 μmol·L-1)也可明显减少LPS引起AC的磷酸化ATF-2蛋白表达上调(Fig 3E)。
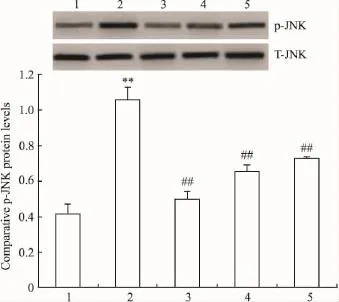
Fig 1 Effects of SAaB on LPS-induced phospho-JNK level in astrocytes in rats by Western blot
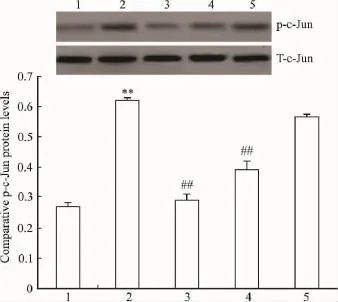
Fig 2 Effect of SAaB on the expression of phospho-c-Jun level in cultured astrocytes in rats by Western blot
3 讨论

Fig3 EffectofSAaB and SP600125 on activating transcription Factor-2(ATF-2)n cultured astrocytes in rats by immunostaining(×400)
在AD患者的脑内发现有明显的胶质细胞反应,老年斑周围有大量活化的AC包裹[5]。研究表明,在病理条件下AC从静息状态快速转化成活化状态,并且其活化具有瀑布效应,活化的AC可分泌大量的细胞炎症介质如IL-1β、IL-6及TNF-α等,这些物质对神经元有毒性作用,使神经元凋亡并坏死[6-7]。革兰阴性菌细胞壁的主要成分LPS可以刺激靶细胞直接分泌炎症因子,更重要的是可以通过信号转导作用,将胞外刺激转入细胞核内,进一步扩大和增强各种炎症因子的作用。现已证实JNK信号转导途径参与了炎症反应中星形胶质细胞活化的过程[8-9],并在细胞炎症反应的病理过程中起着至关重要的作用。JNK又称SAPK,即应激活化蛋白激酶,是丝裂原活化的蛋白激酶家族之一,主要受炎性细胞因子和应激信号的激活引起应激反应,从而导致细胞生长停滞和凋亡。JNK一旦被激活,其双磷酸化功能区Thr-Pro-Tyr与c-Jun N端的活化区结合并使其第63、73位丝氨酸残基磷酸化从而使其活化并转移到细胞核,激活其下游c-Jun,引起级联反应[10-11]。c-Jun是细胞内的一个重要转录因子,细胞遭受凋亡刺激时c-Jun被上游激酶磷酸化激活,上调自身表达同时,活化的c-Jun必须与ATF-2[12]或c-Fos[13]形成复合物才能发挥转录活性。本实验结果中特异性JNK特异性阻断剂SP600125可对抗LPS诱导AC分泌炎症因子TNF-α和NO增加,并且LPS可引起磷酸化JNK、c-Jun以及ATF-2的蛋白表达水平增高,都说明LPS诱导炎症因子分泌的增加与激活JNK信号转导通路有关。
本研究通过LPS造成AC炎症模型,观察到SAaB能够明显减少LPS引起的炎症因子TNF-α和NO分泌增多,同时能下调LPS引起的磷酸化JNK、c-Jun和ATF-2蛋白表达水平,表明了SAaB对星形胶质细胞炎症反应有明显的抑制作用,并且该作用与其下调了JNK信号转导通路有关。已证实SAaB可通过上调脑胆碱能受体[14]、清除自由基、抑制小胶质细胞炎症、抗海马神经细胞凋亡以及增加海马突触相关蛋白的表达[15]等方面明显改善AD模型的学习记忆障碍,本实验通过SAaB抑制AC的炎症作用,为其治疗AD又提供了一条新途径。
[1]Verkhratsky A,Olabarria M,Noristani H N,et al.Astrocytes in Alzheimer's disease[J].Neurotherapeutics,2010,7(4):399 -412.
[2]刘 卓,金 英,刘婉珠,等.知母皂苷对脂多糖引起的大鼠学习记忆障碍和炎症反应的影响[J].中国药理学通报,2010,26(10):1362-6.
[2]Liu Z,Jin Y,Liu W Z,et al.Effects of SAaB on LPS-induced learning and memory disorders and inflammatory reaction in rat hippocampus[J].Chin Pharmacol Bull,2010,26(10):1362 -6.
[3]Liu Z,Jin Y,Yao S Y,et al.Saponins from Anemarrhena asphodeloides Bge protect neurons from amyloid β-protein fragment 25 ~35-induced apoptosis[J].Chin J Pharmacol Toxicol,2006,20(4):295-304.
[4]刘 卓,金 英,隋海娟,等.知母皂苷对Aβ25-35引起的巨噬细胞炎症介质释放的抑制作用及信号转导机制[J].中国药理学通报,2011,27(5):695 -700.
[4]Liu Z,Jin Y,Sui H J,et al.Effect and signaling mechanism of SAaB on the Aβ25-35-induced the release of inflammatory mediators in cultured macrophages[J].Chin Pharmacol Bull,2011,27(5):695-700.
[5]Fuller S,Steele M,Münch G.Activated astroglia during chronic inflammation in Alzheimer's disease-do they neglect their neurosupportive roles[J].Mutat Res,2010,690(1 -2):40 -9.
[6]隋海娟,金 英,潘月星,等.吡格列酮对脂多糖诱导的AC炎性细胞因子释放的影响[J].中国药理学通报,2010,26(9):1226-30.
[6]Sui H J,Jin Y,Pan Y X,et al.Effects of SAaB glitazone on the cultured cortical astrocytes induced by lipopolysaccharide expressions of inflammatory cytokines[J].Chin Pharmacol Bull,2010,26(9):1226-30.
[7]Lee J W,Lee Y K,Yuk D Y,et al.Neuro-inflammation induced by lipopolysaccharide causes cognitive impairment through enhancement of beta-amyloid generation[J].J Neuroinflammation,2008,29(5):37.
[8]Gao Y J,Xu Z Z,Liu Y C,et al.The c-Jun N-terminal kinase 1(JNK1)in spinal astrocytes is required for the maintenance of bilateral mechanical allodynia under a persistent inflammatory pain condition[J].Pain,2010,148(2):309 - 19.
[9]刘 卓,隋海娟,闫恩志,等.吡格列酮对脂多糖刺激的星形胶质细胞白介素-1β的抑制作用及机制[J].中国药理学通报,2012,28(2):266 -9.
[9]Liu Z,Sui H J,Yan E Z,et al.Effects and signaling mechanisms of pioglitazone on the expression of interleukin-1beta induced by lipopolysaccharide in cultured astrocytes in rats[J].Chin Pharm acol Bull,2012,28(2):266 - 9.
[10]Dérijard B,Hibi M,Wu I H,et al.JNK1:a protein kinase stimulated by UV light and Ha-Ras that binds and phosphorylates the c-Jun activation domain[J].Cell,1994,76(6):1025 - 37.
[11]Baltriukiene D,Kalvelyte A,Bukelskiene V.Induction of apoptosis and activation of JNK and p38 MAPK pathways in deoxynivalenoltreated cell lines[J].Altern Lab Anim,2007,35(1):53 - 9.
[12]Yuan Z,Gong S,Luo J,et al.Opposing roles for ATF2 and c-Fos in c-Jun-mediated neuronal apoptosis[J].Mol Cell Biol,2009,29(9):2431-42.
[13]Cerezo-Guisado M I,Alvarez-Barrientos A,Argent R,et al.c-Jun N-terminal protein kinase signalling pathway mediates lovastatininduced rat brain neuroblast apoptosis[J].Biochim Biophys Acta,2007,1771(2):164 -76.
[14]胡雅儿,孙启祥,夏宗勤.ZMS对老年大鼠脑内NGF和BDNF的影响[J].中国药理学通报,2003,19(2):149 -51.
[14]Hu Y E,Sun Q X,Xia Z Q.The effect of ZMS,an active componentof Zhimu,on NGF and BDNF in brains of aged rats[J].Chin Pharmacol Bull,2003,19(2):149 -51.
[15]刘 卓,金 英,隋海娟.知母总皂苷对老年大鼠海马突触相关蛋白表达的影响[J].中国药理学通报,2012,28(3):441 -2.
[15]Liu Z,Jin Y,Sui H J.Effects of Saponins from Anemarrhena asphodeloides Bge on expression of synaptic associated proteins in hippocampus in Aged Rats[J].Chin Pharmacol Bull,2012,28(3):441-2.

