白芍总苷对胶原性关节炎大鼠滑膜β抑制蛋白的影响与其抑制滑膜细胞增殖的关系
吴华勋,陈镜宇,汪庆童,孙妩弋,常 艳,吴育晶,张玲玲,魏 伟
(安徽医科大学临床药理研究所,抗炎免疫药理学教育部重点实验室,安徽省中药研究与开发重点实验室,抗炎免疫药物安徽省工程技术研究中心,安徽合肥 230032)
类风湿关节炎(rheumatoid arthritis,RA)是一种以关节滑膜炎症为主要病理表现的慢性、系统性、自身免疫性疾病[1]。白芍总苷(total glucosides of paeony,TGP)是从白芍干燥根中提取的有效部位,研究表明[2-3],TGP可以抑制关节炎大鼠滑膜细胞增殖,调节免疫功能,在临床上治疗类风湿关节炎已经发挥了重要作用。滑膜炎的核心问题之一是滑膜细胞异常增殖,尽管对其的原因研究较多,涉及到多个细胞因子的作用以及 NF-κB、MAPKs信号的参与等,但G蛋白偶联信号在其中的作用较明显。研究发现,G蛋白-AC-cAMP信号通路介导了实验性关节炎大鼠滑膜细胞的异常增殖,TGP能明显抑制实验性关节炎大鼠滑膜组织中Gi的表达,促进Gs的表达,提高细胞内cAMP水平,从而降低滑膜细胞的增殖与分泌[4-6]。
G蛋白偶联受体(G-protein-coupled receptors,GPCRs)是最大的膜蛋白家族,是重要的药物作用靶点,在炎症免疫应答中起着重要的信号转导作用[7]。β抑制蛋白分为β抑制蛋白1、2两种亚型,广泛存在于各种细胞中,调节绝大多数GPCRs的活性,促进GPCRs内化和脱敏[8]。其中β抑制蛋白1在胞质和胞核中都有表达,除参与GPCRs的调节,还可能通过核内功能调节自身免疫病;而β抑制蛋白2仅在胞质中表达,还参与了肿瘤坏死因子受体、TLR/IL-1R/RANK等信号通路的调节[9]。研究发现[10],在胶原性关节炎(collagen-induced arthritis,CIA)大鼠滑膜组织中β抑制蛋白2表达在致炎后d 21、d 28明显增加,d 28达到峰值,与病程发展有相关性,可能与其影响G蛋白-cAMP信号通路发生异常改变有关。另有文献报道,采用β抑制蛋白2基因敲除小鼠,诱导造模,结果发现β抑制蛋白2基因敲除小鼠影响了关节炎的严重程度,这与其对滑膜细胞炎症的调整有关[11]。TGP对滑膜β抑制蛋白表达的影响是否与其抑制滑膜细胞增殖作用相关,未见文献报道。本文主要探讨TGP对CIA大鼠滑膜β抑制蛋白1、2表达的影响与其抑制滑膜细胞增殖的关系,旨在进一步揭示TGP治疗作用的分子机制。
1 材料与方法
1.1动物Sprague-Dawley(SD)大鼠,体质量(120±20)g,♂,由安徽医科大学动物实验中心提供,合格证号:皖医实动准字第01号。
1.2药物与试剂TGP:棕色粉末,由亳白芍干燥根提取、纯化后得到;由安徽医科大学临床药理研究所化学室提供,给药时以质量浓度5 g·L-1羧甲基纤维素钠配制成所需浓度;雷公藤多苷(GTW),上海复旦复华药业有限公司,实验时均以质量浓度5 g·L-1羧甲基纤维素钠配制成所需浓度;卡介苗(BCG):卫生部上海生物制品所产品,用前80℃灭活;鸡Ⅱ型胶原(CCⅡ):上海本草生物医学工程所;羊抗β抑制蛋白1抗体(K16,sc-9182):购于Santa Cruz公司;小鼠抗 β抑制蛋白2抗体 (H-9,sc-13140):购于Santa Cruz公司;辣根酶兔抗山羊IgG(H+L),辣根酶山羊抗小鼠IgG(H+L)购于北京中杉公司;β-actin选购于Sigma公司;
1.3方法
1.3.1大鼠CIA模型的建立将 CCⅡ溶于0.1 mol·L-1的冰醋酸中,浓度为 0.4 g·L-1,将研钵置于冰袋上,研磨CCⅡ至充分溶解,置4℃冰箱过夜;再将80℃、1 h灭活的BCG溶于液体石蜡中,配成0.4 g·L-1的完全弗氏佐剂(CFA),将二者等体积混合、乳化,制成CCⅡ乳剂(即每1 ml中含0.2 mg CCII)。将该乳剂于大鼠的足爪、背部、尾根部多点皮内注射致炎(1 ml/只)。注射致炎后d 7,再用上述CⅡ乳剂背、尾部皮内注射加强(1 ml/只)。正常组用生理盐水同法注射。
1.3.2实验分组和给药方案SD大鼠随机分为6组:正常对照组,CIA模型组,TGP低、中、高剂量组(25、50、100 mg·kg-1)和阳性对照组(GTW 40 mg·kg-1)。各用药组于致炎后d 14~28 ig给药,qd,正常对照组和CIA模型组ig等容量的5 g·L-1羧甲基纤维素钠。
1.3.3关节炎指数(arthritis index,AI)评分致炎后d 14、d 20、d 28观察并记录大鼠全身关节病变情况,每只足趾按下列标准评分:0分:正常;1分:踝关节出现红斑和轻微肿胀;2分:踝关节到趾关节或掌关节红斑和轻微肿胀;3分:踝关节到跖趾关节或掌关节红斑和中度肿胀;4分:踝关节到趾关节出现红斑和重度肿胀。未注射胶原的其余3个关节的评分累计之和即为每只大鼠的AI。
1.3.4滑膜细胞增殖反应的测定采用MTT法。体内给药各组大鼠滑膜细胞经培养后,制备细胞悬液(5 ×109cells·L-1),加至96孔培养板,每孔100 μl,设6 个复孔,再加入 100 μl含 8 mg·L-1LPS 的DMEM培养液,置于37℃、5%CO2培养箱培养,培养72h,终止培养前4 h各孔加MTT(5 g·L-1)溶液20 μl继续培养,培养结束后弃去上清液,加入DMSO(100 μl/孔),振荡3 min后于酶标仪490 nm波长处测吸光度(absorbance,A值)。以正常大鼠滑膜细胞为对照组,每组以6孔的均值表示其结果。
1.3.5β抑制蛋白表达的测定处死大鼠,取滑膜组织,提取蛋白行SDS-PAGE,转移至PVDF膜后,用质量浓度50 g·L-1脱脂牛奶室温封闭2 h;室温孵育一抗2 h,PBS洗3次,每次10min;室温孵育二抗2 h,PBS洗3次,每次10 min;ECL试剂盒显色。结果采用凝胶成像系统扫描后,以特异性条带浓度与面积的乘积为有效值,反映蛋白表达水平。
1.3.6统计学分析数据分析用SPSS17.0软件处理,数据以表示,组间比较采用t检验。
2 结果
2.1TGP对CIA大鼠关节炎足爪指数评分的影响致炎后d14,对CIA大鼠关节炎指数进行评分,CIA模型大鼠足爪分值不断升高,到d 28达高峰,与足爪肿胀时间一致。TGP(25、50、100 mg·kg-1,d 14 ~28)、GTW(40 mg·kg-1,d 14 ~28)连续灌胃给药14 d,可明显抑制CIA大鼠多发性关节炎评分分值(Tab 1)。
Tab 1 Influence of TGP on arthritis index in CIA rats(±s,n=9)
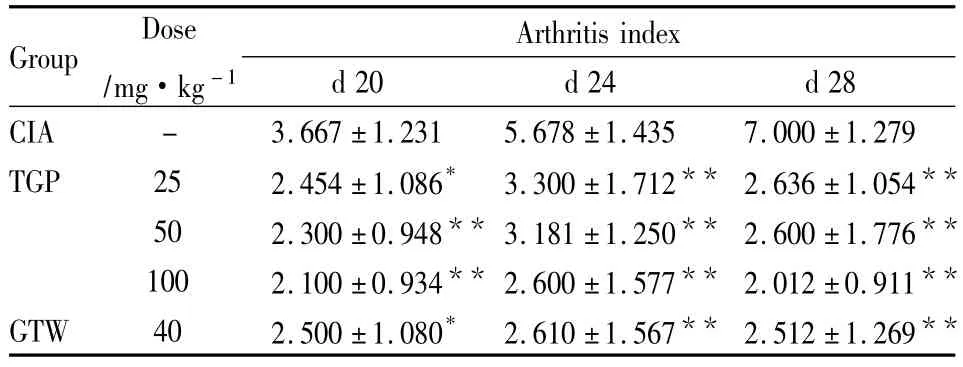
Tab 1 Influence of TGP on arthritis index in CIA rats(±s,n=9)
*P<0.05,**P<0.01 vs CIA group
Group Dose/mg·kg-1 Arthritis index d 20 d 24 d 28 CIA - 3.667 ±1.231 5.678 ±1.435 7.000 ±1.279 TGP 25 2.454 ±1.086* 3.300 ±1.712** 2.636 ±1.054**50 2.300 ±0.948** 3.181 ±1.250** 2.600 ±1.776**100 2.100 ±0.934** 2.600 ±1.577** 2.012 ±0.911**GTW 40 2.500 ±1.080* 2.610 ±1.567** 2.512 ±1.269**
2.2TGP体内用药对CIA大鼠FLS增殖反应的影响末次给药后分离大鼠滑膜组织,经胶原酶-胰蛋白酶消化法分离得到FLS,取第3代FLS,MTT法检测其增殖反应。结果表明,CIA大鼠FLS增殖反应增强,TGP(50、100 mg·kg-1,d 14 ~ 28)和GTW(40 mg·kg-1,d 14 ~28)可不同程度的抑制FLS增殖反应(Tab 2)。
Tab 2 Influence of TGP on synoviocyte proliferation in CIA rats(±s,n=6)

Tab 2 Influence of TGP on synoviocyte proliferation in CIA rats(±s,n=6)
#P<0.05 vs normal;*P<0.05,**P<0.01 vs CIA.
Group Dose/mg·kg-1 Synoviocyte proliferation(A)Normal - 0.110 ±0.020 CIA - 0.163 ±0.037#TGP 25 0.136 ±0.034 50 0.116 ±0.023*100 0.107 ±0.017**GTW 40 0.112 ±0.020*
2.3TGP体内用药对滑膜组织β抑制蛋白表达的影响大鼠致炎后d 28处死,分离滑膜组织,用Western blot法检测滑膜组织中β抑制蛋白1、2表达水平。结果表明,与正常组相比,模型组β抑制蛋白2表达明显升高,β抑制蛋白1无明显变化;TGP(100 mg·kg-1)能明显减少致炎后β抑制蛋白2的表达,而对β抑制蛋白1表达无明显影响(Fig 1)。
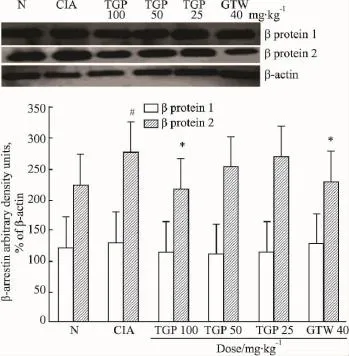
Fig 1 Effects of TGP on expression of β-arrestins in synovial tissue of CIA rats(±s,n=4)
2.4TGP对CIA大鼠滑膜β抑制蛋白表达的影响与其抑制滑膜细胞增殖作用相关性分析TGP对β抑制蛋白1表达无影响,故主要分析TGP对CIA大鼠滑膜β抑制蛋白2表达的影响与其抑制滑膜细胞增殖作用的相关性。经相关性分析,TGP对CIA大鼠滑膜β抑制蛋白2表达的影响与其抑制滑膜细胞增殖作用呈高度相关(r=0.88),随着TGP浓度的增加,其下调β抑制蛋白2表达的作用增强,抑制滑膜细胞增殖作用增加,逐渐趋于正常组的β抑制蛋白2表达水平及滑膜细胞增殖状态(Fig 2)。
3 讨论
G蛋白偶联信号转导通路的异常在炎症免疫性疾病进程中起重要作用[12],其中GPCRs-G蛋白-cAMP信号通路参与多种生理活性的调节,包括对细胞增殖与分化的调节。细胞的异常增殖、快速分化等与细胞内的cAMP改变有关,cAMP水平增高可抑制细胞的增殖效应。
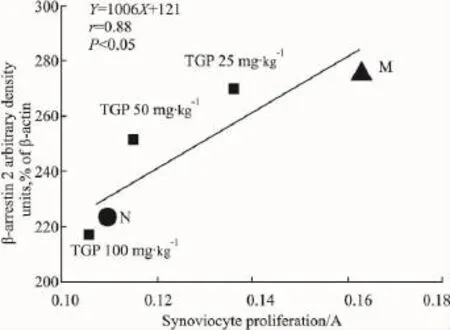
Fig 2 Correlation analysis between effects of TGP on expression of β-arrestin 2 and on synoviocyte proliferation(A)
β抑制蛋白是GPCR信号的负调控者,与G蛋白偶联受体激酶(G-protein-coupled receptors kinases,GRKs)协同促进GPCRs内化和脱敏。β抑制蛋白的功能变化将影响GPCRs介导的信号转导的效应[13],从而可能影响 cAMP水平及细胞的增殖活性。另外,β抑制蛋白可通过调节 NF-κB、MAPKs信号通路参与许多炎症免疫性疾病的发病过程。
本实验研究发现,CIA大鼠滑膜β抑制蛋白2表达升高,TGP对CIA大鼠滑膜β抑制蛋白2表达的影响与其抑制滑膜细胞增殖作用呈高度相关。本课题组以往研究也发现,在CIA大鼠滑膜细胞中GRKs的表达在炎症高峰期上调,与病程发展有相关性[14]。根据相关实验结果,我们推断关节炎症期间,各种致炎细胞因子水平升高,长期或反复刺激后,可能引起β抑制蛋白2自身保护性的表达上调,以促进GPCRs与G蛋白脱偶联,从而关闭了一些通过GPCRs的信号通路,导致G蛋白-cAMP信号通路发生异常改变,cAMP水平下降。TGP能下调β抑制蛋白2的表达,降低其对GPCRs与G蛋白的脱偶联作用,恢复G蛋白-cAMP信号通路,从而发挥抑制滑膜细胞增殖,治疗关节炎的作用。
此外,在RA中NF-κB是明显活化的,它在RA炎症、骨质破坏、细胞的增殖、血管翳的形成中起重要作用,β抑制蛋白表达的上调可以明显抑制NF-κB活化;MAPKs在RA滑膜组织中表达升高,β抑制蛋白2可以作为支架蛋白,促进MAPKs通路的活化[10];β抑制蛋白对这些通路的调整也可能参与了RA的发病过程,在下一步的工作中将进一步探讨。
[1]Bax M,van Heemst J,Huizinga T,et al.Genetics of rheumatoid ar-thritis:what have we learned[J]?Immunogenetics,2011,63(8):459-66.
[1]朱 蕾,魏 伟.白芍总苷对大鼠胶原性关节炎及其免疫功能的影响[J].中国药学杂志,2007,42(20):1547 -51.
[2]Zhu L,Wei W.Effects of total glucosides of paeony on immune functions in rats with collagen-induced arthritis[J].Chin Pharm J,2007,42(20):1547 -51.
[3]Xu H M,Wei W,Jia X Y,et al.Effects and mechanisms of total glucosides of paeony on adjuvant arthritis in rats[J].Ethnopharmacol,2007,109(3):442 -8.
[4]Chen Q,Wei W.Effects and mechanisms of glucosides of chaenomeles speciosa on collagen-induced arthritis in rats[J].Int Immunopharmacol,2003,3:593 -608.
[5]Zhang L L,Wei W,Wang N P,et al.Paeoniflorin suppresses inflammatory mediator production and regulates G protein-coupled signaling in fibroblast-like synoviocytes of collagen induced arthritic rats[J].Inflamm Res,2008,57:388 -95.
[6]常 艳,魏 伟,张 磊,徐红梅.白芍总苷对IL-1β诱导胶原性关节炎大鼠成纤维样滑膜细胞功能的影响[J].中国药理学通报,2007,23(2):185 -8.
[6]Chang Y,Wei W,Zhang L,Xu H M.Effects of TGP on functions of fibroblast-like synoviocytes under the stimulation of IL-1β in CIA rats[J].Chin Pharmacol Bull,2007,23(2):185 - 8.
[7]Hutchings C J,Koglin M,Marshall F H.Therapeutic antibodies directed at G protein-coupled receptors[J].MAbs,2010,2(6):594-606.
[8]Vibhuti A,Gupta K,Subramanian H,et al.Distinct and shared roles of β-arrestin-1 and β-arrestin-2 on the regulation of C3a receptor signaling in human mast cells[J].PLoS One,2011,6(5):e19585.
[9]Ma L,Pei G.Beta-arrestin signaling and regulation of transcription[J].J Cell Sci,2007,120(2):213 -8.
[10]吴华勋,陈镜宇,严尚学,等.胶原性关节炎大鼠滑膜组织βarrestin 1和β-arrestin 2的表达[J].安徽医科大学学报,2008,43(2):648-50.
[10]Wu H X,Chen J Y,Yan S X,et al.The expression of beta-arrestin 1 and beta-arrestin 2 in the synovium of collagen-induced arthritis rats[J].Acta Univ Med Anhui,2008,43(2):648 - 50.
[11]Li P,Cook J A,Gilkeson G S,et al.Increased expression of betaarrestin 1 and 2 in murine models of rheumatoid arthritis:isoform specific regulation of inflammation[J].Mol Immunol,2011,49(1-2):64-74.
[12]吴 虹,宋礼华,魏 伟.与类风湿关节炎相关的G蛋白偶联受体及治疗药物作用靶点[J].中国药理学通报,2006,22(9):1048-53.
[12]Wu H,Song L H,Wei W.G protein.coupled receptor and drug targets for therapy in rheumatoid arthritis[J].Chin Pharmacol Bull,2006,22(9):1048 -53.
[13]Dromey J R,Pfleger K D.G Protein coupled receptors as drug targets:the role of beta-arrestins[J].Endocr Metab Immune Disord Drug Targets,2008,8(1):51 -61.
[14]陈镜宇,吴华勋,陈 尹,等.胶原性关节炎大鼠滑膜组织G蛋白偶联受体激酶的表达及白芍总苷对其的影响[J].中国药理学通报,2008,24(6):715 -7.
[14]Chen J Y,Wu H X,Chen Y,et al.Expression of GRKs in synovial tissue from rats with collagen-induced arthritis and the effect of total glucosides of paeony[J].Chin Pharmacol Bull,2008,24(6):715-7.

