家蚕G蛋白α亚基基因BmGα73B原核表达及其表达条件优化
汤 强 方 玲 章玉萍
(1芜湖职业技术学院,安徽芜湖 241003;2安徽省农业科学院蚕桑研究所,安徽合肥 230061)
家蚕G蛋白α亚基基因BmGα73B原核表达及其表达条件优化
汤 强1方 玲1章玉萍2
(1芜湖职业技术学院,安徽芜湖 241003;2安徽省农业科学院蚕桑研究所,安徽合肥 230061)
通过RT-PCR技术从家蚕中扩增出G蛋白α亚基基因BmGα73B的cDNA,克隆至原核表达载体pET-41b(+)中,所获得的重组质粒经酶切鉴定后,将其转化至E coli BL21诱导表达,用SDS-PAGE与Western blot对表达产物进行鉴定。结果表明,通过RT-PCR扩增获得长度为1 158 bp的蛋白基因,诱导表达重组质粒pET-41b(+)-Gα73B,经SDS-PAGE检测,IPTGr的终浓度为1 mmol/L时,诱导4 h时蛋白表达量最高,出现分子质量约为73 kD的目的蛋白带,与蛋白的理论值相符。经Western blot检测,表达产物可与GST发生特异性反应。
G蛋白α亚基;BmGα73B;RT-PCR;克隆;原核表达
异三聚体G蛋白(heterotrimeric GTP-binding protein,简称G蛋白)家族在昆虫多种特异的细胞信号传导中起着十分重要的作用,如激素、神经递质、光、药物等特异作用信息都是通过细胞膜受体与G蛋白偶联,从而传递至细胞内,产生各式各样的生理反应[1-2]。G 蛋白是由 α、β和 γ3个亚基组成,在自然状态下,β与γ亚基始终以二聚体的形态结合在一起,并通过γ亚基定位于细胞质膜上,只有在变性条件下才能分开。根据G蛋白的结构、氨基酸序列及其进化相似性和功能等可将其分为Gs、Gi、Gq和G12这4个家族[3]。其调节的下游效应器有腺苷酸环化酶,cGMP磷酸二脂酶,磷酸肌醇3-激酶,PI-PLCP,Na+/H+泵,TUBBY 转录因子,离子通道等[4]。不同的G蛋白能特异地将受体和与之相适应的效应酶偶联起来。
家蚕(Bombyx mori)作为重要的经济昆虫,也是继果蝇(Drosophila melanogaster)之后又一个适用于现代生命科学研究的模式昆虫。目前已有一些关于家蚕G蛋白的研究报道,其中包括对5个G蛋白α亚基基因及其功能的研究[5-7]。家蚕G蛋白亚基基因BmGα73B是一个组织时空特异性表达的基因,在中肠组织中表达量最高,在家蚕的不同发育时期中,转录水平峰值出现在幼虫期,而在预蛹期、蛹后期和成虫期几乎没有表达,BmGα73B基因可能在家蚕生长前期的中肠发育信号转导过程中起着重要的作用[7]。本研究利用RT-PCR技术,将BmGα73B基因成熟肽克隆到pET-41b(+)中,通过构建原核表达载体pET-41b-Gα73B对其进行原核表达,并对表达条件进行了优化,为今后利用基因工程方法研究其功能及活性奠定了基础。
1 材料与方法
1.1 菌种与质粒
pET-41b(+)质粒、宿主菌 E.coli DH5、BL21(DE3),由安徽农业大学安徽省微生物重点防治实验室保存。
1.2 主要试剂
Trizol,购自Invitrogen公司;逆转录试剂盒、质粒小量提取试剂盒、琼脂糖凝胶回收试剂盒,购于上海生工生物工程技术服务有限公司;T4DNA连接酶、Ex-Taq酶、DNA限制性内切酶(EcoRⅠ,BamHⅠ)、DNA Maker(DL 2 000)、低分子量蛋白质 Maker,购自TaKaRa(大连)公司和上海NEB公司;抗6×GST单克隆抗体,购自上海生工生物工程技术服务有限公司;硝酸纤维素膜,购自Sigma公司;其它化学药品均为国产或进口分析纯。
1.3 引物设计
根据编码BmGα73B基因的氨基酸序列,利用软件设计一对特异性引物。斜体碱基为酶切位点,下划线碱基为保护碱基。正向引物BmGα73B-F:5'-C GAATTC TACAATGCGCTTGCTACCCTG-3',反向引物BmGα73B-R:5'-CCC AAGCTTTCAATAAACGCCTATATTATTGAG-3'。
1.4 家蚕总RNA提取和RT-PCR扩增
按Invitrogen Trizol®试剂盒说明提取5龄第1天家蚕幼虫中肠的RNA,然后以RNA为模板,按TOYOBO反转录酶的使用说明进行cDNA第1链的合成。以家蚕cDNA为模板,用引物BmGα73B-F/BmGα73B-R进行PCR扩增,反应条件:94℃ 30 s;55℃ 30 s,72℃ 30 s,30个循环;扩增结束10 min后,4℃保存。PCR产物回收纯化后,进行TA克隆(TaKaRa,pMD18-T载体,大肠杆菌 DH5α),阳性克隆通过鉴定后送Invitrogen公司测序。
1.5 原核表达质粒的构建
用限制性内切酶EcoRⅠ和HindⅢ酶切空质粒pET-41b(+)和pT-Gα73B,分别回收目的片段与线性化载体片段后,用T4DNA连接酶连接12 h,构建融合表达载体pET-41b(+)-Gα73B并转化至大肠杆菌BL21(DE3)。阳性克隆通过鉴定后送Invitrogen公司测序。
1.6 原核表达质粒在大肠杆菌中的诱导表达
将测序正确的阳性克隆接种于含卡那霉素的LB培养液中,37℃振荡培养12 h,按1∶100的比例将培养的菌液加到新鲜的含卡那霉素的LB培养液中,37℃培养至D600nm为0.6~0.8,分别加入异丙基 β-D-硫代半乳糖苷(IPTG)至终浓度为0.01、0.10、0.50、1.00、1.50 和 2.00 mmol/L 进行诱导。此外,在添加相同浓度的 IPTG 诱导的1、2、3、4、5 h内分别取样处理,用12%SDS-PAGE电泳分析。重组pET-41b(+)-Gγ30A菌液10 mL,在 IPTG浓度为0.01 mmol/L、37℃下诱导4 h后,收集菌液13 000 g离心1 min,加入1 mL PBS重悬沉淀,重悬的菌液在冰浴下用超声破碎菌体,离心收集上清和沉淀,分别进行12%SDS-PAGE分析。
1.7 Western blot鉴定融合蛋白
取适量诱导融合蛋白超声破碎后的上清,经SDS-PAGE后,将凝胶上的蛋白转印至硝酸纤维素膜上,利用目的蛋白上的GST标签肽,进行Western blot分析,以未诱导的融合蛋白作为对照。
2 结果与分析
2.1 BmGα73B基因的RT-PCR扩增
RT-PCR产物经琼脂糖凝胶电泳检测,扩出长约1 158 bp片断,与预计的基因大小相符(图1)。

图1 PCR扩增的家蚕G蛋白α亚基BmGα73B基因产物
2.2 重组表达载体的酶切鉴定
阳性克隆经EcoRⅠ、HindⅢ双酶切鉴定,在1 100 bp左右处能切出DNA目的片段,大小与目地蛋白基因一致(图2)。测序结果显示,插入片段为1 158 bp,与开始测序获得BmGα73B基因编码框序列相同,两者同源性为100%。
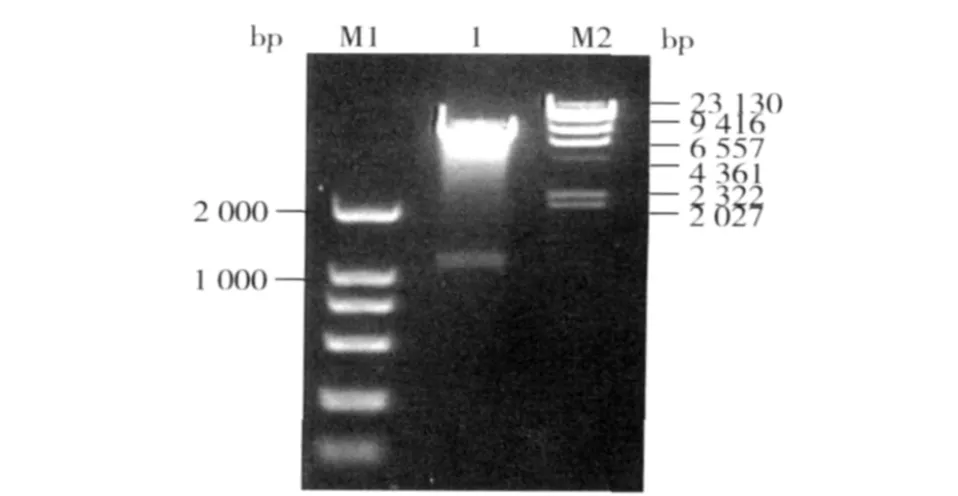
图2 表达载体pET-41b-Gα73B的双酶切鉴定
2.3 重组蛋白的表达
SDS-PAGE显示,经IPTG诱导的pET-41b(+)-Gα73B菌体表达出约38 kD大小特异的融合蛋白条带,与理论预测值相一致,即GST与Gα73B的融合蛋白。随着诱导时间的越来越长,蛋白的表达量也越来越大,当其诱导后4 h时,融合蛋白的表达量最大(图3-A)。工程菌在 IPTG的终浓度分别为0.01、0.10、0.50、1.00、1.50 和 2.00 mmol/L、37 ℃条件下诱导3 h后,结果显示蛋白的表达量没有明显的变化(图3-B)。
2.4 诱导融合重组蛋白的表达方式
诱导后的融合蛋白经超声波破碎、离心,分别取上清和沉淀进行SDS-PAGE,将凝胶上的蛋白转印至硝酸纤维素膜上,利用目的蛋白上的GST标签肽,进行Western blot分析。结果在上清和沉淀中都可检测到目的蛋白,说明该蛋白有可溶性和包涵体2种表达方式(图4)。
2.5 Western blot分析重组蛋白
诱导的重组蛋白破碎后沉淀,进行SDS-PAGE电泳,电转移到Nc膜,Western blot结果显示,重组蛋白可与抗6GST-tag多克隆抗体发生特异性反应,其分子量大小约为73 kD,与实验预期的一致(图5)。
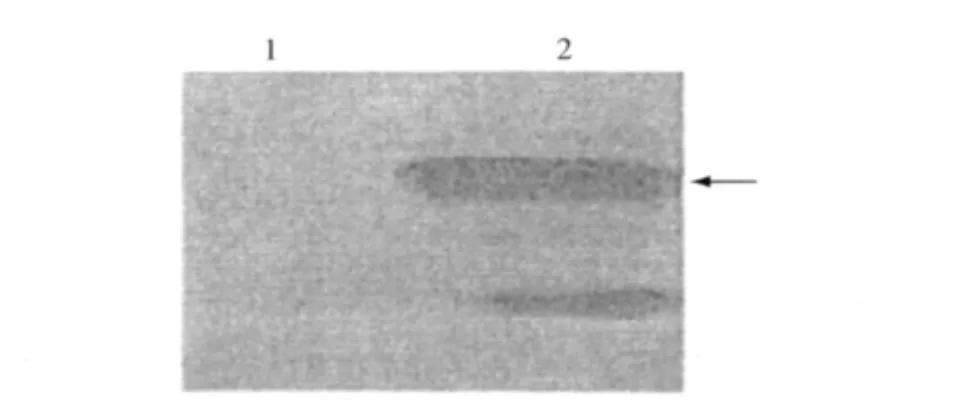
图5 重组菌BL21(DE3)-pET-41b-Ga73B的W estern blot分析
3 讨论
GST基因融合表达系统广泛用于各种融合蛋白的表达,它包含一系列的表达载体,可以在大肠杆菌和酵母菌等宿主细胞中表达,其表达的蛋白质带有GST头部,可利用含有还原型谷胱甘肽的纯化柱进行纯化,得到纯的融合蛋白[8]。本研究成功构建了pET-41b(+)-BmGα73B融合表达载体,转化至感受态E.coli BI21宿主菌细胞中,以IPTG诱导目的蛋白表达,使GST-BmGα73B融合蛋白获得了高效表达。为了进一步验证GST-BmGα73B在大肠杆菌内的表达,用含抗GST的标签对融合蛋白的菌体裂解后的沉淀进行了Western blot印迹分析,结果表明GST-BmGα73B特异地被抗GST的抗体识别,从而证实GST-BmGα73B在大肠杆菌BL21内成功表达。在发酵条件摸索实验中,我们主要是对温度梯度、时间梯度和诱导剂浓度梯度进行分析[9],结果显示工程菌诱导4 h后,融合蛋白表达量最大,而诱导剂浓度对融合蛋白的表达量没有什么影响。
大肠杆菌被内膜和外膜隔开形成胞内、周质和胞外3个部分。根据表达部位的不同可将蛋白在大肠杆菌中的表达形式分为3种:胞外分泌、周质空间表达和胞内表达。胞内表达易形成无活性的包涵体,包涵体是外源基因在大肠杆菌中高效表达时表达产物聚集在一起形成的直径大约0.5~1.0μm的折光小体[10]。由于在重组蛋白表达过程中,大肠杆菌缺乏蛋白折叠过程需要的酶和辅助因子,而无法形成正确的次级键来进行正确折叠,所以包涵体是重组蛋白非天然形式的混合物[11],因此没有生物学活性。包涵体难溶与水,只溶于变性剂如尿素中,必须经过繁琐的变性、复性过程才能得到具有生物学活性的重组蛋白。而周质空间表达,有利于蛋白质的正确折叠,更有可能产生目的蛋白的天然N末端,这对后续的蛋白功能研究工作是极其重要的。提高重组蛋白可溶性表达的方法有选择适合的载体与宿主菌,降低重组蛋白合成的速率,改变培养基成分与分子伴侣或折叠酶供表达、通过替换氨基酸增加可溶性等[12-13]。本研究获得的 GST-BmGα73B主要以包涵体形式存在,后期蛋白纯化研究还需要进一步的探索。
[1]Cabrera-Vera TM,Vanhauwe J,Thomas TO,et al.Insights into G protein structure,function,and regulation[J].Endocr Rev,2003,24(6):765-881.
[2]Neves SR,Ram P T,Iyengar R.G protein pathways[J].Science,2002,296:1 636-1 639.
[3]Downes G B,Gautam N.The G protein subunit gene families[J].Genomics,1999,62(3):544-552.
[4]Assmann SM.Heterotrimeric and unconventional GTP binding proteins in plant cell singaling[J].The Plant Cell,2002,355-373.
[5]Miura N,Atsumi S,Tabunoki H,et al.Expression and localization of three G protein α subunits,Go,Gq,and Gs,in adult antennae of the silkmoth(Bombyx mori)[J].J Comp Neurol,2005,485:143-152.
[6]章玉萍,汤强,赵云坡,等.家蚕G蛋白α亚基基因BmGα12的克隆及序列分析与融合表达[J].蚕业科学,2011,37(2):312-319.
[7]章玉萍,蒋剑豪,张建设,等.家蚕 G蛋白 α亚基基因BmGα73B的克隆与表达[J].昆虫学报,2008,51(8):785-791.
[8]章玉萍,蒋剑豪,赵云坡,等.家蚕G蛋白γ亚基BmGγ1的克隆其GST融合蛋白的表达和纯化[J].蚕业科学,2008,34(4):627-633.
[9]陈卫,葛佳佳,张颧,等.半乳糖昔酶基因在大肠杆菌中过量表达及IPTG诱导条件[J].无锡轻工大学学报,2002,21(5):492-495.
[10]李军,李伯良.蛋白A信号肽引导的E.coli外泌高表达异源蛋白[J].生物化学与生物物理学报,1995,27(6):616-623.
[11]Katsuyoshi K,Yoshitaka N,Satoru K,et al.Cloning and expression of Bombyx mori gland elongation factor1 in escherichia coli[J].Biosci Biotechnol Biochem,2002,66(3):558-565.
[12]董旭,新毅.重组蛋白在大肠杆菌中可溶性表达的策略[J].大连医科大学学报,2007,29(4):393-395.
[13]余波,程安春,汪铭书.大肠杆菌中重组蛋白可溶性表达的研究进展及展望[J].黑龙江畜牧兽医,2008,(10):19-21.
S881.2
A
1007-0982(2012)03-0019-04
2012-03-30;
2012-06-20
安徽省高校自然科学基金项目(编号 KJ2012B218);安徽省农业科学院院长青年创新基金项目(编号11B0625);安徽省芜湖职业技术学院博士科研启动基金项目。
汤强(1981—),男,安徽芜湖,博士。
Tel:0553-5777156,E-mail:tqiang226@126.com
章玉萍(1981—),女,安徽合肥,博士。
Tel:0551-2840193,E-mail:ypzhang6330@163.com

