溶液Ca、K浓度和pH对烟草Cd毒性的影响
雷丽萍,陈世宝,孙 聪,徐照丽,汪安云,柴家荣
(1.云南省烟草农业科学研究院,云南 玉溪 653100;2.农业部植物营养与施肥重点实验室,中国农业科学院农业资源与农业区划研究所,北京 100081)
在土壤重金属污染中,镉(Cd)是影响我国烟草安全性的主要污染元素之一[1-3]。烟草属于易累积Cd的经济作物之一,Cd污染胁迫不仅影响烟草的生理过程,同时也会降低烟叶的品质[3-4]。虽然在近10多年来国内外对烟草重金属的相关研究取得了不少进展[1,5-7],但主要还是集中在对植烟区土壤和烟叶中的重金属(包括Cd)含量的监测、烟草土壤中重金属的富集研究等,少量研究涉及不同重金属污染对烟叶质量的影响、生理反应及其减控措施等[8-12],而针对烟草Cd胁迫毒性与环境因子之间的量化关系研究较少。
烟草主要通过根系对Cd进行吸收、累积,因此,不同土壤性质对土壤中Cd的迁移、转化特性有显著影响,如土壤 pH、有机质含量、阳离子交换量及粘粒含量等[1]。除了上述土壤性质外,土壤溶液阳离子组成与含量与烟草对Cd吸收的影响还未见报道。本研究通过水培实验,利用ISO毒性测试方法,研究溶液中 Ca、K离子浓度变化及溶液pH对烟草Cd毒性的影响,以期为烟草Cd减控措施提供科学依据。
1 材料与方法
1.1 试验设计
溶液性质变化实验共设钙(Ca)、钾(K)和pH 3个组,实验以8.0 mg/L的Ca(以Ca(NO3)2进行配制)作为背景溶液。8.0 mg/L的Ca2+是土壤孔隙水中Ca2+的最低浓度,也通常作为植物毒性测试的一种背景溶液[13]。溶液 Ca、K 离子浓度的变化范围参照自然土壤孔隙水的离子浓度范围进行设置[13]。本试验中,设置Ca2+离子浓度分别为0、8.0、16.0、32.0、64.0、128.0、256.0、400.0 mg/L;设置K+离子(以KNO3进行配制)浓度分别为0、4.0、8.0、16.0、32.0、64.0、128.0、256.0 mg/L;溶液pH分别为4.52、5.04、5.57、6.02、6.55、7.09、7.47和8.10。
1.2 溶液配制
用钙与钾的硝酸盐分别配制Ca2+、K+母液,通过添加不同量的母液配制成不同Ca2+、K+浓度的供试溶液。除pH组外,钙与钾溶液分别以2.0 mmol/L的2-吗啉乙磺酸缓冲液(MES)调节溶液pH为6.0,每组钙与钾离子浓度及不同pH溶液中,通过添加Cd(NO3)2·4H2O,分别配制7个浓度的Cd溶液(0、1.12、2.24、4.48、8.96、17.92、35.84 mg/L),每处理设3次重复。
1.3 毒性测试
根伸长抑制试验参照ISO标准(11269—1)[14]。烟草品种为云烟87。将上述烟草种子在10%(v/v)H2O2中表面消毒10 min后,冲洗干净,放于底部铺有纱布的培养皿上,滤纸用蒸馏水浸湿,然后置于温度为(20±2) ℃无光照的培养箱中直到种子露白。生长箱的光照时间保持在14 h,光强度约为280 μmol/(m2·s),相对湿度保持在80%,昼夜温度保持在20~25 ℃。培养24 h后,挑选出大小一致、幼根长度约为2 mm的种子进行根伸长抑制水培试验。水培装置采用顶部罩有玻璃纤维网的 PVC培养筒 (直径7.0 cm,高12 cm),每个处理为10粒种子,暴露于装有不同供试溶液组的培养筒,然后置于培养箱中进行培养。PVC培养筒在培养箱中随机放置,每2 d更换溶液并变换烧杯的位置,培养7 d后测定种子的根长。相对于对照的根的伸长百分比(RE)依据公式计算:
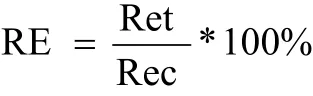
式中,Ret为处理溶液中根的伸长(cm),Rec为对照溶液中根的伸长(cm)。
1.4 测定分析
在进行毒性测试前,经过消化以(石墨)原子吸收光谱法(F-AAS; Varian 220Z)(AAS)对每组溶液中Cd、Ca及K的实际含量进行测定。预备实验结果表明,植物生长2 d对溶液中Cd、Ca及K离子浓度影响可以忽略,因此,溶液每2 d更换1次。用梅特勒pH计(Delta320,Mettler)对溶液的实际pH进行测定,以获得培养溶液最终pH。
1.5 统计分析
剂量-效应曲线拟合:溶液中Cd植物毒性的剂量-效应关系曲线采用逻辑斯蒂克分布模型(Log-logistic distribution)进行拟合[15]。
Log-logistic曲线:

式中,x为溶液中 Cd浓度值(mg/L);M 为ECx的自然对数值,b为参数。当低剂量毒物刺激效应发生时,采用低剂量毒物刺激效应(hormesis)曲线拟合[15],通过Table curve 2D-V5.01软件来完成。当溶液中低浓度Cd对烟草产生刺激效应时,采用低剂量刺激效应拟合方程(Hormesis dose-response data fitting)进行毒性效应的拟合,方程如下:

式中,Y是烟草相对根长(%),X是溶液 Cd的浓度(mg/L),a、b、c、d是方程参数。当k为10、50时,参数c定义为EC10及EC50。所有实验数据均采用Excel 2007和SPSS13.0分析软件进行处理,LSD法检测差异显著性(p<0.05)。
2 结 果
2.1 溶液pH对烟草Cd毒性的影响
溶液 pH对烟草 Cd毒性的影响浓度 EC10、EC50值及其95%置信区间见表1。可以看出,随着pH的升高,Cd对烟草毒性的影响浓度值 EC10、EC50值逐渐增加,且EC50值变化趋势较EC10更为明显,这一结果表明,随着溶液pH的逐渐升高,Cd对烟草胁迫毒性逐渐降低。就EC10变化而言,最低pH(4.52)处理Cd的10%毒害浓度值仅为最高pH(8.10)处理毒害浓度的28.4%,其中在较低pH(<5.57)条件下,EC10之间差异并不显著,而随着pH逐渐升高,Cd对烟草毒害EC10显著增加;相对EC10而言,溶液pH变化对Cd的50%毒害浓度值影响更为显著,最低pH(4.52)处理Cd的50%毒害浓度值仅为最高 pH(8.10)处理毒害浓度的14.9%,除了pH 6.02和pH 6.55二个处理间EC50没有显著性差异外,EC50值随着溶液 pH的升高EC50 值显著增加(p<0.05)。
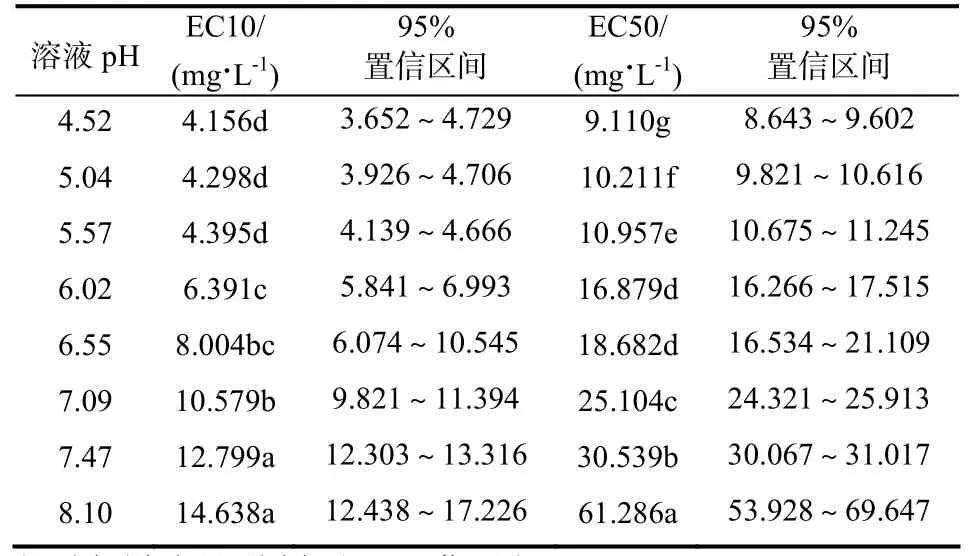
表1 不同pH条件下Cd对烟草毒性的影响Table1 Effect of solution pH on Cd toxicity to tobacco
相关分析结果表明,溶液的pH与烟草Cd毒性影响浓度间呈显著正相关关系,方程为 EC10 =3.2072pH - 12.032,R2= 0.9325**;EC50 = 12.16pH -53.7,R2= 0.7563*)。
2.2 溶液Ca离子浓度对烟草Cd毒性的影响
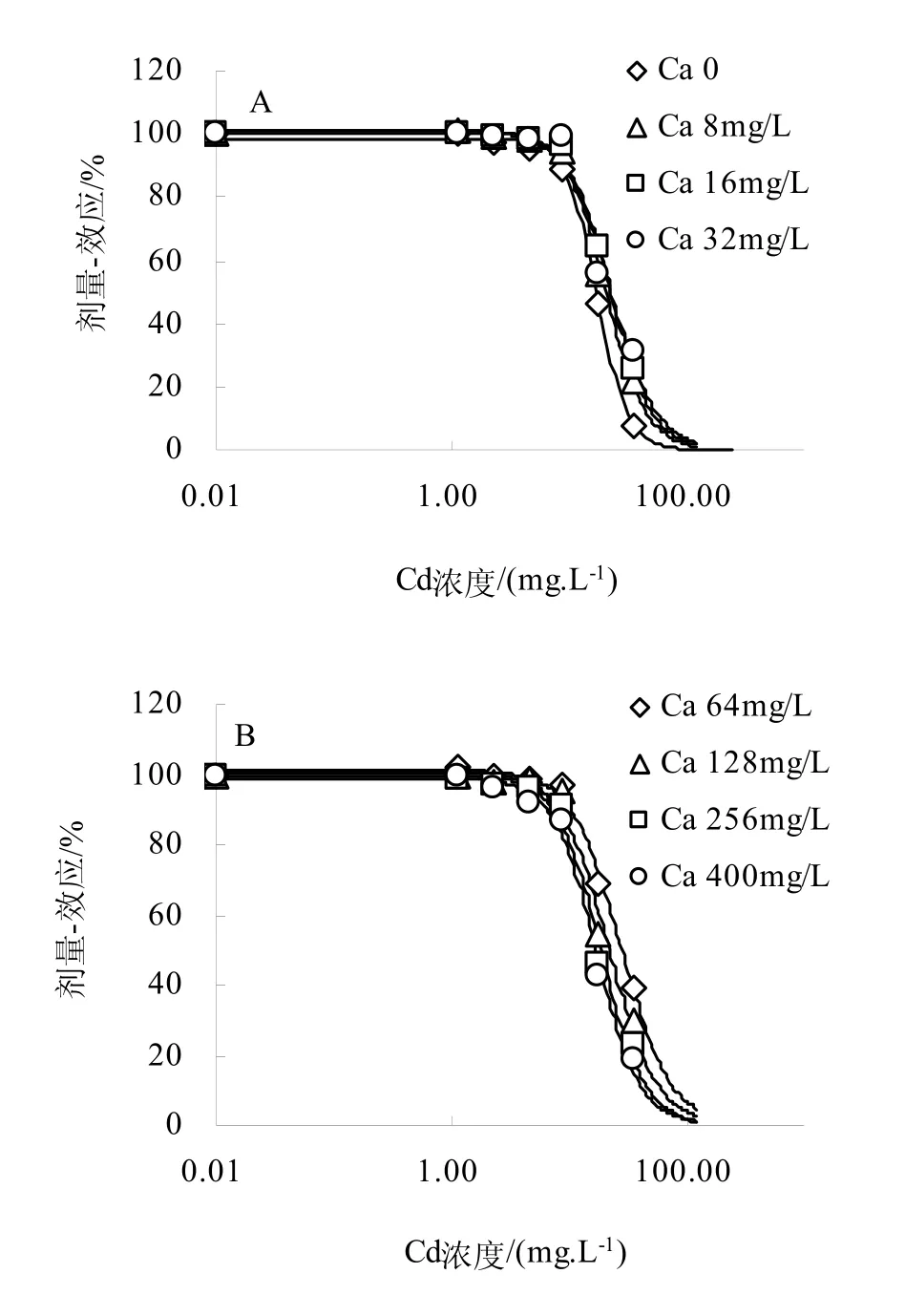
图1 不同Ca离子浓度条件下Cd对烟草毒性的剂量-效应关系(实线为模型预测值)Fig.1 The dose-response curves of Cd to tobacco with different Ca2+ in solution
通过利用逻辑斯蒂克分布模型并结合低剂量刺激效应拟合方程对8个不同Ca2+浓度下Cd毒性进行了测定。培养溶液中不同Ca2+浓度变化对烟草Cd毒害的剂量-效应关系见图1。从图1A可以看出,在相对低Ca2+浓度(<64.0 mg/L)处理下,Cd的毒害影响浓度(纵坐标)相同时,随着溶液Ca2+浓度的增加,溶液中Cd的浓度也逐渐增加,换言之,随着溶液 Ca2+浓度的增加,Cd对烟草毒害浓度逐渐降低,烟草Cd的50%毒害浓度EC50与溶液Ca2+浓度之间呈正相关关系(图2),相关关系方程为:EC50 = 0.1775[Ca2+]+ 18.03,R2= 0.8521;而随着溶液 Ca2+浓度的逐渐增加,在相对高 Ca2+浓度(>128.0 mg/L)处理下(图 1B),随着溶液 Ca2+浓度的增加,Cd对烟草毒害浓度EC50逐渐降低,此表明,溶液中Ca2+浓度的持续增加并不能降低溶液中Cd对烟草的致害浓度值。

图2 溶液中Ca2+离子浓度与Cd对烟草毒性EC50间的关系Fig.2 Relationship between the Cd toxicity (EC50) to tobacco and Ca2+ concentration in solution
2.3 溶液K离子浓度对烟草Cd毒性的影响
溶液不同K+浓度变化对Cd烟草毒性影响浓度见图3。就Cd对烟草毒性影响浓度EC10而言,在相对低浓度(<64.0 mg/L)条件下,K+浓度的增加并没有显著降低Cd的致害浓度EC10,而随着K+浓度逐渐增加,EC10值显著增加(p<0.05),不同浓度 K+处理的 Cd的 EC10变化为 8.54~20.23 mg/L。相对EC10而言,溶液中的K+浓度变化对烟草Cd毒性的EC50影响更为明显,从图3可以明显看出,随着溶液中的K+浓度的增加,EC50值逐渐增加,也即表明Cd的毒害显著降低,不同处理Cd的EC50浓度变化为17.29~39.03 mg/L,其中对照处理EC50值为最高K+处理EC50值的44.3%。K+浓度与Cd毒害的EC50值之间呈显著的正相关关系(EC50 = 0.0767[K+]+ 21.276,R2= 0.8709)。
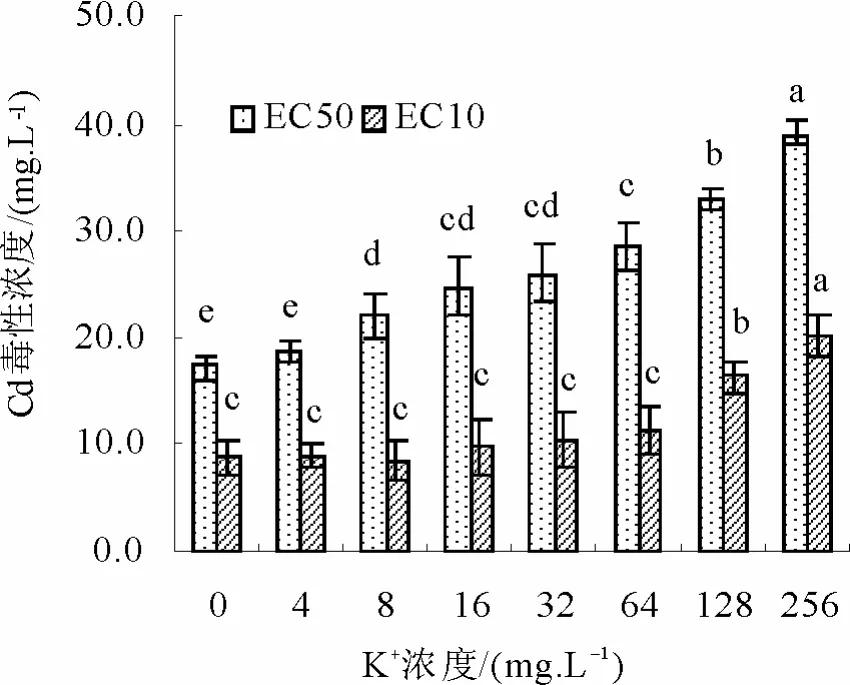
图3 不同K离子浓度条件下Cd对烟草毒性的影响Fig.3 The toxicity thresholds of Cd to tobacco as affected by different K+ concentration in solution
3 讨 论
3.1 溶液pH对Cd毒性的影响
在影响烟草对Cd吸收的土壤性质中,pH是其中重要的影响因子之一。有大量研究结果表明,土壤pH变化是影响烟草对污染土壤中Cd吸收最重要的影响因子之一[1,16-17]。进入土壤中的 Cd2+,以不同结合形态存在于土壤固-液体系中,随着土壤pH的升高,土壤胶体带负电荷逐渐增加,导致土壤胶体对Cd离子的吸附明显增加,从而降低Cd的迁移转化性。
Zachara等[18]对土壤中 Cd的结合形态研究发现,当pH > 8.0时,土壤中的Cd几乎都以氧化铁、铝和硅酸盐等植物无效态存在,而当土壤pH为中、酸性时,Cd则以较多的有机结合形态及可交换态等有效态存在于土壤中。pH变化导致土壤中Cd结合形态的变化是影响烟草对Cd吸收、转化的最根本原因。本试验结果显示,对于 10%的致害浓度(EC10)而言,在溶液pH < 5.57的酸性条件下,随着pH的升高,Cd的毒性虽然有所降低,但并不显著,而随着pH的逐渐升高达到碱性(pH > 7.09)条件下,Cd的毒性显著降低,而这一结果对于半抑制浓度(EC50)的影响更为显著,这可能与Cd在溶液中随着pH升高,其吸附形态的变化有关。
3.2 溶液中Ca、K离子的影响
在烟草对Cd吸收的影响因子中,除了土壤pH外,土壤溶液中阳离子的种类和含量也是其中重要影响因子之一。土壤中的金属阳离子,如Ca、K、Co、Cu、Ni及Pb等,由于和Cd具有类似的物理、化学性质,在一定程度上影响土壤胶体对Cd的吸附-解吸作用,从而影响土壤中 Cd的植物有效性[19-20]。土壤中胶体的种类及其交换性能对 Cd离子的吸附作用大小对烟草Cd吸收有十分重要影响。有研究表明,烟草对土壤中Cd的吸收与土壤的阳离子交换量(CEC)呈明显负相关关系[19],如Adamu等[21]在13种土壤中烟草对Cd吸收实验结果表明,烟叶中Cd的含量与土壤阳离子交换量呈显著负相关关系;另有资料报道,土壤中的 Zn通过对土壤胶体吸附位的竞争从而影响烟草对Cd的吸收、转化。在烟草根系对Cd吸收转运的过程中,Zn的存在会影响植物根细胞质膜对Cd向韧皮部的转运,而当Zn进入植株体内后,Zn由于和植物蛋白产生竞争络合作用从而影响植物体内Cd的再分配过程,也即产生拮抗效应[22-23]。除了 Zn外,土壤中其他金属元素,如Fe、Ca、K等阳离子的存在也会由于Fe-Cd、Ca-Cd的拮抗作用而降低烟草对Cd的吸收、转运[1]。
烟草根系主要通过H+-ATP酶的作用对溶液中的K+进行主动运输或通过低亲和力的K+内流通道和非选择性的阳离子通道进行被动运输。提高溶液中K+浓度对降低烟草Cd毒性的机制可能与以下原因有关,一是提高K+浓度可以促进烟草的生长,增强烟草对Cd胁迫的耐性,二是由于K+在溶液中通过与 Cd2+竞争阳离子吸附点位及 Cd2+进入植物细胞阳离子运输通道等。本研究结果表明,虽然在低浓度(<64.0 mg/L)条件下,添加K+在一定程度上增加了烟草Cd胁迫的抗性,但就10%毒性影响浓度(EC10)而言,与对照相比并不显著(p>0.05),随着溶液中K+浓度的增加,显著降低了溶液中Cd对烟草的毒性,因此,在烟草Cd胁迫条件下,增加介质中K的浓度,可以显著降低Cd对烟草的毒性。
4 结 论
(1)水培试验结果表明,随着溶液pH的升高,Cd对烟草的毒性浓度值 EC10、EC50逐渐增加,也即表明Cd的毒性逐渐降低,溶液的pH与烟草Cd毒性影响浓度值间呈显著正相关关系。
(2)在溶液Ca2+浓度 < 64.0 mg/L处理下,随着溶液 Ca2+浓度的增加,Cd对烟草毒害浓度逐渐降低,烟草Cd的50%毒害浓度EC50与溶液Ca2+浓度之间呈正相关关系;而随着溶液Ca2+浓度的逐渐增加,当Ca2+浓度 > 128.0 mg/L时,溶液中Ca2+浓度的增加并不能降低Cd对烟草的毒性;与Ca2+相比,在相对低浓度(< 64.0 mg/L)条件下,K+浓度的增加并没有显著降低Cd的毒性,而随着K+浓度逐渐增加,EC10及EC50值显著增加,溶液中高K+浓度(>64.0 mg/L)可以显著降低烟草 Cd的毒性。
(3)在烟草Cd污染胁迫条件下,提高介质pH和增加介质中Ca2+、K+的浓度可以有效降低Cd的毒性。
[1]雷丽萍,陈世宝,夏振远,等.烟草对污染土壤中镉胁迫的响应机制及影响因素研究进展[J].中国烟草科学,2011,32(4):87-93.
[2]刘义新,陶涌,孟丽华, 等.烤烟品种K326 和云烟87对镉胁迫的生理响应及抗性差异[J].中国烟草科学,2008,29(4):1-5.
[3]马新明,李春明,田志强,等.镉污染对烤烟光合特性、产量及其品质的影响[J].生态学报,2006,26(12):4039-4043.
[4]高家合,王树会.镉胁迫对烤烟生长及生理特性的影响[J].农业环境科学学报,2006,25(5):1167-1170.
[5]张艳玲,周汉平.烟草重金属研究概述[J].烟草科技,2004(12):20-27.
[6]Choi Y E, Harada E, Wada M, et al.Detoxification of cadmium in tobacco plants: formation and active excretion of crystals containing cadmium and calcium through trichomes [J].Planta, 2001, 213: 45-50.
[7]Verma S, Yadav S, Singh I.Trace metal concentration in different Indian tobacco products and related health implications [J].Food and Chemical Toxicology, 2010,48: 2291-2297.
[8]吴玉萍,杨虹琦,徐照丽,等.重金属镉在烤烟中的累积分配[J].中国烟草科学,2008,29(5):37-39.
[9]袁祖丽,马新明,韩锦峰,等.镉污染对烟草叶片超微结构及部分元素含量的影响[J].生态学报,2005,25(11):2919-2927.
[10]刘双营,李彦娥,赵秀兰.不同品种烟草镉吸收的动力学研究[J].中国农学通报,2010,26(5):257-261.
[11]Toma G, Zden P, Jir S, et al.Toxicity and DNA damage in tobacco and potato plants growing on soil polluted with heavy metals [J].Ecotoxicology and Environmental Safety, 2006, 65: 420-426.
[12]Isaure M P, Sarret G, Harada E, et al.Calcium promotes cadmium elimination as vaterite grains by tobacco trichomes[J].Geochimica et Cosmochimica Acta, 2010,74: 5817-5834.
[13]Oorts K, Ghesquiere U, Swinnen K, et a1.Soil properties affecting the toxicity of CuC12and NiC12for soil microbial processes in freshly spiked soils[J].Environ Toxicol Chem, 2006, 25(3): 836-844.
[14]International Organization for Standardization.Soil quality determination of the effects of pollutants on soil flora,Part 1: method for the measurement of inhibition of root growth, ISO 11269-1[S].Geneva, Switzerland, 1993.
[15]Schabenberger K, James J.Kells G, et al Response of annual weed species to glufosinate and glyphosate [J].Weed Technology, 1999, 13(3): 542-547.
[16]Tsadilas C D.Soil pH influence on cadmium uptake bytobacco in high cadmium exposure [J].J.Plant Nutr,2000, 23, 1167-1178.
[17]Maier N A, McLaughlin M J, Heap M, et al.Effect of nitrogen source and calcitic lime on soil pH and potato yield, leaf chemical composition, and tuber cadmium concentrations [J].J.Plant Nutr., 2002, 25: 523-544.
[18]Zachara J M, Smith S C, Resch C T, et al.Cadmium sorption to soil separates containing layer of silicates and iron and aluminium oxides [J].Soil Sci.Soc.Am.J.,1992, 56: 1074-1084.
[19]Ghnaya T, Slama I, Messedi D.Effects of Cd2+on K+,Ca2+and N uptake in two halophytes Sesuvium portulacastrum and Mesembryanthemum crystallinum:consequences on growth [J].Chemosphere, 2007, 67:72-79.
[20]Larsson E H, Asp H, Bornman J F.Influence of prior Cd2+exposure on the uptake of Cd2+and other elements in the phytochelatin-deficient mutant, cad1-3, of Arabidopsis thaliana [J].J.Exp.Bot., 2002, 53: 447-453.
[21]Adamu C A, Mulchi C, Bell P F.Relationships between pH, clay, organic matter and CEC and heavy metal concentrations in soils and tobacco [J].Tob.Sci., 1989,33: 96-100.
[22]Hart J J, Welch R M, Norvell W A, et al.Transport interactions between cadmium and zinc in roots of bread and durum wheat seedlings [J].Physiol.Plant., 2002, 116:73-78.
[23]Green C E, Chaney R L, Bouwkamp J.Interactions between cadmium uptake and phytotoxic levels of zinc in hard red spring wheat [J].J.Plant Nutr., 2003, 26:417-430.

