卵寄生真菌刀孢蜡蚧菌对烟草根结线虫的生物防治
陈德鑫,许家来,曹君正,武 侠,林北森,孔凡玉*
(1.中国农业科学院烟草研究所,青岛 266101;2.山东烟草研究院,济南 250101;3.青岛农业大学农学与植物保护学院,青岛 266109;4.广西壮族自治区烟草公司百色市公司,广西 百色 533000)
根结线虫是当前我国主要的农作物病原线虫之一[1]。根结线虫作为烟草主要的病原线虫,每年对世界烟草生产造成严重的经济损失。迄今尚缺少抗根结线虫的商品化作物品种,且与非寄主植物轮作的农业措施在烟草产区难以施行。采用化学杀线剂防治根结线虫病,由于土壤残留、环境破坏及吸食对人不安全等因素,有的化学杀线剂已经被禁用,有的即将被禁用。迄今为止生产上尚无安全有效的防治烟草根结线虫病害措施,促使人们开始寻求更为安全有效的防治手段,生物防治是目前国内外研究和应用的热点,也是根结线虫可持续治理的理想途径之一[2-3]。
刀孢蜡蚧菌 Lecanicillium psalliotae(syn Verticillium psalliotae)对根结线虫的生物防治具有重要的应用潜力。该菌寄主范围很广,既能寄生根结线虫卵和 2龄幼虫[4-7]、胞囊类线虫[4]和腐生线虫[8],也能寄生大豆锈病等多种病原真菌[9-11]及多种农业害虫[12-15],具有很大的生物防治应用潜力。目前未见该菌对烟草根结线虫的生物防治潜力评价。
本研究通过该菌离体条件下对分离自烟草根结线虫卵和雌虫的寄生测定及对烟草根结线虫病害的田间防效测定,探明该菌对烟草根结线虫的生防潜力,为进一步开发和利用该菌奠定理论依据。
1 材料与方法
1.1 供试菌株
刀孢蜡蚧菌 Lecanicillium psalliotae CGM CC5329(QNCSE0810)由青岛农业大学线虫研究室提供。
1.2 刀孢蜡蚧菌对根结线虫卵、雌虫的寄生及卵孵化抑制的测定
本试验于2010年5月在青岛农业大学线虫学研究室进行,将采自云南被南方根结线虫侵染的烟草病根洗净,直接挑取新鲜的卵块和健康雌虫。用1%次氯酸钠震荡分离新鲜的卵块,收集游离卵,制成每毫升 3000个卵的悬浮液。刀孢蜡蚧菌对烟草根结线虫卵、雌虫寄生及卵孵化抑制的测定试验设计参见文献[7]。
1.3 刀孢蜡蚧菌菌剂的制备
将干燥麦麸加入营养液(0.2% K2HPO4,0.1%KH2PO4,0.3% KNO3,0.001% FeSO4,0.03% NaCl,0.03% MgSO4·7H2O,0.3% Tryptone)并充分混匀,使麦麸湿度达70%后,装入1000 mL三角瓶1/2处,121 ℃灭菌30 min 备用。挑取PDA平板上27 ℃、6 d的纯培养物边缘直径6 mm菌块,加入三角瓶中,每瓶放菌块10个。27 ℃暗箱培养,每天摇瓶3次,使之充分发酵。7 d后取出自然晾干备用。
1.4 刀孢蜡蚧菌菌剂的田间防效测定试验设计
试验于 2010—2011年在山东诸城市、广西百色市进行。诸城市相州镇高戈庄村往年发生根结线虫病较重的地块,土壤为褐土,肥力中等;百色市隆林县蛇场乡大坝屯,根结线虫病较重的地块,土壤为红壤土,肥力中等。供试品种为红花大金元,是南方根结线虫感病品种。
试验共设5个处理水平,即施菌剂30、15、7.5、5、0 kg/667m2,0为CK。菌剂在烤烟移栽时一次全部施入。小区面积33 m2,每区50株,3次重复,完全随机排列,处理间设保护行,按优化栽培管理烟草。采收期采用 5点取样法,每点定株调查 25株,调查烟草根结线虫病的病株率,并计算病情指数。采收期烟株拔根调查计算根结指数。根据病株率、根结指数计算相对防效,相对防效计算方法见文献[16]。收获期根结严重度的分级标准[17]为0级:无根结;1级:1/3以下根系上有少量根结;2级:1/3~1/2根系上有根结;3级:1/2以上根系上有根结,少量根结上再产生根结;4级:几乎所有根系上长满根结,甚至连结成根结团块。计算公式[18]:
根结指数=∑(各级植株数×相应级值)/(调查总株数×最高级别代表值)×100
相对防效=(对照根结指数-处理根结指数)/对照根结指数×100%
2 结 果
2.1 刀孢蜡蚧菌对南方根结线虫卵的寄生
卵内充满菌丝以及胚胎和1龄幼虫被破坏的卵定义为被寄生的卵。培养5 d后寄生率为83.29%。被寄生的卵被菌丝穿透卵壳,在卵表面形成菌网,有的卵壳皱缩凹陷甚至破裂,内容物外渗(图1A);菌丝侵入卵内,在卵内生长,使卵内容物凝集,胚胎发育停止,卵壳变形,卵壳内充满菌丝并产生镰刀形分生孢子(图1B)。未接菌的卵壳初期表面光滑,内容物均匀(图1C),3 d后可见明显的胚胎发育(图1D),5 d后孵化出2龄幼虫破壳而出。
2.2 刀孢蜡蚧菌对南方根结线虫雌虫的寄生
观察接菌培养基上的年轻雌虫,菌丝接触雌虫体壁形成致密菌网和侵染钉,穿透雌虫体壁,体壁皱缩变形,内含物外渗(图2B)。未接菌培养基上的雌虫,外壳表面光滑,内含物均匀完整(图2A)。
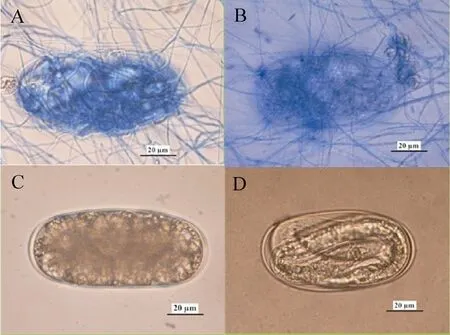
图1 刀孢蜡蚧菌对南方根结线虫卵的寄生过程Fig.1 Parasitic process of L.psalliotae to M.incognita eggs
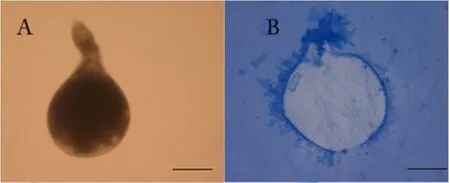
图2 刀孢蜡蚧菌对南方根结线虫雌虫的寄生Fig.2 Parasitism of L.psalliotae to the female of M.incognita
2.3 刀孢蜡蚧菌对卵孵化的抑制效果
未接菌的卵块解离48 h后孵化率为78.8%。接菌的卵块,解离后卵壳表面粗糙,卵质发黑,48 h后孵化率仅为5.7%,胚后发育期的卵表面粗糙,表明卵内幼虫亦被寄生。刀孢蜡蚧菌对南方根结线虫卵块寄生后的卵孵化抑制率为92.77%。
2.4 刀孢蜡蚧菌对烟草根结线虫的相对防效
试验结果发现,当施用菌剂量为 30 kg/667m2时,有烧苗现象,植株长势矮小,叶片泛黄,根系变褐腐烂,直至萎蔫死亡。由表1可以看出,其他处理均有一定的防效,当菌剂施用量为15 kg/667m2时防效最好,达80%以上,根系发达,根结少而小,有的很难找到根结(图 3A、C)。对照组呈明显鸡爪状,须根少,根结多而大(图3B、D)。
2.5 刀孢蜡蚧菌对烟草长势的影响
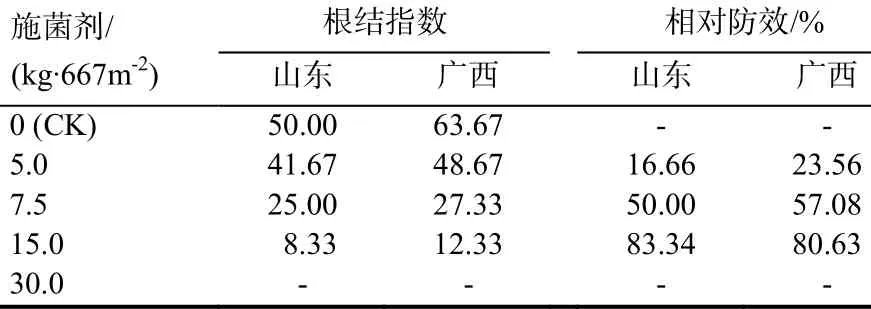
表1 不同处理根结线虫根结指数及防效Table1 Effects of different treatments on root-knot index and relative control effect
从采收初期至采收完最后一片烟叶,随机取烟叶测量叶面积,在采收最后一片烟叶后,各小区随机取15 株测量其株高、茎围和鲜质量。结果表明,除施用30 kg/667m2菌剂的处理外,其他处理在株高、叶面积指数、茎围和鲜质量均优于对照,株高、叶面积指数、茎围测量及计算方法参照文献[19]。其中施用15 kg/667m2菌剂的处理最为明显(表2、3)。
3 讨 论
刀孢蜡蚧菌CGMCC5329对烟草根结线虫卵和卵块具有很强的寄生能力和孵化抑制作用,对卵的寄生率第5天为83.29%,与曹君正等[7]报道的寄生率相近,对卵块的孵化抑制率为91.41%。这与Eapen等[20]报道的高效菌株蜡蚧菌Verticillium lecanii V1对卵块的孵化抑制率相近。刀孢蜡蚧菌CGMCC5329对不同时期的卵均有侵染能力,但胚前发育期卵的寄生率明显高于胚后发育期卵。线虫的卵壳是防御土壤微生物侵入的有效屏障,主要由几丁质(约占40%)和蛋白质构成[21]。这可能是在侵染过程中,产生几丁质酶和蛋白酶分解卵壳[22]。

表2 不同处理对烟草长势的影响(山东)Table2 Effects of different treatments on morphological indices of tobacco plants (Shandong)

表3 不同处理对烟草长势的影响(广西)Table3 Effects of different treatments on morphological indices of tobacco plants (Guangxi)
本试验用麦麸作为菌剂发酵的主要培养基,在施用量为30 kg/667m2时,有明显的烧苗现象,这可能与麦麸降解不充分且在土壤中的浓度过高,施入土壤后,通过自然降解产生大量氨气等造成烧苗。试验结果表明施用量为15 kg/667m2时,防治效果最好,且相对防效与长势情况与杨有才等[23]和祝明亮等[24]报道的结果类似。
烟草根结线虫的生物防治在资源普查、高效菌株筛选、生防菌剂的研制及田间试验等方面前人已经做了大量研究工作[25]。但是,由于生防菌株在复杂土壤微生态环境的影响下,生防菌剂防效很难达到理想效果,本研究是在未考虑土壤环境等因素的前提下进行的,且取得了较为理想的效果,说明该菌株可以作为高效生防菌株进行更深入的研究。对于该菌株产生的几丁质酶和蛋白酶活性及其与土壤微生态环境共存稳定性,需要做进一步研究,同时进一步评价温室和大田中影响该菌定殖及发挥防效的关键生态因子,以便为该菌的开发利用提供理论依据。
[1]Nguyen V N, Kim Y J, Oh K T, et al.The role of chitinase from Lecanicilliun antillanum B-3 in parasitism to root-knot nematode Meloidogyne incognita eggs[J].Biocontrol Science and Technology, 2007, 17(10):1047-1058.
[2]Kery B R.An assessment of progress toward microbial control of plant parasitic nematode[J].Journal of Nematology, 1990, 22 (4S): 621-631.
[3]Stirling G R.Biological control of plant parasitic nematodes: progress, problems and prospects[M].Wallingford: CABI, 1991: 106-108.
[4]Zare R, Gams W.A revision of Verticillium section Prostrata.IV.The genera Lecanicillium and Simplicium gen.nov[J].Nova Hedwigia, 2001, 73(1): 1-50.
[5]Nicole M V, George S A.Fungi parasitic on juveniles and egg masses of Meloidogyne hapla in organic soils from New York[J].Supplement to the Journal of Nematology,1998, 30(4S): 632-638.
[6]甘中伟,杨金奎,陶南,等.刀孢轮枝菌胞外几丁质酶的基因克隆及系统发育分析[J].菌物学报,2008,27(3):368-376.
[7]曹君正,林森,武侠.刀孢蜡蚧菌的鉴定及其对南方根结线虫不同生活阶段的定殖[J].中国农业科学,2012,45(12):2404-2411.
[8]Yang J K, Huang X W, Tian B Y, et al.Isolation and characterization of a serine protease from the nematophagous fungus, Lecanicillium psalliotae,displaying nematicidal activity[J].Biotechnology Letters,2005, 27: 1123-1128.
[9]Saksirira W, Hoppe H.Secretion of extracellular enzymes by Verticillium psalliotae Treschowand Verticillium lecanii (Zimm.) viegas During growth on uredospores of the soybean rust fungus (Phakopsora pachyrhizi Syd.) in liquid cultures[J].Journal of Phytopathology, 1991,131(1): 161-173.
[10]Toshinori N, Kengo N, Kenji K, et al.Antifungal activity of oosporein from an antagonistic fungus against Phytohthora infestans[J].Verlag der Zeitschrift für Naturforschung, 2004, 59(3-4): 302-304.
[11]Liao Y M, Xiong Y, Luo D P, et al.A hyperparasitism of Puccinia sp.and identification of the mycoparasite[J].Chinese Journal of Biological Control, 2008, 24: 85-89.
[12]Tove S, Richard A H.Entomopathogenic potential of Verticillium and Acremonium species (Deuteromycotina:Hyphomycetes)[J].Journal of Invertebrate Pathology,1999, 73: 309-314.
[13]Kurihara Y, Kurihara Y, Machida R, et al.Entomopathogenic fungi isolated from laboratory-reared Baculentulus densus (Acerentomidae, Protura)[J].Edaphologia, 2006, 80: 25-28.
[14]Dalė P, Irena N, Vaidilutė D V, et al.Pine defoliator Bupalus piniaria L.(Lepidoptera:Geometridae) and its entomopathogenic fungi[J].Ekologija, 2010, 56(1-2):34-40.
[15]Kurihara Y, Sukarno N, Ilyas M, et al.Entomopathogenic fungi isolated from suspended-soil-inhabiting arthropods in East Kalimantan, Indonesia[J].Mycoscience, 2008, 49: 241-249
[16]雷丽萍,李天飞,余清,等.生防菌剂田间试验示范[J].中国烟草科学,1998,19(3):30-32.
[17]国家烟草专卖局.YC/T39—1996烟草病害分级及调查方法[S].北京:中国标准出版社,1996.
[18]方中达.植病研究法[M].3版.北京:中国农业出版,1996.
[19]祝明亮,张克勤,李天飞,等.三种生物制剂对烟草根结线虫病防效研究[J].云南大学学报:自然科学版,2000,22(5):369-372.
[20]Eapen S J, Beena B, Ramana K V.Tropical soil microflora of spice-based cropping systems as potential antagoists of root-knot nematodes[J].Journal of Invertebrate Pathology, 2005, 88(2): 218-225.
[21]Wharton D A.Nemotode egg-shells[J].Parasitology,1980, 81: 447-463.
[22]Lopez-Llorca L V, Robertson W M.Immumocytochemical localization of a 32-kDa protease from the nematophagous fungus Verticillium suchlasporium in infected nematode eggs[J].Experimental Mycology,1992, 16: 261-267.
[23]杨友才,黄晓辉,龚理,等.烟草内生菌对烟草根结线虫病的防治效果[J].生态学杂志,2009,28(11):2269-2272.
[24]祝明亮,张克勤,李天飞,等.几种微生物杀线虫剂对烟草根结线虫病的防效试验[J].山地农业生物学报,2001,20(1):28-31.
[25]祝明亮,张克勤,夏振远,等.烟草根结线虫生物防治研究进展[J].微生物学通报,2004,31(6):95-99.

