非生殖器部位脂溢性角化病组织中HPV L1蛋白及HPV16、18 DNA的检测及意义
(三峡大学医学院,湖北宜昌443002)
脂溢性角化病(SK)又名老年疣、脂溢性疣及基底细胞乳头瘤,是表皮和真皮结缔组织共同增生构成的良性肿瘤。由于SK临床和组织病理表现与HPV感染引起的病毒疣有众多相似之处,国内外学者开始研究SK与HPV之间的关系,但并没有达成共识[1~6]。本研究的目的是通过检测SK组织中高危型HPV16和18的存在情况,以确定这两型HPV是否与SK发病有关。
1 材料与方法
1.1 材料 收集宜昌市第一人民医院病理科2009~2011年的SK石蜡标本43例份(观察组),组织来源均为非生殖器部位,其中取自四肢17例、头面部23例、躯干3例;患者年龄为38~78岁,>50岁者35例。正常皮肤组织标本(对照组)15例份来源于整形美容科,其中取自躯干7例、面部5例、四肢3例;年龄为 20 ~ 45 岁。查阅文献[7,8]设计引物,由上海生工合成。PCR Master Mix,DNA marker;小鼠抗HPV L1单克隆抗体,检测型别为 HPV1、6、11、16、18、31;DyLight549 标记山羊抗小鼠 IgG,DAPI染色液,其他相关试剂均为进口或者分析纯。仪器包括HM340E石蜡切片机、ECLIPSE TE2000-S倒置荧光显微镜、DMR型图像分析系统、MJMini梯度PCR仪、DYCP-31DN型电泳仪、Gel Logic 100凝胶成像系统。
1.2 方法
1.2.1 HPV L1蛋白检测方法 将石蜡组织连续切片,每片4μm;采用免疫组化法检测HPVL1蛋白,按试剂盒说明书进行。设置尖锐湿疣病理标本为阳性对照,荧光显微镜下555 nm激发,出现红色荧光为阳性;将一抗改为PBS的空白对照,无可见红色荧光;正常皮肤组织为阴性对照。
1.2.2 HPV16、18 DNA检测方法 采用 PCR法。采用简单裂解法从组织中提取总 DNA[9~11]。-20℃保存备用。PCR步骤参照文献[7,8]进行。取5μL的PCR反应产物与1μL的溴酚蓝上样缓冲液混匀,2%琼脂糖凝胶电泳。在KODAK凝胶成像仪上扫描,照相。提取到的总DNA首先进行β-globin扩增,以保证提取方法及反应条件的正确性和可靠性,并设置阳性对照(CaSik细胞、HeLa细胞)和阴性对照(HaCat细胞);琼脂糖凝胶电泳出现目的条带:βglobin目的条带为126 bp,HPV16 E6目的条带为397 bp,HPV18 E6目的条带为322 bp。
1.2.3 统计学方法 采用SPSS13.0统计软件。组间比较用确切概率法。P≤0.05为差异有统计学意义。
2 结果
2.1 HPV L1蛋白检测结果 观察组阳性部位主要在上皮角化层及深部的角化珠内,角化层阳性反应一般呈中等强度的荧光反应,细胞核存在的部位多数无红色荧光出现,呈负染状态。观察组出现阳性反应20例,阳性率为46.51%;对照组阳性4例,阳性率为26.67%。两组比较,P >0.05。
2.2 HPV16、18 DNA检测结果 观察组和对照组HPV16 E6和HPV18 E6均无阳性结果,见图1~3。
3 讨论
HPV属乳多空科病毒衣壳包含L1、L2两种结构蛋白。根据完全L1序列的开放读码框,可以将HPV分类编制成进化分支图[12]。其分类可以分为属、种、型三级,共有 α、β、γ、δ等 18个属。根据HPV感染人类组织的不同,又可将其分为两型。皮肤相关型 HPV 主要有 HPV1、2、3、4、7、10、26 ~29、41、49、57、60、63、65、75 ~77 等;黏膜相关型 HPV 根据致癌性的大小又可分为高危型(HPV16、18)、中危型(HPV31、33、35、39、45、51、52、56、58、59、68、73、82、83)、低危型(HPV6、11、26、30、32、40、42 ~44、53 ~55、62、6、70、72、81)。
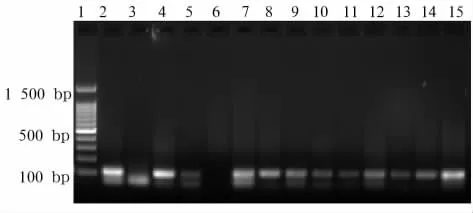
图1 临床标本中β-globin基因引物扩增电泳结果

图2 脂溢性角化病标本中HPV16 E6引物扩增凝胶电泳结果
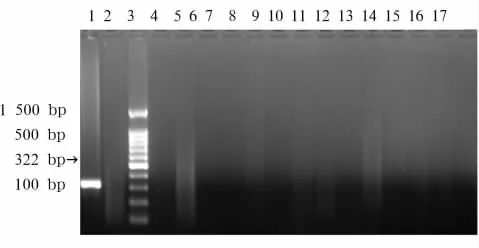
图3 脂溢性角化病标本HPV18 E6引物扩增凝胶电泳结果
本实验经过对HPV 16E6、HPV 18E6引物行PCR扩增,观察组及对照组标本中均无阳性结果。我们认为,HPV16、HPV18不是非生殖器部位SK的致病因素。Akiyo等[6]应用原位杂交、PCR、DNA 杂交等方法检测104例SK病变组织中的HPV DNA,同时对原位杂交阳性的标本进行免疫组化法检测病毒衣壳蛋白,检测型别包括黏膜型HPV(HPV6、11、16、18、30、31、33、35、45、51、52、56、58)和皮肤型HPV(HPV1、2)。结果显示,28.8%的 SK 标本中存在HPV DNA,原位杂交的阳性反应在表皮角质形成细胞的胞核内;免疫组化结果显示,在颗粒层和角质层的角蛋白细胞核内有HPV蛋白的表达;PCR结果显示,HPV18感染率为 83.7%,HPV6感染率为77.9%,HPV18和 HPV6混合感染者占到70.2%,而 HPV1(7.7%)和 HPV2(14.4%)的感染率相对较低。作者推测,HPV很可能在SK的发病机制中起到重要的作用,其作用是通过混合感染HPV18和HPV6或者某些其他型别而实现的。Bai等[6]的研究结果显示,外阴部位SK中HPV DNA的阳性率达72%,主要为低危组的HPV6、11;HPV DNA呈阳性的标本中,Ki-67相应的单克隆抗体Mib-1全部阳性,与其他女阴部病损相比差异有统计学意义。Mib-1作为目前较为肯定的核增殖标志,其阳性大致可反映皮损中HPV的存在。本实验结果与上述研究存在差异的原因可能是取材部位不同,我们主要选择非生殖器部位的SK标本,而Akiyo[4]及Bai等[6]的标本来源于生殖器部位。非生殖器部位与HPV的感染有无相关性也存在争论,Tsambaos等[2]应用原位杂交的方法检测173例非生殖器部位SK中的HPV,HPV阳性率达到19.65%,在34例阳性标本中15 例 HPV6、11 阳性,14 例 HPV31、33、35 阳性,另有5例阳性显示是其他型别感染;因此作者认为,非生殖器部位的SK中相当一部分病例与HPV的感染有相关。而Lee等[3]应用原位PCR探针杂交和PCR法检测40例非生殖器部位SK中的HPV6、11、31、33,结果所有标本均是阴性,认为HPV6、11、31、33不是非生殖器部位 SK的致病因素。Li等[5]应用通用型引物对55例非生殖器部位SK的活检组织进行巢氏PCR和测序分型,观察组疣状表皮发育不良相关性 HPV(HPV 5、8、9、12、14、15、17、19 ~25、36 ~38、47、49)的阳性率为 76%,与对照组比较有显著性差异;作者认为,疣状表皮发育不良型HPV在非生殖器部位SK的发病机制中起到一定的作用。本实验结论及Lee等[3]的研究结果共同证明黏膜型HPV与非生殖器部位的SK没有相关性。
本研究结果显示,SK标本中HPV L1蛋白的检出率较高,但与对照组相比差异无统计学意义,说明SK标本中存在HPV的感染,但不是致病因素。蛋白检测的结果与HPV DNA的检出情况存在差异,其原因可能是我们PCR中所用的HPV引物是针对黏膜型HPV16、18的,而鼠抗可以检测5个黏膜型HPV L1蛋白(HPV6、11、16、18、31)和 1 个皮肤型HPV L1蛋白(HPV1),由此可以推测免疫荧光法实验中检测到的HPV L1可能为HPV16、18以外的其他型别HPV,因此说明有必要设计针对皮肤型的HPV引物进行PCR。
研究[13~15]证实,上皮的存在对于 HPV 感染上皮基底层角质形成细胞是必须的,但是病毒DNA的扩增只发生在中上层棘细胞向最终的扁平鳞状细胞分化的过程中。大部分微小的病毒蛋白,如L1、L2蛋白表达在上皮的表层,在这个部位子代病毒颗粒被组装,最终随着角化的团块脱落。本实验SK标本的阳性反应主要表达在上皮角化部及深部的角化珠内,与上述研究结果相一致。
通过本实验我们认为非生殖器部位SK中并不存在HPV16、18 DNA,其发病机制与高危型HPV不相关,但是非生殖器部位SK中有HPV1、6、11、31中某一型或者某几型L1蛋白的存在,属于非特异性感染。下一步可收集更多的石蜡标本应用原位杂交的方法检测更多的HPV型别与SK的相关性。
[1]Ko CJ,Iftner T,Barr RJ,etal.Changes of epidermodysplasia verruciformis in benign skin lesions:the EV acanthoma[J].JCutan Pathol,2007,34(1):44-48.
[2]Tsambaos D,Monastirli A,Kapranos N,etal.Detection of human papillomavirus DNA in nongenital seborrhoeic keratoses[J].Arch Dermatol Res,1995,287(6):612-615.
[3]Lee ES,Whang MR,KangWH.Absence of Human Papillomavirus DNA in Nongenital Seborrhei Keratosis[J].JKorean Med Sci,2001,16(5):619-622.
[4]Akiyo G,Takuro K,Tamotsu K,etal.Detection and sequences of human papillomavirus DNA in nongenital seborrhoeic keratosis of immunopotent individuals[J].JDermatol Sci,2003,31(2):143-149.
[5]Li Y,Chen,Dong XP,et al.Detection of epidermodysplasia verruciformis-associated human papillomavirus DNA in nongenital seborrhoeic keratosis[J].Br JDermatol,2004,151(5):1060-1065.
[6]Bai H,Cviko A,Granter S,et al.Immunophenotypic and Viral correlates of vulvar seborrheic keratosis[J].Hum Pathol,2003,34(6):559-564.
[7]Pérez LO,Barbisan G,Ottino A,et al.Human papillomavirus DNA and oncogene alterations in colorectal tumors[J].Pathol Oncol Res,2010,16(3):461-468.
[8]刘霞,张淑兰.人乳头瘤病毒感染型别及整合状态与宫颈癌发生的相关性研究[D].中国医科大学博士毕业论文,2010,17-19.
[9]Frank TS,Svoboda-Newman SM,Hsi ED.Comparison ofmethods for extracting DNA from formalin-fixed paraffin sections for nonisotopic PCR[J].Diagn Mol Pathol,1996,5(3):220-224.
[10]黄幼生,宋伟伟,邓晓佳,等.四种微量石蜡组织DNA提取方法的比较[J].海南医学院学报,2010,16(9):1120-1123.
[11]王丽江,甘润良,唐运莲,等.石蜡组织提取DNA 4种方法的比较[J].诊断病理学杂志,2004,11(1):57-58.
[12]Villiers EM,Fauquet C,Broker TR,etal.Classification of papillomaviruses[J].Virology,2004,324(1):17-27.
[13]Stoler MH,Broker TR.In situ hybridization detection of human papillomavirus DNAs and messenger RNAs in genital condylomas and a cervical carcinoma[J].Hum Pathol,1986,17(2):1250-1258.
[14]Chow LT,Broker TR,Steinberg BM.The natural history of human papillomavirus infections of the mucosal epithelia[J].APMIS,2010,118(6-7):422-429.
[15]Wang HK,Duffy AA,Broker TR,et al.Robust production and passaging of infectious HPV in squamous epithelium of primary human keratinocytes[J].Genes Dev,2008,23(2):181-194.