辛伐他汀对COPD大鼠肺组织细胞凋亡的影响及其机制探讨
王 伟,吴 倩,丁启翠,黄建安
(1苏州大学附属第一医院,江苏苏州215006;2山东大学第二医院)
研究[1]发现,肺组织细胞凋亡参与慢性阻塞性肺疾病(COPD)的发生、发展过程,且与Caspase-3、内皮型一氧化氮合酶(eNOS)及诱导型一氧化氮合酶(iNOS)等细胞凋亡相关因子有关。他汀类药物为羟甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,除调脂作用之外还具有调节细胞凋亡的作用[2]。2008年12月~2011年7月,我们观察了辛伐他汀对COPD大鼠肺组织细胞凋亡的影响,并探讨其作用机制。
1 材料与方法
1.1 材料 30只SPF级成年雄性Wistar大鼠,体质量(228.6±7.4)g;脂多糖,辛伐他汀片(10 mg/片),哈德门牌香烟;Trizol、PCR试剂盒及反转录试剂盒,TUNEL 试剂盒;Caspase-3、iNOS、eNOS 引物由上海生物工程公司合成。
1.2 方法
1.2.1 动物分组及造模 将30只大鼠随机分为正常组、对照组、治疗组,每组10只。正常组行标准饲养,不进行干预;对照组参照文献等[3,4]制作 COPD模型;治疗组造模方法与对照组相同,于香烟暴露2周后,给予辛伐他汀2.5 mg/kg灌胃,连续治疗6周。
1.2.2 动物处置及标本采集 造模成功后,腹腔注射10%水合氯醛300 mg/kg麻醉大鼠;固定后打开胸腹腔,用10 mL的注射器抽净下腔静脉血。用组织剪剪破左心房,以静脉输液器经右心室,灌注适量生理盐水;将肺内血管床中的残留血液冲洗干净,取出右肺,浸入4%多聚甲醛中固定72 h;常规石蜡包埋,制备5μm厚石蜡切片,其余肺组织于液氮中保存。
1.2.3 COPD大鼠肺组织原位细胞凋亡的检测采用TUNEL法。冰冻切片干燥及过氧化物酶阻断后,室温孵育 10 min,PBS冲洗 5 min,3次。0.1 mol/L的TBS以1∶100稀释蛋白酶K 37℃消化10 min,按每张切片取末端脱氧核酸转移酶(TdT)和DIG-d-UTP各1μL,加10μL抗体稀释液,每片加标记液20μL,湿盒37 ℃孵育2 h,PBS冲洗5 min,3次。滴加封闭液,每片50μL,室温孵育50 min,PBS冲洗5 min,3次。用抗体稀释液1∶100稀释生物素化抗地高辛抗体,每片50μL,37℃孵育30 min,PBS冲洗5 min,3次。DAB显色,苏木素复染,常规乙醇梯度脱水,二甲苯透明,甘油封片。光镜下计数500个细胞中TUNEL染色阳性细胞数(细胞核呈现棕色或者棕黄色)。凋亡指数(AI)=凋亡细胞数/细胞总数×100%。
1.2.4 COPD 大鼠肺组织中 iNOS、eNOS、Caspase-3 mRNA的检测 采用RT-PCR技术。根据用Trizol试剂提取肺组织总RNA,紫外分光光度仪鉴定其浓度及纯度,琼脂糖凝胶电泳鉴定完整性。RNA反转录成 cDNA:反应管中依次加入5×Prime Script buffer 2 μL,Prime Script RT Enzyme Mix I 0.5 μL,Oligo dT primer(50 μM)0.5 μL,Random 6 mers(100μM)0.5μL,每10 μL体系中加入500 ng的总RNA;最后加Rnase Free dH2O至10μL,37℃ 15 min,85 ℃ 5 s。cDNA 扩增:94 ℃ 1 min,58 ℃ 50 s,72℃ 1.5 min,40个循环72℃ 10 min;扩增产物于2%琼脂糖凝胶电泳,溴化乙锭染色,紫外灯下观察,以扩增产物的吸光度比值表示目的基因的相对表达量。
1.2.5 统计学方法 采用SPSS17.0统计软件。组间比较应用单因素方差分析,两变量之间的关系用Pearson相关分析。P≤0.05为差异有统计学意义。
2 结果
2.1 各组大鼠支气管及肺组织细胞AI比较 各组大鼠气道上皮细胞及肺泡上皮细胞AI比较,见表1。
表1 各组大鼠气道上皮细胞及肺泡上皮细胞AI比较(±s)
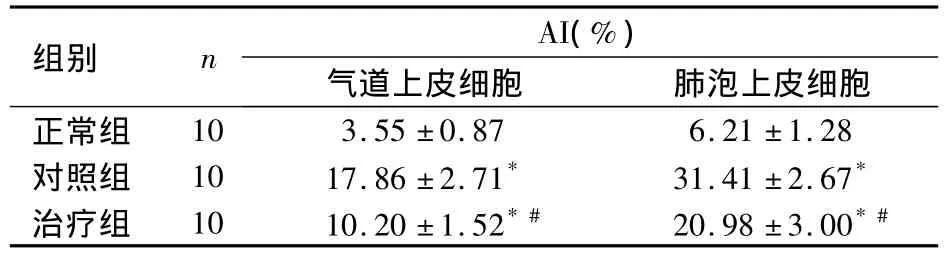
表1 各组大鼠气道上皮细胞及肺泡上皮细胞AI比较(±s)
注:与正常组比较,*P <0.05;与对照组比较,#P <0.05
组别 n AI(%)气道上皮细胞 肺泡上皮细胞正常组对照组治疗组10 3.55 ±0.87 6.21 ±1.28 10 17.86 ±2.71* 31.41 ±2.67* 10 10.20 ±1.52*# 20.98 ±3.00*#
2.2 各组大鼠肺组织中 iNOS、eNOS、Caspase-3 mRNA检测结果 各组大鼠肺组织中的Caspase-3、iNOS、eNOSmRNA相对表达量比较,见表2。
表2 各组大鼠肺组织中Caspase-3、iNOS、eNOSm RNA相对表达量比较(±s)
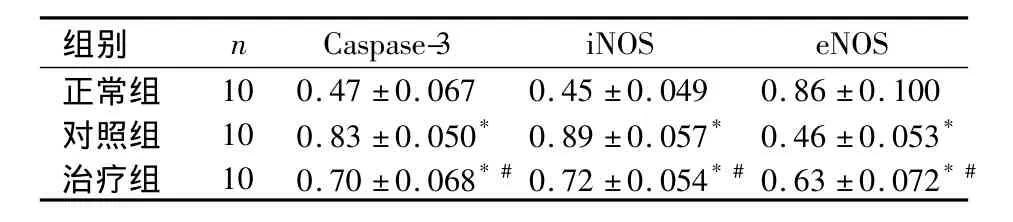
表2 各组大鼠肺组织中Caspase-3、iNOS、eNOSm RNA相对表达量比较(±s)
注:与正常组比较,*P <0.05,与对照组比较,#P <0.05
组别 n Caspase-3 iNOS eNOS正常组10 0.47 ±0.067 0.45 ±0.049 0.86 ±0.100对照组 10 0.83 ±0.050* 0.89 ±0.057* 0.46 ±0.053*治疗组 10 0.70 ±0.068*#0.72 ±0.054*#0.63 ±0.072*#
2.4 各组大鼠肺组织中 iNOS、eNOS、Caspase-3 mRNA表达的关系 各组大鼠肺组织中Caspase-3 mRNA表达与iNOSmRNA表达呈正相关(r分别为0.94、0.89、0.91,P <0.05),与 eNOSmRNA 表达呈负相关(r分别为 -0.88、-0.65、-0.92,P <0.05)。
3 讨论
研究发现,辛伐他汀除具有调脂作用外,还具有调节细胞凋亡的作用[2]。本研究结果显示,应用辛伐他汀治疗后,大鼠肺泡上皮细胞和气道上皮细胞凋亡减少。目前有研究[5~7]发现,辛伐他汀可以通过增加eNOSmRNA稳定性和提高一氧化氮(NO)的生物活性来抑制Caspase-3活性,减少细胞调亡。
Caspase家族是细胞凋亡的核心,不同的刺激诱发凋亡过程激活的Caspase不尽相同,但Caspase-3是不同凋亡途径的必经之路,是细胞凋亡的执行者。研究[8~10]发现,肺组织和气道凋亡的细胞增多与Capase-3的激活有关。本研究发现,对照组大鼠肺组织Caspase-3 mRNA表达较正常组增多,而辛伐他汀治疗后大鼠肺组织Caspase-3 mRNA表达较对照组明显减少,表明辛伐他汀能够通过减少Caspase-3基因的转录,从而减轻COPD大鼠肺组织细胞的凋亡。
一氧化氮合酶(NOS)是NO合成中最主要的限速酶,可分为神经元型一氧化氮合酶(nNOS)、eNOS、iNOS[11]。在呼吸系统中,NOS 广泛存在于多种组织中,且三种酶的作用各不相同。eNOS在正常生理状态下含量较高,而iNOS在病理状态下高表达。由nNOS和eNOS催化合成的NO,在呼吸系统中发挥生理性作用。生理情况下,iNOS在正常的气道上皮及巨噬细胞可有表达,产生的NO可以抵抗外界有害物质的侵袭;在各种炎症性肺疾病中,如哮喘、COPD、特发性肺纤维化和肺囊性纤维化,气道和肺周围实质中iNOS的表达上调[12]。各种介质如TNF-α、干扰素γ、白细胞介素-1β和LPS等,均可以诱导iNOS的表达。Rus等[13]通过研究大鼠缺氧与复氧过程中肺组织中eNOS来源的NO的作用,发现当抑制eNOS的作用时,大鼠NO的产生水平明显降低,而脂质过氧化物水平、细胞凋亡均明显升高。Rus等[14]还发现,抑制iNOS产生的NO可以降低脂质过氧化物、细胞凋亡以及硝基化蛋白质的水平[17]。本研究结果显示,对照组大鼠肺组织eNOS mRNA表达较正常组减少,而辛伐他汀治疗后大鼠肺组织eNOSmRNA表达较对照组明显增多;对照组大鼠肺组织iNOSmRNA表达较正常组增多,而辛伐他汀治疗后大鼠肺组织iNOSmRNA表达较对照组明显减少;可见辛伐他汀能通过促进COPD模型大鼠肺组织eNOSmRNA的转录,减少iNOSmRNA的转录,进而减少肺组织凋亡,减轻肺组织的破坏,为辛伐他汀在COPD中的应用提供了理论依据。
Caspase-3是细胞凋亡的最后执行者,本实验发现Caspase-3 mRNA与iNOSmRNA的表达呈正相关,与eNOSmRNA的表达呈负相关,考虑与iNOS的表达能够诱导细胞凋亡,eNOS的表达减轻细胞凋亡有关。
[1]Walsh GM.Defective apoptotic cell clearance in asthma and COPD-A new drug target for statins[J].Trends in Pharmacological Sciences,2008,29(1):6-11.
[2]Ambrosi P,Villani P,Habib G,etal.The statins:new properties[J].Therapie,2003,58(1):15-21.
[3]宋一平,崔德健,茅培英,等.慢性阻塞性肺疾病大鼠模型气道重塑及生长因子的研究[J].中华结核和呼吸杂志,2001,24(5):283-288.
[4]马楠,崔德健,梁延杰,等.气管内注入脂多糖法建立大鼠慢性支气管炎模型[J].中华结核和呼吸杂志,1999,22(6):371-372.
[5]Abraham SS,Osorio JC,Homma S,et al.Simvastatin preserves cardiac function in genetically determined cardiomypathy[J].J Cardiovase Pharmacol,2004,43(3):454-461.
[6]Porter KA,Turner NA,Regan DJ,et al.Simvastatin reduces human atrialmyofibroblast proliferation independently of cholesterol lowering via inhibition of PhoA[J].Cardiovase Res,2004,61(4):745-755.
[7]Soyseth V,Brekke PH,Smith P,et al.Statin use is associated with reducedmortality in COPD[J].Eur Respir J,2007,29(2):279-283.
[8]Aoshiba K,Yokohori N,Nagai A.Alveolar wall apoptosis causes lung destruction and emphysematous changes[J].Am J Respir Cell Mol Biol,2003,28(5):555-562.
[9]Yoshida M,Nakayama K,Yasuda H,et al.Carbocisteine inhibits oxidant.induced apoptosis in cultured human airway epithelial cells[J].Respirology,2009,14(7):1027-1034.
[10]Kasahara Y,Tuder RM,Cool CD,et al.Endothelial cell death and decreased expression of vascular endothelial growth factor and vascular endothelial growth factor receptor 2 in emphysema[J].Am JRespir Crit Care Med,2001,163(3 Pt1):737-744.
[11]Sugiura H,Ichinose M.Nitrative stress in inflammation lung diseases[J].Nitric Oxide,2011,25(2):138-144.
[12]Brindicci C,Kharitonov SA,Ito M,et al.Nitric oxide synthase isoenzyme expression and activity in peripheral lung tissue of patients with chronic obstructive pulmonary disease[J].Am JRespir Crit Care Med,2010,181(1):21-30.
[13]Rus A,Molina F,Peinado MA,et al.Endothelial NOS-derived nitric oxide prevents injury resulting from reoxygenation in the hypoxic lung[J].Free Radic Res,2010,44(9):1027-1035.
[14]Rus A,Castro L,Del ML,et al.Inducible NOS inhibitor 1400W reduces hypoxia/re-oxygenation injury in rat lung[J].Redox Rep,2010,15(4):169-178.