K562细胞过表达MHCⅠ类相关抗原A对树突状细胞吞噬功能的影响
张 跃,邵小青,陈 贝,季明春,龚卫娟
(扬州大学医学院病原生物学和免疫学教研室,江苏扬州,225001)
MHC I类相关抗原A(MICA)是细胞受到应激反应后在其表面表达的一种蛋白。MICA受体为表达于 NK 、NKT 、CD8+T 、γ δ T 等细胞表面的活化性受体NKG2D。当NKG2D与其配体结合后,主要通过与其偶联的转接蛋白DAP10传递活化信号,是介导细胞毒功能的关键蛋白[1]。近来研究[2-3]发现,MICA具有介导NK细胞与DC之间相互作用的活性,MICA阳性表达的肿瘤细胞易被NK细胞攻击而进入凋亡状态。因此,本文试图观察肿瘤细胞过表达MICA抗原时,被诱导形成的凋亡小体对DC吞噬活性的影响。该研究将深入揭示使用某些化学药物诱导肿瘤细胞凋亡或上调MICA抗原表达时,不仅直接影响天然免疫功能,且因具有调节DC的活性继而对获得性免疫功能产生影响[4-5]。
1 材料与方法
1.1 材料与试剂
重组pcDNA3.1-MICA表达载体由本室自行构建并保存[4],红白血病细胞株K562,单核细胞株THP1均来自美国ATCC,由本室常规保存。外周血淋巴细胞分离液购自挪威Axis-shield公司。RPMI1640培养基购自Invitrogen公司。胎牛血清购自杭州四季青公司,G418、青霉素、链霉素、两性霉素B购自上海生工生物公司。丝裂霉素C来自Sigma公司。脂质体转染试剂盒lipofectamine 2000购自 Invitrogen公司。重组人GM-CSF、IL-4购自 PeproTech公司。FITC-抗-CD14mAb,APC-抗-CD11cmAb,PE-抗-MICA mAb,PE-抗-HLA-DR mAb,PE-Cy5-抗-CD86 mAb,PE-抗-NKG2D mAb,NKG2D中和性抗体均购自Biolegend或eBioscience公司。CFSE细胞染色试剂盒来自 Invitrogen公司。流式细胞仪FACS Arial来自Becton Dickinson公司。
1.2 稳定表达MICA抗原的K562细胞株的建立
无菌条件下抽提质粒,按照Invitrogen公司的说明书进行操作,具体过程为:取对数期的K562细胞置于24孔内,共10孔。取 16 μ g的质粒用质粒稀释液稀释至总量400 μ L,取32 μ L的脂质体用无血清培养基稀释至总量400 μ L,2者混合,室温孵育10 min,每孔加入100 μ L的复合物,另外两孔作为阴性对照。37℃,5%CO2培养4 h后加入全培养基,48 h后加入G418筛选。2周后筛选出G418抗性的细胞。对筛选出的细胞用PE-MICA抗体标记,进一步用流式细胞术分选,得到纯度>90%的K562-MICA细胞。
1.3 流式细胞术检测THP1细胞的表型
分别取对数期培养的K562和K562-MICA细胞,用丝裂霉素 C(30 μ g/mL)37 ℃处理3 h,全培养基洗涤3遍。按1︰1比例与THP1细胞孵育过夜。收集混合培养的细胞,分别标记CD14和CD86、MICA、HLA-DR 和NKG2D 的抗体,流式细胞仪分析CD14阳性细胞内各细胞表面分子的表达。
1.4 DC的体外诱导
常规分离外周血单个核细胞(PMBCs),计数并调整细胞的密度为2×106/mL。将细胞铺于24孔板中培养(每孔500 μ L,约 1×106个细胞/孔),37℃,50 mL/L CO2条件下培养过夜。次日去掉未贴壁的细胞,加新鲜培养基,并加细胞因子GM-CSF(100 ng/mL)和IL-4(40 ng/mL)继续CO2培养。隔日半量换液,培养5 d,诱导为未成熟DC。
1.5 DC对肿瘤细胞凋亡小体的吞噬
分别取对数期培养的K562、K562-MICA细胞株,悬浮于1 μ L 5 mmol/L的CFSE,37 ℃孵育10 min,5倍体积全培养基洗涤终止反应。CFSE标记的细胞用丝裂霉素C(10、30 μ g/mL)处理37℃孵育3 h后,经全培养基洗涤后与未成熟DC按3∶1比例孵育过夜。次日混合细胞悬液用CD11c抗体或HLA-DR抗体标记,流式细胞仪检测CD11c+CFSE+细胞或 HLA-DR+CFSE+细胞,计算CD11c+CFSE+细胞或HLA-DR+CFSE+细胞频率占总CFSE阳性细胞的频率,(Q2/Q1+Q2)×100%代表吞噬率。
2 结 果
2.1 K562-MICA细胞的鉴定
K562-MICA细胞的荧光强度显著增强,说明MICA抗原已经稳定表达在K562细胞表面(图1)。
2.2 凋亡的K562-MICA细胞对THP1细胞相关表型的影响
在确定 THP1表达CD14和CD11c细胞表面标记的基础上(图2),观察THP1细胞表面CD86、MICA、HLA-DR、NKG2D 表达的变化。结果显示,K562细胞刺激可微弱上调 CD86、MICA、HLA-DR和NKG2D的表达。但与K562相比,K562-MICA细胞可刺激THP1上调CD86、MICA的表达,且CD86和MICA阳性的细胞频率近2倍增长,而对HLA-DR、NKG2D的表达无明显影响(图3)。本实验重复2次。

图1 流式细胞术检测MIC A在K562细胞的表达

图2 THP1细胞高表达CD14和CD11c

图3 K562-MICA细胞刺激THP1上调表达 CD86和 MICA
2.3 K562-MICA细胞的凋亡小体对THP1细胞吞噬功能的影响
本实验首先将K562、K562-MICA细胞经荧光素CFSE标记,进而用丝裂霉素C处理诱导凋亡,2者混合过夜后检测CD11c+CFSE+细胞的频率代表THP1细胞对凋亡小体的吞噬活性。结果发现,来自 K562-MICA的凋亡小体更容易被THP1细胞吞噬(图4)。
2.4 来自K562-MICA细胞的凋亡小体对DC吞噬功能的影响
与K562细胞相比,来自K562-MICA细胞的凋亡小体更容易被 DC吞噬,且 DC内吞噬的CFSE碎片荧光强度降低,提示这些碎片进入DC胞浆内已被及时加工处理[6](图5)。

图4 来自K562-MICA的凋亡小体促进THP1细胞吞噬

图5 来自K562-MIC A细胞的凋亡小体易被DC吞噬
2.5 DC对K562-MICA细胞凋亡小体的吞噬依赖NKG2D受体
尽管凋亡状态的K562细胞可上调DC表达NKG2D受体,但MICA在K562细胞表达后可协同刺激NKG2D的上调表达,尤其在细胞凋亡程度(丝裂霉素C 30 μ g/mL)较为明显时,MICA 的协同作用亦较为明显(图6)。在此基础上,作者在DC与凋亡细胞的悬液中加入人NKG2D的中和性抗体,结果显示,NKG2D抗体可拮抗DC对K562-MICA细胞凋亡小体的吞噬作用(P<0.05),但并未下降到对K562细胞的水平,提示DC表面可能还有其他受体参与吞噬作用[7](图7)。
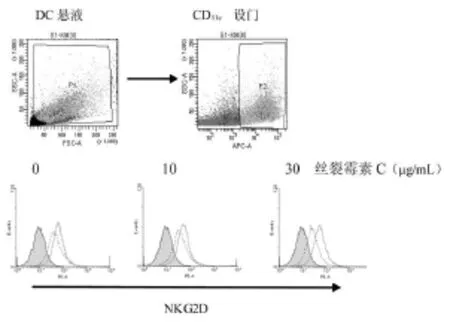
图6 K562-MICA细胞刺激DC上调表达NKG2D受体
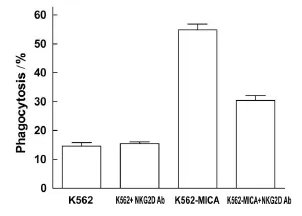
图7 NKG2D抗体拮抗DC对K562-MICA细胞凋亡小体的吞噬活性
3 讨 论
本研究初步揭示了某些化学药物(如柔红霉素、硼替佐米等)治疗肿瘤的分子机制,因为这些药物在诱导肿瘤细胞凋亡的同时促进细胞表面表达MICA抗原。DC吞噬肿瘤细胞凋亡小体的意义不仅仅在于清除细胞碎片,更重要的是将肿瘤细胞来源的特异性抗原递呈给T细胞,诱导免疫记忆的产生,从而达到根治肿瘤的目的。
NKG2D的配体除MICA抗原,还包括MICB和ULBP1~6分子。小鼠NKG2D还可识别视黄酸早期诱导蛋白-1(RAE-1),次要组织相容性抗原(H60)和鼠ULBP样转录子(MULT-1)。基于NKG2D配体表达谱的研究已证实,80%的上皮性肿瘤细胞表达MICA,而血液细胞来源肿瘤表达NKG2D的另一配体(ULBP)。然而由于免疫选择的压力(即免疫细胞清除MICA抗原高表达的细胞),晚期肿瘤细胞表面MICA表达往往逐渐降低或丢失,造成免疫细胞不能识别肿瘤[8]。因此,通过某些化疗药物或基于MICA高表达的基因疫苗来提高肿瘤细胞表达MICA的密度,可作为肿瘤免疫治疗的手段之一。
K562-MICA细胞来源的凋亡小体可明显促进DC表达NKG2D,而THP1细胞表面NKG2D的表达却没有明显变化。作者推测一方面可能与两种细胞处于分化的不同阶段有关,THP1处于早期的单核细胞阶段;另一方面,THP1为发生恶性转化的肿瘤细胞,与机体内正常细胞的生物学特征不完全一致。NKG2D一直被认为仅表达于淋巴细胞,但最近研究发现,DC或巨噬细胞在某些条件下可表达NKG2D。Baba等[9]报道大鼠体内CD4+CD8+巨噬细胞可表达NKG2D,通过识别肿瘤细胞表面MICA抗原而发挥抗肿瘤活性。Buhtoiarov等[10]发现小鼠初始巨噬细胞与L5178Y淋巴瘤细胞株及内毒素(LPS)共孵育后上调NKG2D受体的表达。K562-MICA细胞促进DC上调NKG2D表达的机制,推测可能与凋亡小体表面的危险信号(包括MICA抗原)分别与DC表面相关受体(如清道夫受体、DEC-205、TLR、NKG2D)结合,诱导DC活化有关。但在诱导NKG2D表达的刺激信号中,哪一种信号发挥关键作用,仍然需要深入研究。
[1]Champsaur M,Lanier L L.Effect of NKG2D ligand expression on host immune responses[J].Immunol Rev,2010,235(1):267.
[2]Jacobs B,Ullrich E.The interaction of NK cells and dendritic cells in the tumor environment:how to enforce NK cell&DC action under immunosuppressive conditions?[J].Curr M ed Chem,2012,19(12):1771.
[3]Wehner R,Dietze K,Bachmann M,et al.The bidirectional crosstalk between human dendritic cells and natural killer cells[J].J Innate Immun,2011,3(3):258.
[4]Suzuki Y,Mimura K,Yoshimoto Y,et al.Immunogenic tumor cell death induced by chemoradiotherapy in patients with esophageal squamous cell carcinoma[J].Cancer Res,2012,72(16):3967.
[5]Pathak S K,Skold A E,Mohanram V,et al.Activated apoptotic cells induce dendritic cell maturation via engagement of Toll-like receptor 4(TLR4),dendritic cell-specific intercellular adhesion molecule 3(ICAM-3)-grabbing nonintegrin(DC-SIGN),and β2 integrins[J].J Biol Chem,2012,287(17):13731.
[6]Asano K,Nabeyama A,Miyake Y,et al.CD169-positive macrophages dominate antitumorimmunityby crosspresenting dead cell-associated antigens[J].Immunity,2011,34(1):85.
[7]Apetoh L,Tesniere A,Ghiringhelli F,et al.Molecular interactions between dying tumor cells and the innate immune system determine the efficacy of conventional anticancer therapies[J].Cancer Res,2008,68(11):4026.
[8]Morisaki T,Onishi H,Katano M.Cancer immunotherapy using NKG2D and DNAM-1 systems[J].Anticancer Res,2012,32(6):2241.
[9]Baba T,Iwasaki S,Maruoka T,et al.Rat CD4+CD8+macrophages kill tumorcells through an NKG2D-and g ranzyme/perforin-dependent mechanism[J].J Immunol,2008,180(5):2999.
[10]Buhtoiarov I N,Rakhmilevich A L,Lanier L L,et al.Naive mouse macrophages become activated following recognition of L5178Y lymphoma cells via concurrent ligation of CD40,NKG2D,and CD18 molecules[J].J Immunol,2009,182(4):1940.

