冠心病患者血小板平均体积的变化及相关因素研究
许文亮,武越,惠波,张纯全,邵一兵,王旭
冠状动脉(冠脉)粥样硬化性血栓形成是冠心病的最基本发病机制,其中活化血小板的黏附、聚集和释放等反应发挥着关键性枢纽作用,血小板的活性状态影响着疾病的转归。血小板体积是血小板活性的主要决定性因素,大的血小板,即平均血小板体积(MPV)增加的血小板,含有更多的致密颗粒,更年轻,更具活性,有更强的促血栓形成作用。增大的MPV是冠心病发病的独立危险因素,对冠心病患者的预后有判定意义。MPV等常规临床血小板功能检测参数,具有简单、廉价、便利且有较高性价比等优点。国外MPV与冠心病关系的研究报道较多,但国内系统的观察很少。因此有必要对MPV在冠心病患者中的变化及其相关因素做进一步的观察和探讨。
1 对象和方法
研究对象:连续性选择我院2010-09到2012-02接受冠状动脉造影(冠造)的住院患者649例,男407例,女242 例,平均年龄(64.2±10.6)岁。根据临床症状、心电图、化验检查和冠造等资料明确诊断后,分为冠心病组487例,非冠心病对照组(对照组)162例。冠心病组包括稳定型心绞痛亚组73例,男47例,女26例,平均年龄(62.5±10.2)岁;非 ST 段抬高型急性冠脉综合征(不稳定型心绞痛和非ST段抬高型心肌梗死)亚组(NSTEACS亚组)249例,男156例,女93例,平均年龄(66.4±9.6)岁;ST段抬高型急性心肌梗死亚组(STEMI亚组)165例,男126例,女39例,平均年龄(63.8±12.3)岁。冠心病影像诊断标准为冠脉直径狭窄≥50%。稳定型心绞痛、NSTEACS和STEMI诊断标准参照美国心脏病协会(AHA)/美国心脏病学会(ACC)的相关指南。所有研究对象进入研究之前两周内未曾服用阿司匹林、氯吡格雷等抗血小板药物和非甾体类抗炎药物及抗凝药物。除外瓣膜性心脏病、心肌病、风湿性疾病、血液系统疾病、感染性疾病和恶性肿瘤等。
方法:血小板功能检查在患者入院后尚未开始抗血小板等药物治疗之前急查或次日早晨空腹下完成,其他实验室检查指标均于入院次日早晨空腹采集血标本。所有检查均由专人完成。检查方法:① MPV、血小板分布宽度、血小板压积和血小板计数:抗凝血2ml,使用日本希森美康公司的SYSMEX五分类血球计数仪XS-800I,用激光散射计数技术测定。② 高敏C反应蛋白:非抗凝血2ml,使用中国深圳国赛公司的QUICKREAD分析仪,用免疫比浊法测定,Quick-Read CRP试剂由芬兰ORION诊断公司提供。③ 血浆甘油三酯、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇、空腹血糖、肌酐、尿酸等血生化指标:非抗凝血2ml,使用日立H 7600全自动生化分析仪测定,试剂由北京利德曼生化技术有限公司提供。④冠脉病变积分:采用Gensini法[1],由两位医生分别阅读冠造结果计算获得,取其均值。
统计学方法:应用SPSS17.0统计软件对相关数据进行统计学分析。正态分布计量资料以均数±标准差表示。两组计量资料之间的比较用t检验。三组以上计量资料之间的比较用单向方差分析,进一步组间比较使用S-N-K检验,需控制其他混杂因素时使用单因变量的多因素方差分析。正态分布双变量相关性分析选择Pearson相关系数,非双变量正态分布资料相关性分析选择Spearman相关系数。多元线性逐步回归分析MPV与其他参数的相关关系。计数资料的比较用χ2检验。P<0.05为差异有统计学意义。
2 结果
临床资料:冠心病组男性比例、吸烟史、体重指数、糖尿病的发生率、白细胞计数、空腹血糖、肌酐、高敏C反应蛋白均高于对照组,高密度脂蛋白胆固醇低于对照组,差异有统计学意义(P<0.01 ~0.05)。表1
表1 649例患者的一般临床和实验室检查资料()

表1 649例患者的一般临床和实验室检查资料()
注:与对照组比较*P<0.05 **P<0.01 -:无
对照组(n=162)冠心病组(n=487)男[%(例)]48.14(78) 67.66(329)**年龄(岁) 63.92±9.59 64.92±10.77高血压[%(例)]71.60(116) 71.87(350)吸烟史[%(例)]38.89(63) 49.49(241)*体重指数(kg/m2) 25.36±2.41 26.59±3.13**糖尿病[%(例)]19.75(32) 44.56(217)**白细胞(×109/L) 6.81±1.89 8.09±2.82**空腹血糖(mmol/L) 5.87±1.38 6.54±2.32**尿酸(mmol/L) 351.21±92.35 351.37±98.04肌酐(mmol/L) 66.32±17.85 74.07±25.59**甘油三酯(mmol/L) 1.94±1.72 1.99±1.68总胆固醇(mmol/L) 4.74±1.08 4.74±1.09高密度脂蛋白胆固醇(mmol/L) 1.30±0.28 1.19±0.26**低密度脂蛋白胆固醇(mmol/L) 2.62±0.88 2.71±0.80高敏 C 反应蛋白(mg/L) 2.75±2.34 6.35±6.22**冠脉病变积分 - 49.34±36.73
冠心病组及其亚组与对照组间血小板功能参数的比较:MPV:冠心病组 [(10.16±1.15)fL]及其NSTEACS亚组[(10.15±1.21)fL]和 STEMI亚组[10.34±1.03)fL]高于对照组[(9.75±1.10)fL];NSTEACS亚组和STEMI亚组高于稳定型心绞痛亚组[(9.81±1.11)fL]。血小板压积:冠心病组[(0.30±0.32)%]及其 NSTEACS 亚组[(0.32±0.35)%]和STEMI亚组[(0.25±0.20)%]低于对照组[(0.33±0.37)%];NSTEACS亚组和STEMI亚组低于稳定型心绞痛亚组[(0.33±0.39)%]。上述比较差异均有统计学意义(P<0.01 ~0.05)。表2
冠心病组平均血小板体积与其他临床和实验室检查指标的双变量相关性分析:MPV与冠心病患者白细胞(r=0.097,P=0.032)、肌酐(r=0.125,P=0.005)、高敏C反应蛋白(r=0.167,P=0.000)和冠脉病变积分(r=0.165,P=0.000)呈显著正相关,MPV 与高密度脂蛋白胆固醇呈显著负相关(r=-0.139,P=0.002)。表3
表2 冠心病组及其亚组与对照组间血小板功能参数的比较()
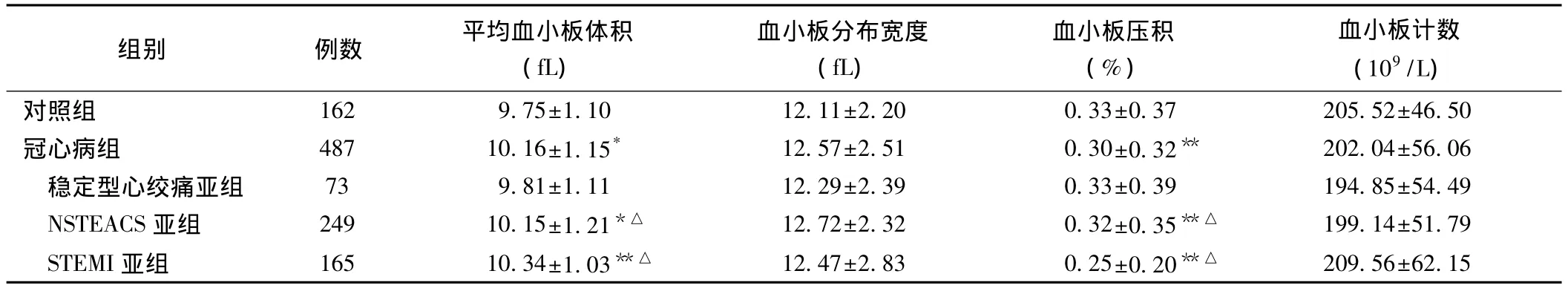
表2 冠心病组及其亚组与对照组间血小板功能参数的比较()
注:与对照组比较*P<0.05**P<0.01;与稳定型心绞痛亚组比较△P<0.01。NSTEACS:非ST段抬高型急性冠脉综合征 STEMI:ST段抬高型急性心肌梗死
组别 例数 平均血小板体积(fL)血小板分布宽度(fL)血小板压积(%)血小板计数(109/L)对照组 162 9.75±1.10 12.11±2.20 0.33±0.37 205.52±46.50冠心病组 487 10.16±1.15* 12.57±2.51 0.30±0.32** 202.04±56.06稳定型心绞痛亚组 73 9.81±1.11 12.29±2.39 0.33±0.39 194.85±54.49 NSTEACS 亚组 249 10.15±1.21*△ 12.72±2.32 0.32±0.35**△ 199.14±51.79 STEMI亚组 165 10.34±1.03**△ 12.47±2.83 0.25±0.20**△ 209.56±62.15

表3 冠心病组平均血小板体积与其他临床和实验室检查指标的相关性分析
平均血小板体积与各变量的多元回归分析:以MPV为因变量,以年龄、性别、高血压、糖尿病、吸烟史、体重指数、白细胞、空腹血糖、尿酸、肌酐、甘油三酯、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、高敏C反应蛋白和冠脉病变积分为自变量,多元线性逐步回归分析MPV的相关因素。与MPV显著相关的是高敏 C 反应蛋白(r=0.151,P=0.001)、冠脉病变积分(r=0.14,P=0.002)和高密度脂蛋白胆固醇(r=-0.121,P=0.008)。表 4

表4 平均血小板体积与各变量的多元回归分析
3 讨论
血小板的大小是血小板活化状态的主要决定因素,MPV是常用的反映血小板活性的参数,MPV的升高与出血时间缩短、血小板血栓素A2释放增加[2]、血小板膜糖蛋白Ⅰb和Ⅱb/Ⅲa受体表达增加呈显著正相关关系。高MPV是动脉粥样硬化和心肌梗死发生的独立危险因素[3-5],其危险度与肥胖或吸烟相当[6]。冠心病患者,随着病情的加重,血小板活性增加,MPV升高,STEMI和不稳定性心绞痛患者显著高于稳定性心绞痛患者[7,8],如同本研究结果。
冠心病患者MPV的升高与多种因素有关。本组资料中,单因素相关分析显示,外周血白细胞计数、血清高敏C反应蛋白、血肌酐和冠脉病变积分与MPV呈正相关,血清高密度脂蛋白胆固醇与MPV呈负相关。但多因素回归分析中,只观察到冠脉病变积分、血清高敏C反应蛋白和高密度脂蛋白胆固醇是MPV的相关因素。冠脉病变积分反映了冠脉病变的严重程度,而MPV与冠脉病变积分、病变血管支数、关键病变的数量及非罪犯病变都有密切的相关关系,MPV能反映冠脉病变的严重程度。本组资料中,从STEMI、不稳定型心绞痛到稳定型心绞痛,冠脉病变积分依次升高,MPV与冠脉病变积分独立正相关,提示MPV与冠脉病变严重程度有一致,即病情越重,冠脉病变积分越高,MPV越高,冠脉病变严重程度可能是MPV的主要影响因素。
血小板和C反应蛋白在动脉血栓事件中均发挥着重要作用,且相互影响,密切联系。C反应蛋白有可逆性促进血小板聚集和与内皮细胞黏附的作用[9,10],C反应蛋白水平的升高是外周血血小板-白细胞聚集体升高的独立预测因素[10]。C反应蛋白在动脉血栓事件中的作用部分归因于血小板的激活[11]。同时,活化血小板介导了低致动脉粥样硬化作用的五聚体C反应蛋白向高致动脉粥样硬化作用单聚体C反应蛋白的分解过程[12]。本组资料观察到高敏C反应蛋白与MVP有相关性,提示在冠心病发生发展过程中,血小板与C反应蛋白有着密切的联系。
本研究较早观察到血清高密度脂蛋白胆固醇与MPV显著负相关,血清高密度脂蛋白胆固醇的降低对MPV的升高有预测意义。此种结果进一步支持了高密度脂蛋白胆固醇对血小板活性有调节作用的观点[13]。通过增加血小板内一氧化氮合成酶的活性[14],抑制血管内皮细胞中血小板激活因子的合成[15],高密度脂蛋白胆固醇有降低血小板活性的作用。人工合成的高密度脂蛋白胆固醇对活性增加的血小板有直接抑制作用[16]。相反,高密度脂蛋白胆固醇水平下降,可能有促血小板活化的作用,高密度脂蛋白胆固醇降低是血小板性血栓形成的独立预测因子[17]。
血小板压积是血小板在全血中所占的容积百分比,与MPV和血小板计数密切联系,受血容量、血管收缩、血小板黏附聚集功能等因素的影响。本组资料观察到冠心病患者血小板压积的显著降低,具体机制不清楚,可能间接反映了冠脉缺血事件中存在血小板的过度消耗。
[1]Gensini GG.A more meaningful scorning system for determining the severity of coronary heart disease.Am J Cardiol,1983,51:606-606.
[2]Vizioli L,Muscari S,Muscari A.The relationship of mean platelet volume with the risk and prognosis of cardiovascular diseases.Int J Clin Pract,2009,63:1509-1515.
[3]Endler G,Klimesch A,Sunder-Plassmann H,et al.Mean platelet volume is an independent risk factor for myocardial infarction but not for coronary artery disease.Br J Haematol,2002,117:399-404.
[4]Kiliçli-Camur N,Demirtunç R,Konuralp C,et al.Could mean platelet volume be a predictive marker for acute myocardial infarction?Med Sci Monit,2005,11:CR387-392.
[5]Chu H,Chen WL,Huang CC,et al.Diagnostic performance of mean platelet volume for patients with acute coronary syndrome visiting an emergency department with acute chest pain:the Chinese scenario.Emerg Med J,2010,28:569-574.
[6]Slavka G,Perkmann T,Haslacher H,et al.Mean platelet volume may represent a predictive parameter for overall vascular mortality and ischemic heart disease.Arterioscler Thromb Vasc Biol,2011,31:1215-1218.
[7]Khandekarmm,Khurana AS,Deshmukh SD,et al.Platelet volume indices in patients with coronary artery disease and acute myocardial infarction:an Indian scenario.J Clin Pathol,2006,59:146-149.
[8]Chu SG,Becker RC,Berger PB,et al.Mean platelet volume as a predictor of cardiovascular risk:a systematic review and meta-analysis.J Thromb Haemost,2010,8:148-156.
[9]Preston RA,Jy W,Jimenez JJ,et al.Effects of severe hypertension on endothelial and platelet microparticles.Hypertension,2003,41:211-217.
[10]Yaron G,Brill A,Dashevsky O,et al.C-reactive protein promotes platelet adhesion to endothelial cells:a potential pathway in atherothrombosis.Br J Haematol,2006,134:426-431.
[11]Shantikumar S,Grant PJ,Catto AJ,et al.Elevated C-reactive protein and long-term mortality after ischaemic stroke:relationship with markers of endothelial cell and platelet activation.Stroke,2009,40:977-979.
[12]Eisenhardt SU,Habersberger J,Murphy A,et al.Dissociation of pentameric to monomeric C-reactive protein on activated platelets localizes inflammation to atherosclerotic plaques.Circ Res,2009,105:128-137.
[13]Barlage S,Boettcher D,Boettcher A,et al.High density lipoprotein modulates platelet function.Cytometry A,2006,69:196-199.
[14]Chen LY,Mehta JL.Inhibitory effect of high-density lipoprotein on platelet function is mediated by increase in nitric oxide synthase activity in platelets.Life Sci,1994,55:1815-1821.
[15]Sugatani J,Miwa M,Komiyama Y,et al.High-density lipoprotein inhibits the synthesis of platelet-activating factor in human vascular endothelial cells.J Lipid Mediat Cell Signal,1996,13:73-88.
[16]Calkin AC,Drew BG,Ono A,et al.Reconstituted high-density lipoprotein attenuates platelet function in individuals with type 2 diabetes mellitus by promoting cholesterol efflux.Circulation,2009,120:2095-2104.
[17]Naqvi TZ,Shah PK,Ivey PA,et al.Evidence that high-density lipoprotein cholesterol is an independent predictor of acute platelet-dependent thrombus formation.Am J Cardiol,1999,84:1011-1017.

