病毒感染对细胞凋亡的影响及作用机制
贾 宁,孙荣钊
(青岛农业大学动物科技学院,山东 青岛 266109)
细胞凋亡是机体在生理条件下受到内外信号刺激时,启动由细胞本身主动调控的具有一定程序的死亡,故又称程序性细胞死(programmedcelldeath,PCD)。在多细胞生物当中,细胞的死亡有两种不同的方式:一种是坏死性或事故性损伤,它是由于某些外界的因素,如贫血、理化因素、缺氧、pH值低下、高热或其他理化创伤因子的作用下造成细胞急速死亡而造成不可逆的损伤;另一种温和的细胞死亡形式称为细胞凋亡,它是由基因编码的细胞程序性死亡过程。细胞凋亡是机体对外界刺激进行的主动应答,这对于维持机体内环境稳定、免疫系统正常功能、调控机体发育等具有着重要意义。
1972年Kerr等[1]首先用细胞凋亡(apoptosis)这一术语来描述细胞死亡的另一种方式,其在发生机制和形态特征上与细胞坏死(necrosis)不同。越来越多的资料表明病毒感染能诱导宿主细胞凋亡[2]。病毒诱导细胞发生凋亡,限制病毒复制,可以看作宿主一种细胞水平的病毒防御机制;病毒基因或因病毒感染诱导表达的细胞蛋白抑制了凋亡,造成持续性感染以及潜伏感染,导致机体长期带毒而无明显的临床症状。
1981年Ezoe等[3]用能产生Cyt/Dey的腺病毒突变体感染细胞,伴随着宿主细胞和病毒DNA降解,细胞迅速死亡,这是病毒感染诱导细胞凋亡研究的首次报道。试验表明:病毒感染诱发的细胞凋亡常与一些疾病的发生密切相关。因此,研究病毒感染宿主细胞后调节细胞凋亡的机制不仅有助于深入理解病毒的致病机理和开发新的抗病毒制剂,还为探索细胞内分子事件打开了窗口。这些研究对治疗人类病毒性疾病意义深远。
1 细胞凋亡的功能
细胞凋亡的主要功能是清除那些对整个机体有害的细胞,为抵抗病毒感染和癌症发生提供一种机制。病毒感染细胞通常被病毒专一性淋巴细胞或由某些细胞因子启动的细胞凋亡程序识别并摧毁。一些病毒在感染期间直接诱导细胞凋亡。与此同时,许多病毒为了有利于自身的复制而得到更多的子代,已进化出阻碍细胞凋亡并延长宿主细胞历期的机制。由于病毒是一类分子生物,病毒蛋白以分子形式参与细胞凋亡的调控,利用病毒与细胞相互作用研究细胞凋亡调控的生化途径具有重要意义。
2 病毒感染调控细胞凋亡的机制
一般来说,病毒调节靶细胞凋亡的途径主要有两种:经免疫系统介导或病毒本身具有凋亡调节基因;病毒凋亡调节基因通过模仿或调节细胞凋亡途径中某些保守成份而发挥作用。细胞调亡调控的生化途径实际上是一个信号传导系统,对于这一系统的研究现已取得了很大进展。
2.1 经免疫系统介导细胞凋亡
病毒感染可激活CTL介导细胞凋亡,CTL对清除动物体内病毒具有重要意义。CTL主要通过两条途径杀死已被病毒感染的细胞。(1)通过分泌穿孔素和颗粒酶。在MHCⅠ类抗原诱导之下,CTL与被病毒感染的细胞结合,首先是穿孔素颗粒释放,继而进入靶细胞胞膜,在胞膜中生成小孔,颗粒酶进入靶细胞。在此过程中,颗粒酶B激活ICE样蛋白酶,后者特异性地切断DNA依赖的蛋白激酶催化亚单位(DNA-PKcs),其被切断后引起DNA损伤后的修复障碍。同时,颗粒酶B切断Caspase-3,产生可降解PARP(Poly(ADP-ribose)polymerase)的活性产物,PARP的活性产物又能激活Caspase-3的蛋白水解作用。(2)通过上调Fas/FasL基因表达,激活磷酸酯酶,合成神经酰胺,神经酰胺进一步激活丝/苏蛋白激酶,通过信号转导激活细胞凋亡。另据国外报道,CTL细胞上蛋白酶gzmA和gzmb及穿孔素与细胞凋亡关联性较高,使用体外病毒免疫的CTL和具有抗Fas的EL4.F15作为靶细胞进行研究显示:gzmA(+)或gzmb(+)的CTL诱导EL4.F15细胞出现早期凋亡特征。再者,凡有gzm介导的细胞凋亡特征均不同程度的与穿孔素有关,穿孔素明显影响了CTL和gzm发挥作用[4]。Sabri等[5]研究发现病毒活化的CTL还可通过分泌因子诱导星形神经胶质瘤细胞发生凋亡,并且TNF-α和IFN-α对于CTL因子诱导的细胞凋亡有协同作用。
2.2 病毒直接调节凋亡
2.2.1 抑制细胞凋亡的病毒蛋白
目前已发现20种以上病毒蛋白能抑制细胞凋亡,这些病毒蛋白来源不同,调控机制各异。随着国内外研究工作的深入,未来会发现更多的病毒蛋白能影响细胞凋亡的生化途径(表1)。
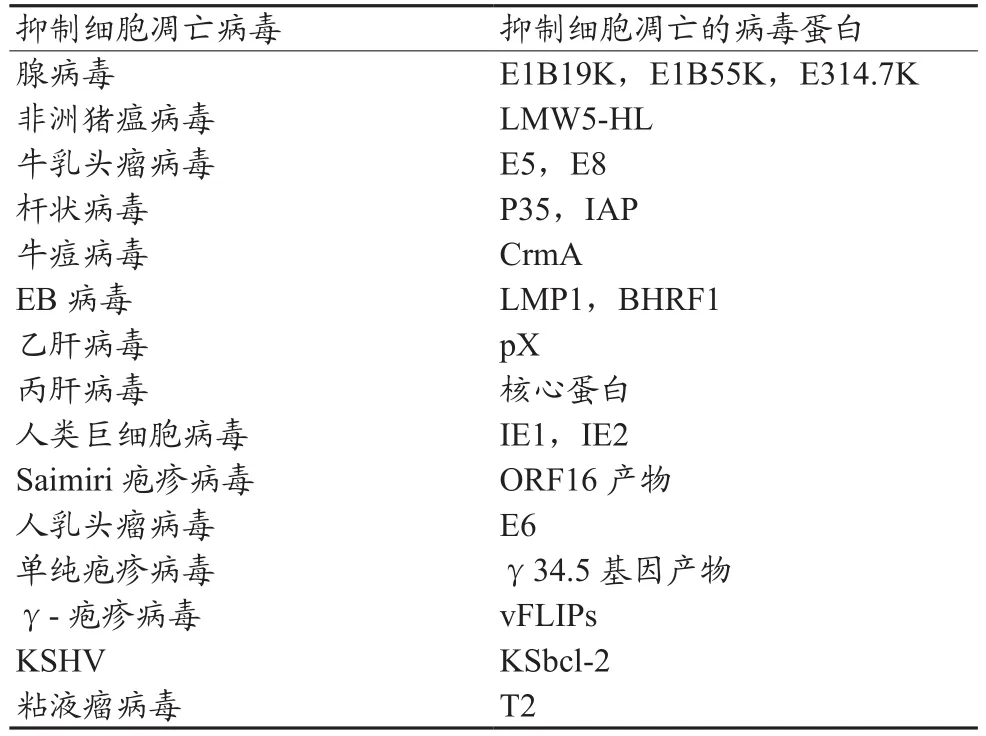
表1 抑制细胞凋亡的病毒蛋白
2.2.2 促进细胞凋亡的病毒蛋白
病毒感染宿主细胞后,有机体的反应之一就是通过细胞凋亡清除那些被感染的有害细胞,病毒蛋白引发细胞凋亡是病毒感染过程中的普遍现象。目前已确定多种病毒蛋白能引发细胞凋亡(表2)。
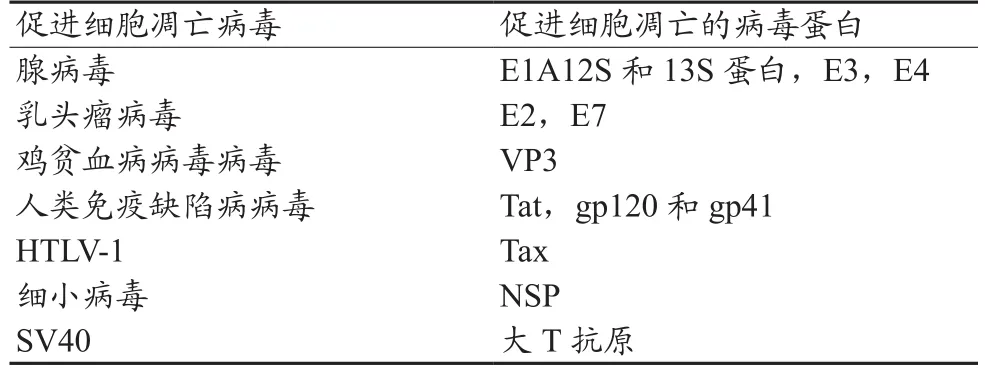
表2 促进细胞凋亡的病毒和病毒蛋白
3 病毒感染相关的细胞凋亡分子
3.1 53途径
又称抑癌蛋白或肿瘤抑制基因,分子量为53kD,分为野生型和突变型。野生型p53促进细胞凋亡,p53突变体则抑制细胞凋亡。p53是一种转录调节因子,它能促进多种基因的表达,进而诱导细胞凋亡。
Devireddy等研究牛单纯疱疹病毒I型感染外周血单核细胞发现,病毒感染细胞后p53数量和活性增高,并且刺激激活p21和Bax,同时激活Caspase,后者作用其底物PARP、actin及切断抑制凋亡的Bce-lxL,诱导细胞凋亡。
KomotoS等[6]研究发现人免疫缺陷病毒Ⅰ型通过p53的表达诱导T细胞凋亡。
erradillos等[7]发现,p53虽然可以促进细胞凋亡,但不是细胞凋亡的必要条件。例如:乙型肝炎病毒的HBx蛋白诱导细胞凋亡就是非p53依赖性的。
3.2 Caspases家族
Caspase(cysteinylaspartate-specificproteinase,Caspase)译名为半胱氨酸天冬氨酸酶,简称为半胱天冬酶。它是一组系列化蛋白酶的总称,国外报道称目前发现有13种以上,分别命名为Caspase-1、Caspase-2等,它们都是ICE/CED-3的同源物。Caspase中的“C”代表这种蛋白酶具有半胱氨酸(Cysteine)蛋白酶活性,“aspase”表示其在天冬氨酸(asparicacid)后切割蛋白。激活的Caspase可作用于其自身和其他Caspase酶原,按一定顺序激活Caspase,激活的Caspase作用于不同底物,能够加快细胞凋亡。生长因子的撤除、受体配体的作用、药物作用及病毒感染,这些诱发细胞死亡的刺激均可激活Caspase。
现已经证实猪传染性胃肠炎病毒通过caspase-6、caspase-7来发挥作用;鸡传染性支气管炎病毒通过caspase-3发挥作用。CarrascosaAL等[8]证实了非洲猪瘟病毒诱导Vero细胞凋亡的过程中伴随着caspase-3的激活。
3.3 Fas/FasL系统
Fas又称APO-1或CD95,是Ⅰ型跨膜蛋白,属于肿瘤坏死因子/神经生长因子受体(TNFR/NGFR)超家族,其与TNFR、NGFR、CD27、CD30等约有30%的同源性,FasL、属TNF家族成员,是Ⅱ型跨膜蛋白。Fas相关蛋白(FADD)是存在于胞质中的一种蛋白质,在凋亡信号刺激下,Fas与其受体FasL结合,然后Fas的死亡域(DD)与FADD死亡域结合,诱导FADDN端的死亡效应区(DED)与pro-caspase8(或pro-caspase10)中的DED结合,形成一个新的死亡诱导信号复合物——(DISC)。该复合物能解除分子自我抑制、形成活化的异四聚体,使下游pro-Caspase水解活化,再通过一系列Caspase级联激活反应诱导凋亡发生。
病毒感染介导细胞表达Fas/FasL,或上调Fas、FasL的表达,促进细胞凋亡。研究发现:HIV感染人巨噬细胞后,可经病毒直接作用或病毒感染产生的细胞因子及可溶性病毒蛋白间接作用,介导巨噬细胞FasL表达增加,且FasL表达程度与体内组织细胞凋亡密切相关[9]。Nicho1s等[10]分析了流感病毒感染后的淋巴细胞亚群,CD4+、CD8+、CD19+淋巴细胞均出现了凋亡,而且凋亡细胞表面高表达FasL,非凋亡细胞低表达FasL,当加入抗Fas、FasL抗体共同培养后,细胞凋亡显著减少。流感病毒诱导细胞凋亡的机制可能是:感染刺激机体产生IFN-γ、IFN-β和dsRNA,它们均可提高Fas表达,Fas与表达在CTL或其他细胞上的FasL结合形成三聚体后,一方面依次激活蛋白激酶途径、三磷酸肌醇和二酰基甘油途径以及钙信号途径激Ca2+/Mg2+依赖性核酸酶,导致DNA断裂和染色质固缩;另一方面,通过Fas的FADD活化Caspase途径,依次激活蛋白酶链裂解各种底物以诱导细胞凋亡。Shin等[11]通过HBV基因组HBX、和突变的HBX基因转染PLC/PRF/5肝癌细胞,在HBV或HBX转染的PLC/PRF/5细胞检测到了FasL的表达,而突变的HBX转染的PLC/PRF/5细胞没有检测到FasL的表达,证实HBV的X基因在诱导肝癌细胞FasL的表达中起了重要作用。Yoo等[12]研究发现HBX蛋白可以增强Egr-2和Egr-3的转录活动和反式激活功能,进而增强FasL的转录活性,反义Egr-2、Egr-3,可以抑制FasL的表达。另有研究发现,HBX的羧基端对于FasL和Egr的转录活化是必不可少的。
3.4 TRAIL
TNF相关凋亡诱导配体(TNF related apoptosis inducing ligand,TRAIL)属于Ⅱ型跨膜糖蛋白,与其结合的受体有5个:DR4、DR5、DcRl、DcR2、OPG。其中,DR4和DRS被认为是转导TRAIL凋亡信号受体,TRAIL与受体结合后可激活NF-κB、JNK通路和caspase级联反应,进而介导细胞凋亡。Huang等[13]研究发现,鸡新城疫病毒(NDV)可通过TRAIL诱导细胞凋亡。Liang等[14]通过建立3种细胞模型:肝癌细胞株BEL7402、BEL7402-HBX(将包含HBX基因的pcDANHBX转染BEL7420获得)和对照细胞BEL7420-cDNA(转染了pc-DAN3的BEL7420细胞),针对HBX与TRAIL的关系进行一系列试验,得出结论:BEL7402,BEL7402-HBX,BEL7402-cDAN3种细胞与TRAIL存在一个剂量依赖的细胞毒作用,在浓度相同的条件下,通过TRAIL处理,BEL7402-HBX的凋亡率及对capase-3的活化率比其他2种细胞具有更高水平。
以往的观点认为TRAIL通常只引起肿瘤及转化细胞的凋亡,对正常细胞不敏感,但最近对HIV-1研究表明,TRAIL还介导了神经元细胞和CD4+T细胞的凋亡[15]。
3.5 bcl-2基因家族
B细胞淋巴瘤/白血病-2(Bcelllymphoma/leukemia-2,bcl-2)是凋亡研究中最受重视的癌基因之一。bcl-2家族包括抑制凋亡的bcl-2、bcl-XL、mcl-1、A1和ced-9等,促进凋亡的bax、bad和bcl-Xs等成员。它们相应的cDNA编码Bcl-2蛋白家族均有BH1和BH2两个高度同源序列。BH1和BH2同源结构域是Bcl-2家族成员形成同型或异型二聚体并参与细胞凋亡调节的主要结构基础。bcl-2正常表达可使许多细胞免于凋亡,但bcl-2抑制凋亡具体作用机制尚不清楚,因受多种不同信号刺激趋于凋亡的细胞均可被bcl-2表达所补救,故推测bcl-2可能于凋亡后期某个环节发挥作用。研究表明,bcl-2/Bax两蛋白之间的比例是决定对细胞凋亡抑制或促进的关键因素。HIV的gp120与CD4交联后,选择性降低bcl-2表达,对HIV介导CD4+T细胞凋亡是必须的。Jackson等研究发现狂犬病病毒感染小鼠引起神经元Bax表达升高,使bcl-2/Bax比例失调,从而介导细胞凋亡。
3.6 TNF-α/TNFR-1途径
肿瘤坏死因子(TNF-α)属TNF家族成员,它是一种主要由单核巨噬细胞分泌的具有多种生物学活性的多肽调节因子。其受体TNFR1和TNFR2存在于多种细胞表面。TNFR1与Fas在结构上同源,若激活可诱导细胞凋亡。TNFR2则不参与细胞凋亡。TNF-α与TNFR1结合后,使TNFR1的死亡结构域与受体作用蛋白(RIP)和TNFR1相关蛋白(TRADD)结合,然后RIP的死亡结构域再结合RIP相关半胱氨酸同源蛋白,继而将pro-caspase2激活,继之激活pro-caspase8,最后通过caspase的级联激活反应导致靶细胞凋亡。
3.7 细胞因子介导的细胞凋亡
细胞因子是免疫细胞或某些基质细胞合成的一种异质性肽类调节因子,与细胞凋亡有关的细胞因子主要有神经生长因子(NGF)、干扰素(IFN)、肿瘤坏死因子(TNF)、集落刺激因子(CSF)及转化生长因子(TGF)等[16]。
3.7.1 TGF途径
转化生长因子(TGF)分为TGF-α和TGF-β两种。TGF-β既能增强某些细胞的增殖、分化能力,又能诱导某些细胞的凋亡反应。
病毒感染靶细胞后,可使TGF-β数量及活性会增高,加速了凋亡发生。Lin等[17]在对马流感病毒感染MDCK细胞研究中发现,TGF-β1表达增加,从而激发JNK/SAPK信号途径介导细胞凋亡。研究显示TGF-β的凋亡与Bcl-2表达减少、caspase3表达增加有关。Schultz等[18]研究发现,流感病毒NA具有唾液酸酶作用,病毒感染细胞后,NA裂解TGF-β前体上的唾液酸残基,释放成熟的TGF-β,使得细胞表而或细胞外基质中TGF-β活性增强,造成细胞凋亡发生。
3.7.2 IFN途径
IFN介导细胞凋亡最主要方式是通过激活PKR,高表达Fas来实现。IFN-γ还能诱导巨噬细胞产生NO,NO反过来又能协同IFN-γ导致巨噬细胞凋亡。Zhirnov等[19]试验证明:病毒对IFN合成功能不同的细胞诱导凋亡的效应明显不同,因此推测,病毒诱导细胞凋亡机制与IFN抗病毒作用机制相关联。此外,还发现流感病毒蛋白NS1诱导细胞凋亡作用也依赖IFN。
4 结语
病毒感染能引起细胞凋亡或程序性死亡。随着专家们对这一机制研究的深入,这种论断已渐渐清晰。病毒感染介导细胞凋亡,是一把双刃剑。它既是机体对周围未感染细胞的一种保护性机制,亦是细胞在病毒感染后,一些病毒蛋白引发细胞凋亡、迅速导致宿主组织细胞损伤的重要机制。这一机制被一些科研工作者所利用,即使用一些病毒,如腺病毒、狂犬病毒、疱疹病毒等“以毒攻毒”,借助病毒裂解恶性肿瘤细胞,取得了可观的成果。
目前,有关这方面的探索极为迅速。而开发多种新方法治疗临床一些棘手的病症,把促进凋亡与抑制凋亡的这些病毒产物或模拟其功能的制剂应用于病毒感染不同阶段,这具有非常重要的现实意义。相信在不久的将来,还会揭示更多未知的细胞凋亡调节机制,这些机制会让人们从更全面的角度理解病毒与宿主的关系。
[1]Kerr J F R, Wyllie A H, Currie A R. Apoptosis:a basic biological phenomenon with wide-ranging implications in tissuekinetics[J]. Br J Cancer, 1972, 26(4):239-257.
[2]Muller A, Rudel T. Modif i cation of host cell apoptosis by viral and bacterial pathogens[J]. Int J Med Microbiol,2001,291(3):197-207.
[3]Ezoe H, Fatt R B L, Mak S. Degradation of intracellular DNA in KB cells IFNected with cyt mutants of human adenovirus-type-12[J]. Virol, 1981,40(1):20-27.
[4]Pardo J, Bosque A, B rehm R,et al. Apoptotic pathways are selectively activated by granzyme A and / or granzyme B in CTL-mediated target cell lysis[J]. J Cell Biol, 2004,167(3):457-468.
[5]Sabri F, Chiodi F, Piret J P, et al. Soluble factors released by virus specif i c activated cytotoxic T-lymphocytes induce apoptotic death of astrogliom a cell lines [J]. Brain Pathol,2003,13(2):165-175.
[6]Komot o S, Kinomot o M,Horikos hi H,et al. Ability to induce p53 and caspase-mediated apopt osis in primary CD4+ T cells is variable among primary isolates of human im munodeficiency virus type 1[J]. AIDS Res Hum Retroviruses , 2002,18(6):435-446.
[7]Terradill os O, Pollcino T , Lecoeur H, et al . p53-indepen dent apoptotic effects of the hepatitis B virus HBx protein in vivo and in vitro[J]. Oncogene, 1998,17(16):2115-2123.
[8]Carrascosa A L, Bustos M J, Nogal M L, et al . Apoptos is induced in an early step of African swine fever virus entry into vero cells does not requir e virus replication[J]. Virology,2002,294(2):372-382.
[9]Ashkenazi A, Dixit V M. Death receptors: signaling and modulation[J]. Science, 1998,281(5381):1305-1308.
[10]Nichols J E, Niles J A, Roberts N J. Human lymphocyte apoptosis after exposure to IFNluenzaA virus [J]. JVirol,2001, 75(13):5921-5929.
[11]Shin E C, Shin J S, Park J H, et al. Expression of fas ligand in human hepatom a cell lines: role of hepat itis-B v irus (HBX)in induction of Fas ligand [J]. Int J Cancer,1999,82(4):587-591.
[12]Yoo Y G, Lee M O. Hepatitis B virus X protein induces expression of Fas ligand gene through enhancing transcriptional activity of early growth response factor[J]. J Biol Chem, 2004,279 (35):36242-36249.
[13]Huang Y, Erdmann N, PengH, et al. The role of TNF related apoptosis -inducing ligand in neurodegenerative diseases[J].CellMol Immunol, 2005,2(2):113-122.
[14]Liang X, SunW, Gao L,et al. Hepatit is B virus X prote inmodulates the apoptosis of hepatom a cell line induced by TRAIL [J]. Sci China C Life Sci,2005,48(3):277-286.

