解毒护肝饮药物血清对异烟肼致HepG2坏死和凋亡的干预
杨铂 刘靓雯 王小利 袁成民 安勇
中医药对于抗结核药引起的药物性肝炎有较好临床疗效,但是由于体外实验研究模型不稳定,深入的疗效机制研究少见。本实验建立了异烟肼致人肝癌细胞株(human hepatocellular carcinoma cell lines,HepG2)细胞坏死和凋亡的细胞模型,制备解毒护肝饮药物血清干预,旨在发现其抗肝细胞损伤的疗效并分析其形成机制。
1 材料与方法
1.1 仪器与试剂
RPMI1640培养液(美国GBCO公司);小牛血清(美国GBCO公司);流式细胞仪(双激光、六色)[美国BD公司(FACS Canto)];FITC Annexin V Apoptosis Detection Kit(BD Biosciences);FITC CD95(20 μl/test)及溶血素(BD公司);PE anti-human CD95 Ligand(5 μl/test)(eBioscience公司);异烟肼注射液(天津金耀氨基酸有限公司,批号:0809162,规格:100 mg/2 ml);HepG2细胞株(山东省医学科学研究院孟红教授赠)。
1.2 药物血清的制备
1.2.1 动物 雄性wistar大鼠15只,山东大学实验动物中心提供,(200±20)g,许可证号:SCXK(鲁)20090001,NO:0009272。环境:山东省中医药研究院动物实验中心,SPF级,许可证号:SYXK(鲁)20050052。
1.2.2 药物 茵陈30 g、生甘草15 g、赤芍15 g、大黄6 g、栀子10 g、生地黄10 g、枸杞15 g、郁金10 g、白茅根15 g、白术15 g、砂仁9 g。上述药物水煎浓缩混匀后配制成100 ml水混悬液,充分混匀后给药。相当于临床等效量的倍数计算:按人与大鼠体表面积换算法计算大鼠一日临床等效量[1]:150 g(成人一日量)×0.09/kg=13.5 g/kg。甘草酸二铵胶囊:同样计算方法,临床一日等效量150 mg×0.09/kg=13.5 mg/kg。
1.2.3 方法 随机分为正常组、甘草酸二铵胶囊组、中药组,每组5只,分别给予蒸馏水和上述含甘草酸二铵及中药的混悬液。灌胃给药,连续7天,末次灌胃90分钟后,离心收集血清,56℃灭活30分钟,经0.22 μm滤器抽滤除菌后-70℃保存,备用。
1.3 细胞培养及给药方法
以HepG2细胞为研究对象。参考Schwab CE的方法[2],取对数生长期HepG2细胞接种6孔板,每孔1×105细胞,放入CO2培养箱培养24小时。24小时后,吸去培养液,实验共分为空白组、模型组、甘草酸二铵胶囊组,解毒护肝饮中药组(简称中药组)。后两组培养液用RPMI1640基础培养液配制含甘草酸二铵胶囊和中药10%浓度的鼠血清;空白组和模型组为RPMI1640基础培养液配制的10%正常鼠血清。选择并配制异烟肼浓度为4 mg/ml,接种于除空白组外其他组细胞。培养24小时后,记录各组细胞不同程度的病变效应并分别收集细胞用流式细胞仪检测各组细胞凋亡率。
1.4 观察指标及方法
1.4.1 显微镜下观察细胞不同程度的病变效应
1.4.2 凋亡检测 收集的细胞用PBS洗2次,1×结合缓冲液重悬1×106细胞。取100 μl(1×105细胞)加入到绝对计数管。加5 μl FITC AnnexinV和5 μl PI。轻轻涡旋细胞,室温孵育15分钟。加400 μl 1×结合缓冲液,待检,1小时内上机检测。
1.4.3 Fas/FasL(CD95/ CD95 Ligand)检测 收集培养24小时的HepG2细胞,PBS洗两次,PBS重悬细胞。取100 μl(1×106)细胞加入到绝对计数管。加20 μl FITC CD95和5 μl PE anti-human CD95 Ligand。轻轻涡旋细胞,室温避光孵育15~30分钟。加2 ml PBS,1000 转/分离心。弃上清,加入500 μl鞘液,待检。
2 结果
2.1 显微镜下观察各组HepG2细胞病变情况
与空白组细胞相比,模型组细胞发生肿胀变性及细胞脱落死亡的情况严重,中药组和甘草酸二铵胶囊组都相对较轻,中药组细胞损伤情况略优于甘草酸二铵胶囊组。见图1。
2.2 各组HePG2细胞凋亡和坏死情况
Annexin V/PI染色中AnnexinV+为早期凋亡,PI+为坏死,AnnexinV+/PI+为坏死或晚期凋亡,以上各项相加为细胞总死亡率。模型组细胞的死亡率最高,达36.9%,甘草酸二铵胶囊组和中药组死亡率明显下降,分别为18.4%和14.4%,中药组略优于甘草酸二铵胶囊组。模型组细胞凋亡率达18.1%,甘草酸二铵胶囊组和中药组凋亡率明显下降,分别为4.1%和3.2%,中药组同样优于甘草酸二铵胶囊组。见表1。

图1 HepG2细胞显微镜下病变效应
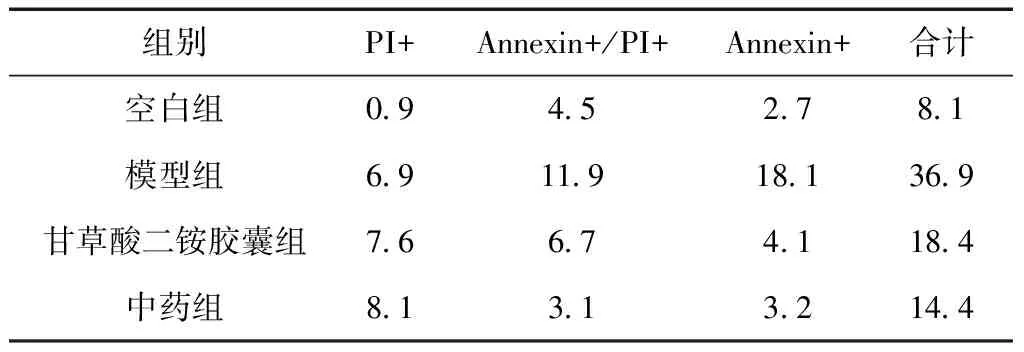
组别PI+Annexin+/PI+Annexin+合计空白组09452781模型组69119181369甘草酸二铵胶囊组766741184中药组813132144
2.3 Fas/FasL表达率
与空白组相比,模型组的Fas/FasL染色率明显增加,分别为11.6%和22.1%,甘草酸二铵胶囊组和中药组相应数值明显减小,中药组表达率尤其更低,分别为6.7%和8.2%。提示解毒护肝饮可以降低Fas和FasL的表达。见表2。
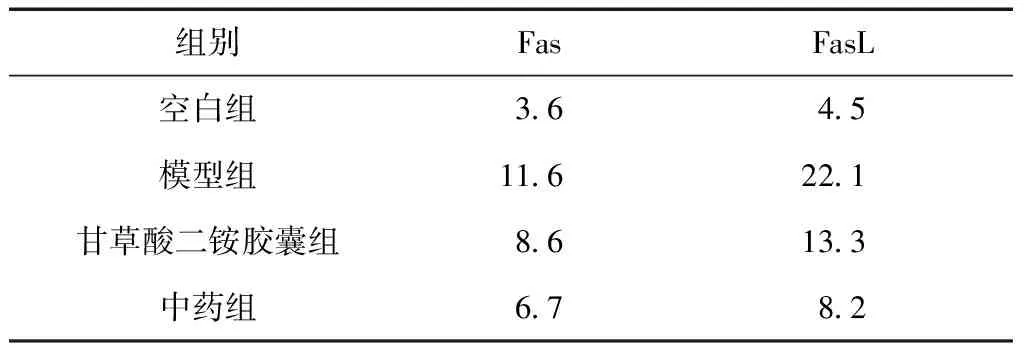
表2 Fas/FasL染色率(%)
3 讨论
N-乙酰基转移酶是异烟肼肝内代谢的关键酶,根据其代谢效率分为快乙酰化和慢乙酰化两种类型,而慢乙酰化者使异烟肼在体内的代谢中产物得以蓄积,这些产物正是导致异烟肼肝毒性的主要物质。Cho HJ[3]、Huang YS[4]等观察发现慢乙酰化者发生异烟肼肝损伤的风险为快乙酰化者的3.8倍,慢乙酰化者发生肝损伤时转氨酶水平更高,认为乙酰转移酶的快慢分型是可以用来预测抗结核药介导的肝毒性损伤的有效手段。而既往国内文献报道的异烟肼肝损伤模型多以动物或者原代人肝细胞为研究对象,由于很难保证其种属一致及确定为慢乙酰化基因的肝细胞株,其重复性差。正如沈冲等[5]指出由于异烟肼代谢有关的细胞色素P450酶个体差异和种属差异都较大,因此以不同的动物模型[6,7]为肝毒性评价体系的试验中得出的实验结论存在很大不确定性。本实验中应用的HepG2是一个肝肿瘤细胞系,可以用于评价肝细胞毒性的研究[8,9]。用HepG2来评价异烟肼造成的肝损伤的理论依据在于HepG2是慢乙酰化肝细胞[10]。本试验建立了稳定的异烟肼致HepG2损伤模型,为进一步的研究提供了研究平台。
抗结核药引起肝损伤在中医辨证体系中有自身的特点。首先本病以痨病为基础,痨病病理性质的特点为阴虚火旺,正如《丹溪心法·痨瘵》所言“痨瘵主乎阴虚”。因此本病的发生首先有一个阴虚火旺的病理基础。其次,药毒直接伤肝,这种药源性病因不属于传统中药,但现代医学研究表明抗结核药物可直接在肝内转化为肝毒物质损伤肝脏。中医理论认为肝体即肝脏器官本身的物质基础[11],肝体阴用阳,肝体受损不足引起肝用不达。一方面,不能正常疏泄气机,引起气郁,木郁则化火、成瘀;另一方面,肝不助脾胃运化进而产生湿、痰。最终形成湿热痰瘀互结、肝阴不足的复杂证候。本方重用茵陈、生甘草为君药,解毒清热利湿;臣以生地、枸杞滋阴柔肝以补肝体,栀子、大黄增强君药清热利湿解毒的功效,与茵陈合用构成茵陈蒿汤,为清利肝胆湿热之名方,郁金疏肝利胆助肝用;佐以白茅根清热利湿退黄使邪有出路,利水而不伤阴,白术、砂仁健脾助运,防肝病之传变,也防止方中苦寒之品伤及脾胃,赤芍凉血活血除肝经瘀热。《张氏医通》指出:“诸黄虽多湿热,经脉久病,不无瘀血阻滞也。”故在辨证论治的基础上重用凉血活血之品,方中大黄、赤芍、郁金均有活血化瘀之力,合用以助利胆退黄。甘味药有和、缓之用,本方多用甘味之药,方中生地、枸杞、甘草、白茅根都为甘味之品,可以缓和药物毒之毒性,同时为避免甘味药过于滋腻“生中满”,选用砂仁、白术健脾化湿增强脾胃运化之力。全方攻补兼施,共奏补肝体助肝用,清热解毒祛湿化瘀之用。
Fas和FasL是介导细胞凋亡的一对膜蛋白,两者结合后通过结合胞内的死亡受体FADD/MORT1或DAXX,进而激活Capase 8[12]或Jnk通路引起表达Fas的细胞凋亡。在多种肝病中可发现其介导的肝细胞凋亡。本实验发现伴随着凋亡率的增加,HepG2细胞中Fas/FasL的表达增高,提示Fas/FasL活化参与了在异烟肼致HepG2的凋亡过程。解毒护肝饮药物血清可以减少异烟肼引起的HepG2坏死和凋亡,同时减少了Fas/FasL的表达,进一步研究发现抑制HepG2凋亡作用与其减少Fas/FasL的表达可能有关。
参考文献
[1] 宋卫国.柴茯调脂口服液对高血脂大鼠模型的影响[J].时珍国医药,2009,20(7):1755-1756.
[2] Schwab CE, Tuschl H.In vitro studies on the toxicity of isoniazid in different cell lines[J]. Hum Exp Toxicol,2003,22(11):607-615.
[3] Cho HJ, Koh WJ, Ryu YJ,et al. Genetic polymorphisms of NAT2 and CYP2E1 associated with antituberculosis drug-induced hepatotoxicity in Korean patients with pulmonary tuberculosis[J]. Tuberculosis (Edinb),2007,87(6):551-556.
[4] Huang YS, Chern HD, Su WJ, et al. Polymorphism of the N-acetyltransferase 2 gene as a susceptibility risk factor for antituberculosis drug-induced hepatitis[J]. Hepatology,2002,35(4):883-889.
[5] 沈冲,徐小梅,孟琴,等,原代肝细胞体外培养用于利福平和异烟肼肝毒性的研究[J].中国药科大学学报,2005,36(3):250-253.
[6] Sarich TC,ZHOU T,Adams SP,et al .A model of isoniazid-induced hepatotoxicity in rabbits[J].J Pharmacol Toxicol Methods,1995,34(2):109-116.
[7] Nicod L,Viollon C,Regnier A,et al.Rifampicin and isoniazid increase acetaminophen and isoniazid cytotoxicity in human HepG2 hepatoma cells[J].Hum Exp Toxicol,1997,16(1):28-34.
[8] Neuman MG ,Koren G,Tiribelli C.In vitro assessment of ethnol-induced hepatotoxicity on HepG2 cell line[J].Biochem Biophys Res Commun,1993,197(2):932-941.
[9] Shear NH,Malkiewicz IM,Klein D,et al.Acetaminophen-induced toxicity to human epidermoid celil line A431 and hepatoblastoma cell line HegG2 in vitro,is diminished by silymarin[J].Skin Pharmaco1,1995,8(6):279-291.
[10] Coroneos E, Sim E. Arylamine N-acetyltransferase activity in hum-an cultures cell lines[J]. Biochem J,1993,294(Pt2): 481-486.
[11] 尹常健.肝病用药十讲[M].北京:中国中医药出版社,1998:66-187.
[12] 魏家臣.Fas/FasL介导凋亡细胞机制及其病理生理意义[J].国外医学外科学分册,2003,30(1):21-23.

