污水中解有机磷微生物的筛选
黄巧娟,陈礼刚,蒋端生,王双辉
(湖南人文科技学院 生命科学系,湖南 娄底 417000)
近年来,随着经济发展的加快和人口的不断增长,我国水环境问题日益严重,水体富营养化尤其突出。氮、磷的输入尤其是磷的浓度升高是引起水体富营养化的关键因素,城镇生活污水的排放是水体磷污染的主要来源之一[1-3]。富营养化会影响水体的水质和水中植物的光合作用,造成鱼类大量死亡。富营养化的水中含有硝酸盐和亚硝酸盐,人畜长期饮用这些物质含量超过一定标准的水,也会中毒致病,对人类产生严重的潜在威胁。为解决磷污染所带来的危害,在污水进入水体之前进行有效处理,降低排放污水的磷浓度十分必要[4]。
目前国内外对降解有机磷的微生物有不少的报道,但大部分是在对土壤中有机磷细菌的研究[5-6],而从污水中分离有机磷降解菌的报道比较少,最新研究表明聚磷污泥是由几种不同的菌属组成[7]。本试验从不同污泥样品中筛选降解有机磷的菌株,并对其解磷能力进行初步测定,为探索微生物除磷在污水处理中的应用提供参考。
一 材料与方法
(一)样品
2011年4月,在湖南人文科技学院采取生活污泥(A)、污水沟污泥(B)、养鱼池污泥(C)作为试样。
(二)培养基
有机磷液体培养基:10g蛋白胨, 3g牛肉膏, 5g NaCl,溶于1000ml水,灭菌后,待培养液冷却到50℃以下,立即加入50ml由无菌生理盐水与现取卵黄按1:1比例配制的卵黄液。
有机磷固体培养基:将1000ml加琼脂的液体培养基冷却到50℃以下,立即加入50ml由无菌生理盐水与现取卵黄按1:1比例配制的卵黄液,并移入平板。
(三)试验方法
1. 菌种富集培养
分别取污泥样品装入三个容量为500ml,装有200ml有机磷培养液的三角瓶中,30℃,130r/min中的恒温摇床中培养,培养3d,如此重复3次,使细菌迅速繁殖。
2. 菌种分离纯化
用无菌移液管取1mL富集培养液的上清液,于盛有9ml无菌水的试管中,混匀,制成浓度梯度为10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9、10-10倍的稀释液。从各浓度梯度分别吸取0.1 mL稀释液于有机磷固体培养基平板,均匀涂布。28℃恒温箱倒置培养,每隔24h观察一次,记录菌种的生长情况。能产生透明圈的菌株即为解磷菌,将透明圈大的菌株挑出,进一步划线法纯化,得到纯菌株后,置于4℃冰箱中保藏。
3. 解磷能力的测定
透明圈法:将筛选到的菌株点接于固体平板中,培养数天,通过观察透明圈大小,测定菌落直径d和透明圈直径D[8]。
二 结果与分析
(一)解磷细菌的筛选
采用平板划线法将得到的菌株分离纯化,部分结果如下(如图1)。
观察分离纯化时的菌落形态,得到共有6株能解有机磷的微生物。A、B、C三个样品中均筛选出了解磷菌,其中C组筛选出的解磷菌解磷能力较强,并且菌株生长较好。对C组进行复筛,共筛出六个菌株,下表为经过48h的恒温培养后,六个菌株的菌落形态特征。
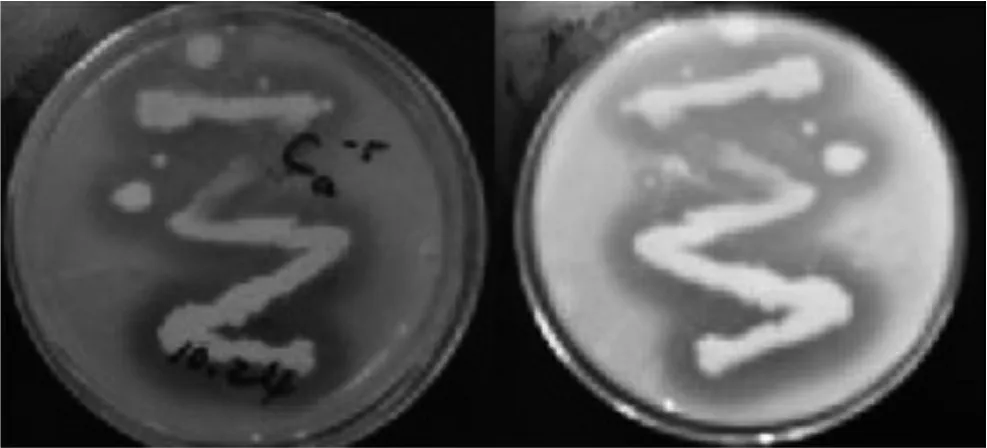
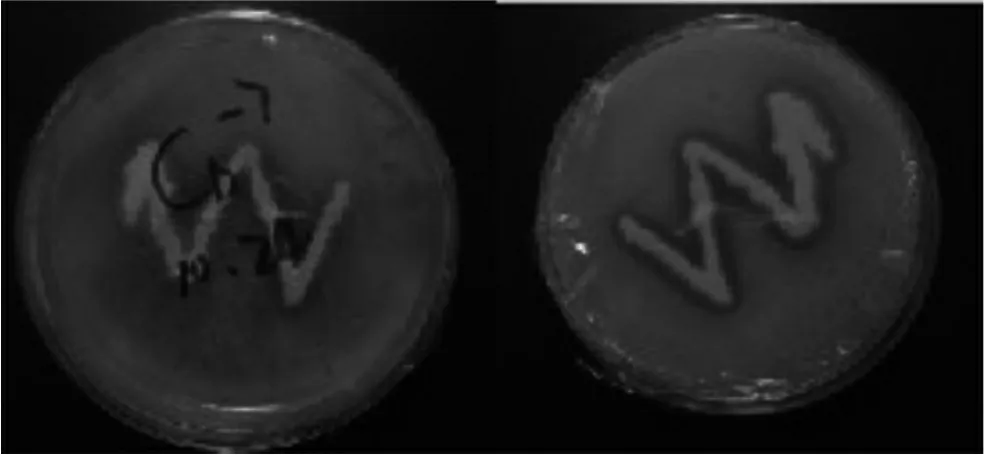
由表1可以看出,筛选出的解磷菌株多为白色圆形菌株。并且菌株多集中于10-4、10-5、10-6、10-7、10-8、10-9几个溶度梯度。其中,菌株边缘主要有规则、不规则、锯齿状几种。

表1 各类解有机磷细菌菌体菌落形态特征
(二)细菌解磷能力的初步测定
将筛选出的六个菌株接种在有机磷固体培养基上,28℃恒温培养箱倒置培养,按24,48,72,96,120h取出观察,结果详见表2。
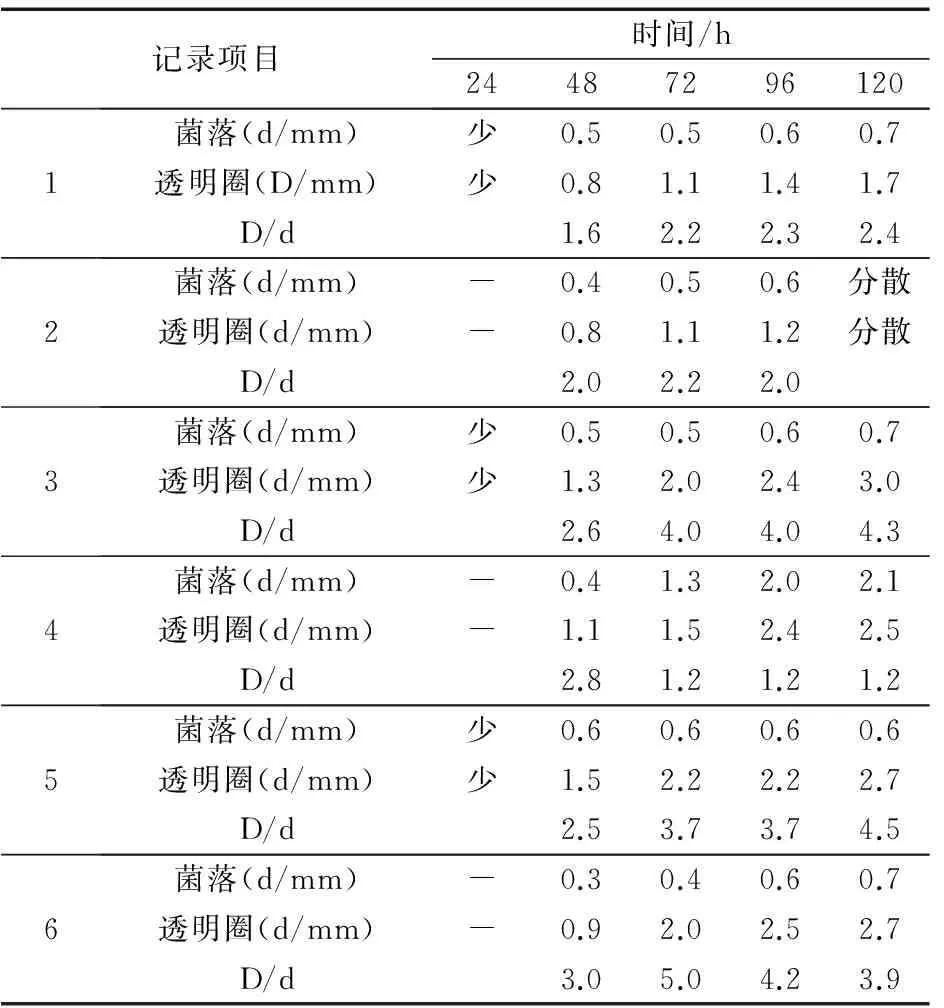
表2 透明圈法测定解磷微生物解磷能力
通过以上数据可以看出:在24h-48h这段时间内,解磷菌的菌落增长最快;在48h-72h这段时间内,解磷菌的解磷圈增长最快;在96h后解磷菌的解磷能力逐渐减弱;六种具有解磷能力的解磷菌中平均解磷能力强弱依次为 6号>3号>5号>1号>2号>4号, 3号和5号菌株解磷能力稳步增长,透明圈最大达到3.0mm;而6号菌株解磷能力最强,在72h时D/d达5.0。
三 讨论与结论
本试验从A、B、C三种污泥样品中筛选降解有机磷的菌株,其中从C组筛出的菌株解磷能力较强,生长较好。对C组进行复筛,共筛出六个菌株,并对其解磷能力进行初步测定。
试验结果表明,而多数研究者采用的蒙金娜培养基[5,8]不适合C组解磷菌的生长,故本试验直接采用添加了卵黄液的牛肉膏蛋白胨培养基作为筛选培养基。筛选出的菌株解磷能力强弱依次为 6号>3号>5号>1号>2号>4号。其中,6号菌株的D/d达5.0,3号和5号菌株生长良好,菌落均呈圆形,菌落小而透明圈大,三个菌株在培养了120h后仍呈现较强的解磷能力。
参考文献:
[1]国家环保局《水和废水监测分析方法》编委会.水和废水监测分析方法[M ]. 4版.北京:中国环境科学出版社,2002:243-250.
[2]洪葵,陈国强,黄为一,等.羟基丁酸及中链羟基脂肪酸共聚物的微生物合成[J].微生物学报,1998,25(2):110-113.
[3]HEIN S,PALETTA J R J,STEINBUCHEL A.Cloning,characterization and comparison of the Pseudomonas mendocina polyhydroxyalkanoate synthases PhaC1 and PhaC2[J].Appl Microbiol Biotehchnol.2002(58):229-236.
[4]SUDESH K,ABE H,DOI Y.Synthesis,structure and properties of polyhydroxyalkanoates: biologicalpolyesters[J].Prog.Polym.Sci.2000(25):1503-1555.
[5]赵小蓉,林启美.微生物解磷的研究进展[J].土壤肥料,2001,5(3):7-11.
[6]MINO T, VAN L M, HEIJNEN J. Microbiology and Biochemistry of the Enhanced Biological Phosphate Removal Process[J]. Water Res,1998,32(11):3193-3207.
[7]冯月红,姚拓,龙瑞军.土壤解磷菌研究进展[J].草原与草坪,2003,100(1):3-5.
[8]胡子全,赵海泉.一株有机解磷菌的筛选及其最佳生长条件的研究[J].中国给水排水,2007(17):66-70.

