人羊水来源c-kit+与c-kit-间充质干细胞生物学特征及体外心肌诱导分化能力的比较
白 静, 王一茹, 刘丽凤, 陈 杰, 苏绍萍, 王 禹
(1解放军总医院第一附属医院心内科, 北京 100048; 解放军总医院: 老年心血管病研究所2, 第九诊室3, 北京 100853)
心肌细胞的再生能力极其有限, 当大面积心肌梗死后造成大量细胞丢失, 几乎不可避免地发生心力衰竭。因此, 缺血性心脏病已经成为全球最主要的致死性疾病之一[1]。以细胞移植为基础的再生性治疗可以避免目前的药物治疗、器械辅助支持治疗以及心脏移植等的不足, 成为修复受损心肌的一种理想治疗方法。近20年来的研究显示, 多种来源的干细胞, 由于具有自我更新及多潜能分化能力, 显示了一定的再生性治疗的潜力。然而, 成体干细胞取材困难、成体组织干细胞含量低且细胞在体外增殖周期长等问题, 限制了临床应用。另一方面, 胚胎干细胞由于致瘤性及伦理学争议也受到限制。因此,需要一种新型的干细胞, 避免以上所有局限性。羊水中蕴含多种由发育中的胎儿的消化道、呼吸道、泌尿道以及胎膜脱落的细胞。常规的产前诊断就是通过羊膜腔穿刺技术获取少量羊水, 在体外培养羊水细胞, 进行核型分析来进行的。已经有研究显示,羊水中除存在大量不同来源的干细胞外, 还存在相当数量的祖细胞。2007年, De Coppi等[2]通过免疫磁珠从羊水中分选得到CD117+(c-kit)干细胞(接近羊水细胞的1%), 发现这些细胞可以在体外迅速增殖, 且传代250代后核型稳定。细胞表达间充质干细胞标记物(Oct-4)及胚胎干细胞标记物(SSEA-4)。许多学者认为c-kit+羊水干细胞处于成体干细胞及胚胎干细胞的中间阶段, 是一种新型干细胞来源, 并且其分化能力也优于所有成体干细胞。Da Sacco等[3]报道, 羊水中的细胞组成存在明显的“时限性”: 即不同孕周期, 细胞的组成不同。该研究提示, 可能c-kit+羊水干细胞在孕期中存在一定的表达规律。本研究旨在比较孕中期c-kit+与c-kit-羊水干细胞的生物学特征及心肌细胞分化能力, 并进一步评价c-kit+的心肌再生性治疗的潜能。
1 材料与方法
1.1 样本及羊水细胞
通过产前诊断或自愿引产, 经羊膜腔穿刺技术获取14份孕中期(15~31周)羊水。该操作获得解放军总医院第一附属医院伦理委员会批准。均征得孕妇本人及家属同意并签署知情同意书。研究中的羊水细胞均已证实无核型异常。
1.2 羊水细胞的体外分离、培养及分选
超声引导下, 行羊膜腔穿刺术抽取无菌羊水各10ml。羊水标本移入4℃冰箱运送至实验室, 4h内进行离心, 室温下1500r/min, 5min。弃上清, 将沉淀用α-MEM培养基(Gibico)重悬后加入20%胎牛血清(Gibico), 18% Chang Medium B+2% Chang Medium C(Irvine Scientific), 1%青链霉素, 1%谷氨酰胺(Gibico)。接种至25cm2培养瓶中, 37℃, 5% CO2饱和湿度孵箱培养。培养3~7d后, 非贴壁细胞及杂质被去除, 贴壁细胞继续培养。以倒置相差显微镜(Olympus IX51)观察细胞形态。待细胞生长至80%融合后以0.25% 胰蛋白酶和1mmol/L EDTA(Invitrogen)消化和传代。取羊水贴壁细胞, 使用单克隆鼠抗人抗c-kit(CD117)抗体, 经流式细胞仪分选。将分选的c-kit+细胞接种至培养皿, 以原方法继续培养并传代。
1.3 羊水细胞生长曲线
分别取第5, 10代c-kit+及c-kit-羊水细胞, 消化并接种至96孔板。每孔加入100ul, 约3000个细胞,并设无细胞的对照孔。 5% CO2, 37℃孵育过夜, 至细胞单层铺满孔。每孔加入20µl MTT溶液继续培养3~4h。在酶联免疫检测仪[enzyme micro-plate reader(Bio-Rad)]490nm处测量各孔的吸光值(A490nm)。每天取3个孔检测, 计算平均值, 连续观察8d, 绘制生长曲线。
1.4 流式细胞仪分析
取扩增第5~7代的c-kit+及c-kit-羊水细胞进行细胞表型鉴定。细胞用0.125%胰蛋白酶消化, 血清终止消化后用磷酸盐缓冲液(phosphate buffer saline,PBS; Sigma-Aldrich)洗涤、重悬, 调整细胞浓度为5×105/ml 单细胞悬液, 每管1ml, 共取8管, 分别加入鼠抗人单克隆抗体PE-CD29、PE-CD44、PE-CD73、PE-CD90、PE-CD105、PE-CD45、PECD34、PE-HLA- DR、PE-HLA-ABC, 兔抗人单克隆抗体抗 PE-Oct-4(BD公司)各20µl充分混匀, 避光室温孵育30 min, PBS洗2遍(1500r/min, 离心5 min),重新制成细胞悬液0.5 ml, 流式细胞仪(Cytomics FC 500 MPL BECKMAN COWLER)检测。数据表达为细胞数量/106细胞计数单位。
1.5 免疫细胞化学分析
取第5~7代c-kit+及c-kit-羊水细胞进行细胞免疫化学染色。4%多聚甲醛室温固定细胞30 min, 分别滴加 1:100鼠抗人单克隆抗体(抗 Oct-4、抗SSEA-4、抗 CD29、抗 CD34、抗 CD44、抗 CD45、抗CD73、抗CD90、抗CD105; BD公司), 同时滴加PBS组为阴性对照, 4℃过夜, 滴加FITC-羊抗鼠第二抗体IgG(Invitrogen), 室温下孵育20 min, 镜下观察结果。阴性对照不加一抗。共聚焦显微镜(Olympus fluoview fv1000)留取影像资料。
1.6 成脂、成骨细胞诱导分化
通过成脂及成骨细胞分化来评估c-kit+及 c-kit-羊水细胞的间充质分化能力。细胞以3000/cm2的密度接种在培养皿, 以 DMEM 低糖培养基+15%FBS+1%青链霉素(Gibco), 成脂细胞诱导液(1µmol/L 地塞米松, 1 µmol/L 3-异丁基-1-甲基黄嘌呤,10 g/mL 胰岛素, 60 µmol/L 吲哚美辛; Sigma)诱导21d, 油红 O染色观察脂滴形成, 通过 RT-PCR仪(BIO RADC1000)检测脂连素基因的表达。以DMEM低糖培养基+10% FBS+1%青链霉素(Gibco),成骨细胞诱导液(100 nmol/L 地塞米松, 10 mmol/L β-甘油磷酸盐, 0.05 mmol/L 抗坏血酸2-磷酸盐)诱导21d, Von Kossa染色后观察深棕褐色钙沉积颗粒。并通过RT-PCR检测骨桥蛋白的基因表达。RT-PCR引物及产物大小见表1。

表1 RT-PC引物及产物大小Table 1 The primers for RT-PCR and the product size
1.7 心肌样细胞诱导分化
将第5代c-kit+与c-kit-羊水细胞分别与新生乳鼠心肌共培养, 使用 transwell板, 可以允许培养基相同, 却阻止两种细胞相互接触。羊水细胞与乳鼠心肌细胞混合比例为1:10。培养皿细胞以3000个/cm2密度接种。用 DMEM 低糖培养基+10%马血清(Gibico)+ 0.5%鸡胚提取物(Gibico)+1%青链霉素的培养液培养 10d。提取总 RNA, 通过 RT-PCR检测诱导后心肌细胞特异标志基因GATA4、α-actin、Cx43和cTnT的mRNA表达。引物序列见表1。未诱导的细胞设为对照。进一步进行 Western blot分析。一抗使用羊抗人抗体(抗-GATA-4, 抗-cTnT, 抗-α-actin和抗-Cx43), 二抗为兔抗羊抗体(Zymed Laboratories, Inc. South San Francisco, CA), 蛋白电泳, 转移装置(BIO-RAD)。
1.8 统计学处理
使用SPSS10.0统计软件进行统计学处理(SPSS Inc. Chicago, IL, USA)。计量资料以均值±标准差表示。
2 结 果
2.1 诱导前羊水细胞形态、生长曲线
共14份羊水标本(孕15~31周)用于分析。新获得的羊水细胞在培养瓶中呈悬浮状态。细胞形态为多样性, 不规则形。培养3~7d后, 出现贴壁细胞,原代细胞成岛状或成簇生长, 细胞为长纺锤形或上皮样形态。经过c-kit分选, c-kit+羊水细胞为均匀一致的成纤维状(图1A)。共有5份羊水分选到c-kit+细胞, 来源于16~22周羊水。C-kit+细胞数量约占贴壁细胞的(3.30±1.24)%。成纤维细胞在体外可以传代至50代以上。来源于孕15周羊水的细胞(样本A), 由于细胞数量极少, 未能传代。有3份标本来自孕中期较晚阶段(样本M,S,T)主要表现为上皮样细胞, 在体外传代不超过5代(图2)。MTT法检测细胞增殖, 可以看到第5, 10代c-kit+及c-kit-羊水细胞具有相似的生长曲线(图1 B)。
2.2 流式细胞仪及免疫细胞化学分析
流式细胞仪及免疫细胞化学分析显示, c-kit+羊水细胞表达间充质干细胞表面标记CD29, CD44,CD73, CD90, CD105; 不表达造血细胞系标记CD34,CD45; 表达HLA-ABC(I型主要组织相容性抗原,MHC-I); 不表达HLA-DR(Ⅱ型主要组织相容性抗原, MHC-Ⅱ); 部分表达Oct-4和SSEA-4。C-kit-羊水细胞也表达如上述间充质干细胞标记; 不表达造血细胞系标记; 表达MHC-I(HLA-ABC); 不表达MHC-Ⅱ(HLA-DR); 不表达Oct-4和SSEA-4(图3,图4)。
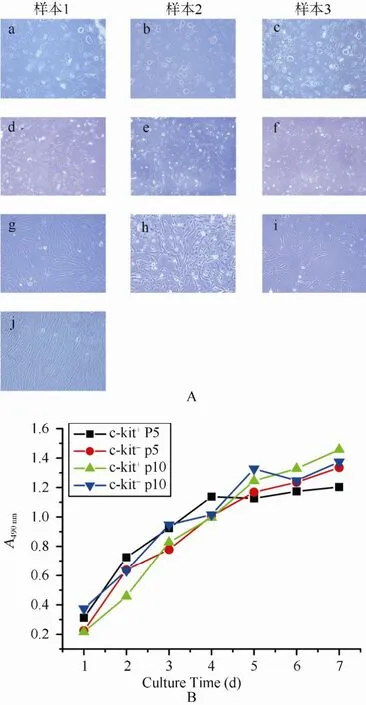
图1 c-kit+和c-kit-羊水干细胞的形态及生长曲线Figure 1 Morphological characteristics and growth curves of amniotic fluid-derived c-kit+ and c-kit- stem cells
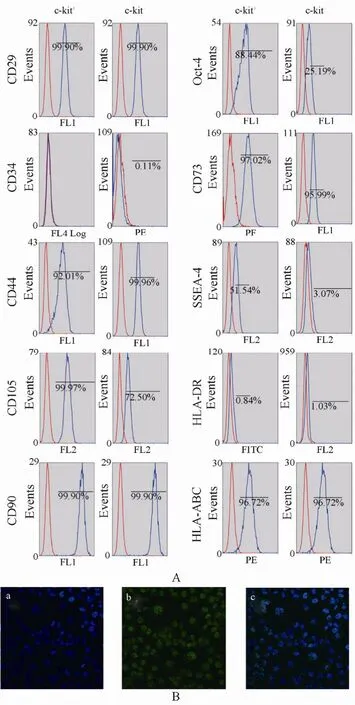
图2 流式细胞仪分析及Oct-4的免疫细胞化学分析Figure 2 Flow cytometry analyseis and immunocytochemical staining of Oct-4 positive cells
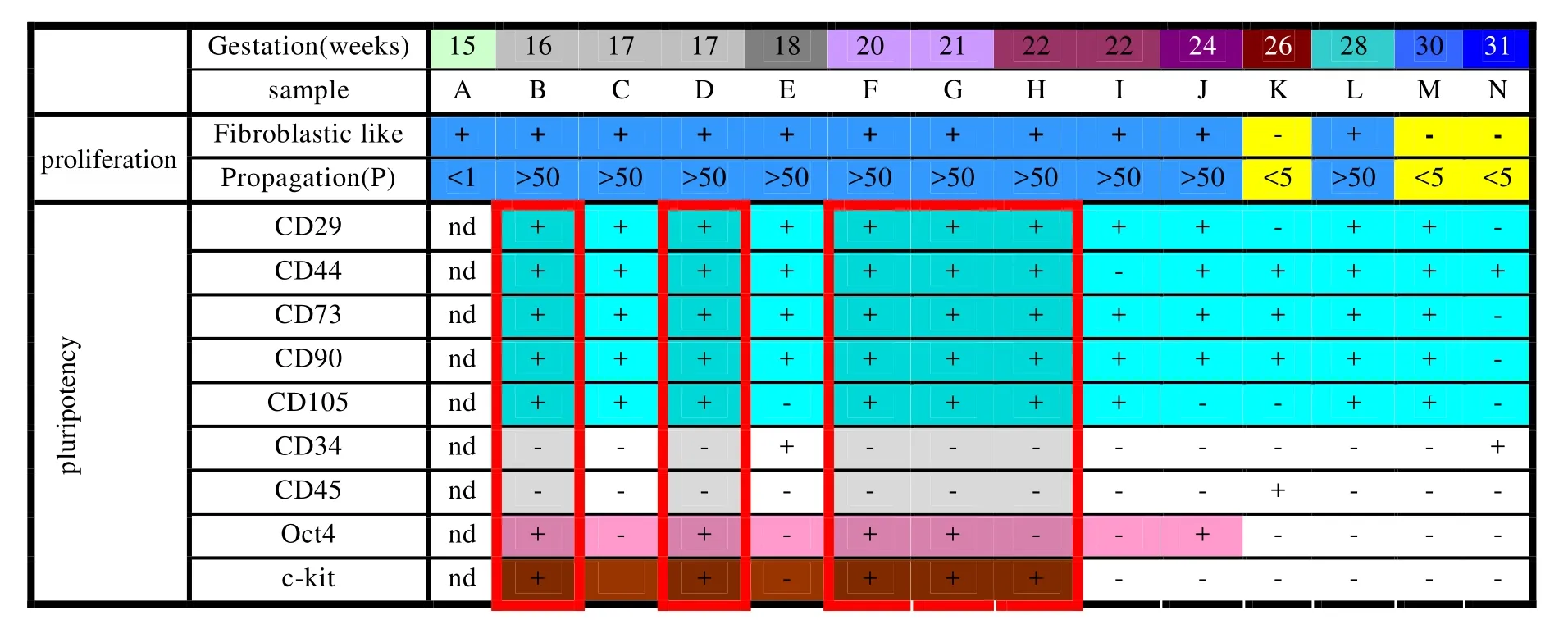
图3 羊水细胞的形态、增殖及表型鉴定Figure 3 Morphology, proliferation, flow cytometry for stem cells markers in human amniotic fluid-derived cells
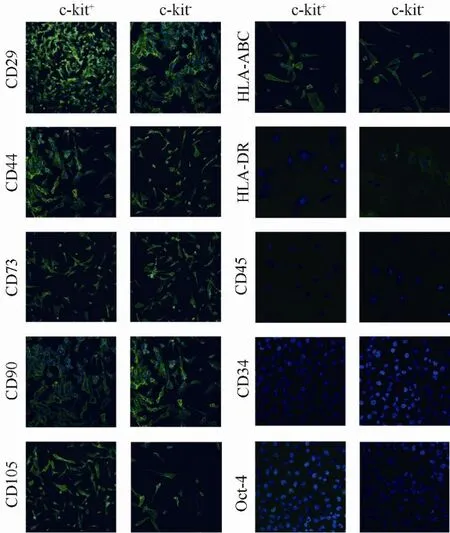
图4 免疫细胞化学分析Figure 4 Immunocytochemical analysis (×200)
2.3 成骨细胞诱导分化
成骨细胞诱导后可见深褐色钙沉积颗粒,RT-PCR分析显示表达骨桥蛋白mRNA。成脂细胞诱导后, 在细胞内可以观察到脂滴形成, RT-PCR分析显示表达脂连素mRNA(图5)。
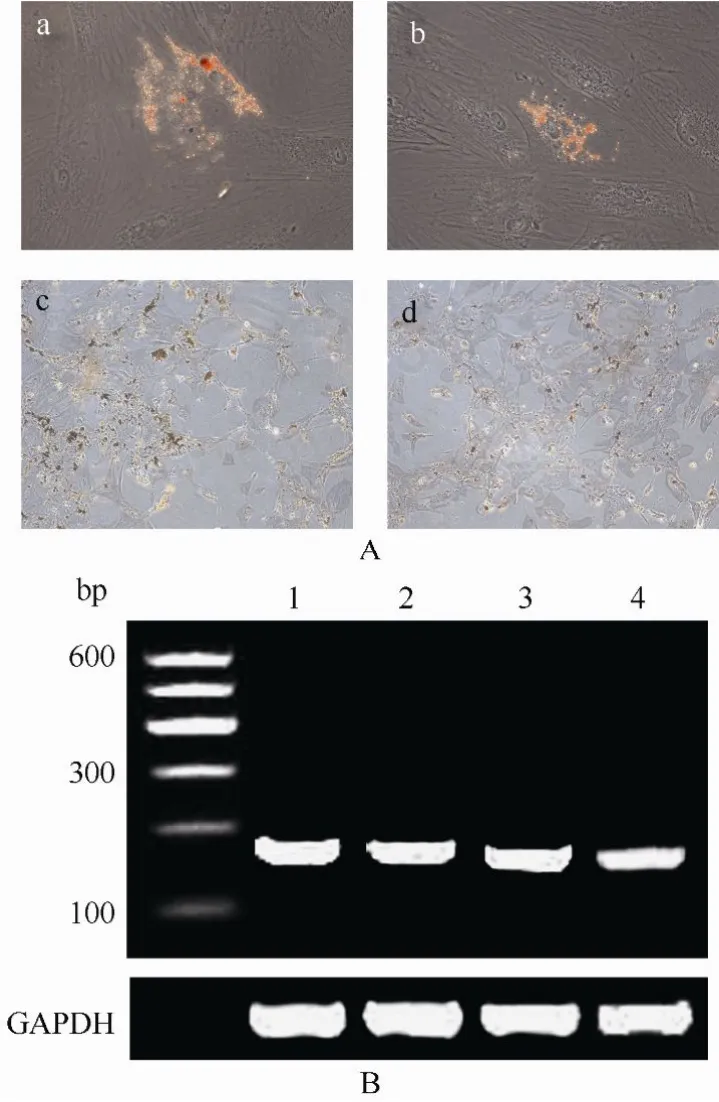
图5 c-kit+和c-kit-羊水干细胞的成脂和成骨分化Figure 5 Adipogenic and osteogenic differentiation of c-kit+(a, c) and c-kit-(b, d) AFS cells (×200)
2.4 心肌样细胞诱导分化
通过与乳鼠心肌细胞共培养的方式诱导羊水c-kit+及c-kit-干细胞向心肌样细胞分化。RT-PCR 和Western blot 分析显示: 心肌细胞相关基因和蛋白(GATA-4, cTnT, α-actin, Cx43)表达阳性。然而,c-kit-羊水干细胞经诱导后仅检测到GATA-4的基因及蛋白阳性(图6)。
3 讨 论
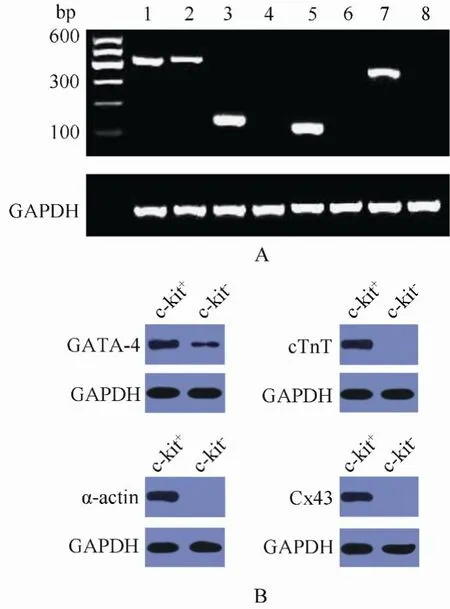
图6 心肌相关基因的RT-PCR和Western blot分析Figure 6 RT-PCR and Western blot analysis of myocardiumrelated genes
羊膜腔穿刺术通常在孕中期完成, 因为此期的羊水中蕴含大量胎儿脱落的细胞, 可以用于产前诊断。当细胞数量超过5000个/ml时, 就要考虑可能存在胎儿畸形。本研究中, 获得的羊水从孕15~31周,羊水细胞的数量平均100~2500个/ml。原代培养的羊水细胞, 贴壁后表现为成纤维样或成上皮样。细胞平均贴壁时间为(5.12±1.87)d。传代3~4代后,大部分细胞为成纤维状, 上皮样细胞逐渐减少。成纤维状细胞可以在体外传代至50代以上。本研究中发现, 3份标本细胞形态均以上皮样为主, 在体外传代不超过5代, 提示这种细胞并非干细胞。这3份标本分别来自孕26, 30及32周, 提示随着孕周增加,成体细胞的比例可能更高。我们发现, 16~24周的羊水较易培养出成纤维样细胞。既往研究认为这种成纤维状的贴壁生长的细胞为间充质干细胞。然而,羊水中的细胞成分复杂, 蕴含多种来源的干细胞或祖细胞, 如果用于临床, 需要筛选出一组纯化的细胞群。通过细胞表面抗原分选是一种简单、高效的分选方法。C-kit是一种受体蛋白, 通常在胚胎干细胞及原始胚层细胞中表达[4]。C-kit+细胞是新近发现的羊水中的间充质干细胞亚型, 目前并不明确它的确切来源及在胎儿发育中的作用。一些研究已经显示了c-kit+羊水细胞的临床应用潜力[5]。Arnhold等[6]的研究发现, 羊水细胞的组成在孕期中存在明显的“时限性”, c-kit+细胞在孕17~18周增加, 孕19周后消失。我们通过流式细胞仪分选c-kit+细胞, 发现c-kit+细胞分布在孕16~22周。这种偏差可能由于样本误差。在体外培养, 我们发现第5代及第10代的c-kit+及c-kit-羊水干细胞具有相似的生长曲线。c-kit+羊水干细胞占羊水贴壁细胞的(3.30±1.24)%, 与文献报道的1%~5%相似[2,6], 提示c-kit+细胞在羊水中可能有相对恒定的比例。我们对c-kit+及c-kit-羊水干细胞进行流式细胞仪及免疫细胞化学染色分析。发现c-kit+细胞强表达间充质干细胞标记CD29,CD44, CD73, CD90, CD105), 不表达造血细胞系标记(CD34, CD45)。表达MHCI, 不表达MHCII。发现c-kit-羊水干细胞也具有间充质干细胞特征, 如表达上述间充质干细胞标记, 不表达造血细胞系标记。但 Oct-4在c-kit+细胞中占较高的比例(88.44%),在 c-kit-细胞中占较低的比例(25.19%)。 SSEA-4在c-kit+细胞中占51.54%,在 c-kit-细胞中占3.07%。Oct-4 通常存在于胚胎干细胞及原始胚层细胞中[7],SSEA-4与细胞的未分化状态相关[8], 通常在干细胞中表达, 在分化细胞中不表达。C-kit+羊水干细胞除了具备间充质干细胞特征外, 还表达Oct-4及SSEA-4, 提示c-kit+羊水干细胞可能处于成体干细胞及胚胎干细胞的中间阶段, 可能比成体干细胞具有更强的分化能力。在对c-kit+及c-kit-羊水干细胞间充质分化能力比较时发现, 两种细胞都可以向成骨、成脂细胞系分化, 并且检测到骨桥蛋白及脂连素等相关基因的表达, 然而在心肌样细胞分化能力上却出现了差异。通过与新生乳鼠心肌细胞共培养的方式[9], 诱导后c-kit+羊水干细胞在基因及蛋白水平上均可以检测到GATA-4, cTnT, α-actin和Cx43 mRNA 的表达。GATA-4 是一种转录因子, 在心肌细胞的早期发育中发挥重要作用。cTnT是胚胎中骨骼肌细胞或肌原纤维中肌钙蛋白复合物的成分, 临床上通常被用于心肌损伤后的检测标志[10]。肌动蛋白是细胞骨架的主要成分。α-actin是肌动蛋白家族中的亚型[11]。缝隙连接在胚胎发育、电偶联、代谢运输、凋亡、分化、组织稳态以及癌的发生中都起到关键作用[12]。Cx43 就是一种缝隙连接蛋白, 主要存在于心房和心室肌细胞中。本研究中, 经过诱导的c-kit+羊水干细胞具有以上心肌细胞中的4种相关基因的表达, 提示c-kit+具有心肌样细胞的分化能力。诱导后c-kit-羊水干细胞只检测到GATA-4的基因及蛋白的表达, 提示诱导后的c-kit+细胞更接近成熟的心肌细胞。
我们的研究提示, 通过流式细胞仪分选, 从孕16~22周羊水中可以高效分离纯化的c-kit+间充质干细胞。虽然c-kit+及c-kit-羊水干细胞具有相似的生物学特征, 但c-kit+羊水干细胞的心肌样细胞分化能力更强, 可能与c-kit+干细胞具有某种胚胎干细胞特征有关。
致谢感谢解放军总医院肿瘤中心实验室郭亚军教授的指导及侯盛教授对本文的技术支持。
[1]Lloyd-Jones D, Adam S RJ, Brown TM,et al. Executive summary: heart disease and stroke statistics-1010 update:a report from the American heart association[J]. Circulation,2001, 121(7): 948-954.
[2]De Coppi P, BartschG Ir, Siddiqui MM,et a1.Isolation of amniotic stem cell lines with potential for therapy[J]. Nat Biotechnol, 2007, 25(1): 100-106.
[3]Da Sacco S, Sedrakyan S, Boldrin F,et al. Human amniotic fluid as a potential new source of organ specific precursor cells for future regenerative medicine applications[J]. J Urol,2010, 183(3): 1193-1200.
[4]Fleischman RA. From white spots to stem cells: the role of the Kit receptor in mammalian development[J]. Trends Genet,1993, 9(8): 285-290.
[5]Perin L, Sedrakyan S, Giuliani S,et al. Protective effect of human amniotic fluid stem cells in an immunodeficient mouse model of acute tubular necrosis[J]. 2010, PLoS One,2010, 5(2): e9357.
[6]Arnhold S, Glüer S, Hartmann K,et al. Amniotic-fluid stem cells: growth dynamics and differentiation potential after CD-117-based selection procedure[J]. Stem Cells Int,2011,doi:10.4061/2011/715341.
[7]Prusa AR, Marton E, Rosner M,et al. Oct-4-expressing cells in human amniotic fluid: a new source for stem cell research[J]? Hum Reprod, 2003, 18(7): 1489-1493.
[8]Kannagi R, Cochran NA, Ishiqami F,et al. Stage-specific embryonic antigens (SSEA3 and -4) are epitopes of a unique globo-series ganglioside isolated from human teratocarcinoma cells[J]. EMBO J, 1983, 2(12): 2355-2361.
[9]Yeh YC, Wei HJ, Lee WY,et al. Cellular cardiomyoplasty with human amniotic fluid stem cells:in vitroandin vivostudies[J]. Tissue Eng, 2010, 16(6): 1925-1936.
[10]Parker BA, Mark AB, Zhang WJ,et al. Precocious expression of cardiac troponin T in early chick embryos is independent of bone morphogenetic protein signaling[J].Dev Dyn, 2002, 225(2): 135-141.
[11]Oma Y, Harata M. Actin-related proteins localized in the nucleus from discovery to novel roles in nuclear organization[J]. Nucleus, 2011, 2(1): 38-46.
[12]Laird DW. The gap junction proteome and its relationship to disease[J]. Trends Cell Bio, 2010, 20(2): 92-101.

