Humanin对实验性阿尔茨海默病小鼠海马小胶质细胞 OX-42表达的影响
张新宇, 尹 榕, 付学锋*, 赵 波, 万东君
(兰州军区总医院: 1干部病房, 2神经内科, 兰州 730050;3兰州军区总医院473临床部神经内科,兰州 730070)
随着老龄化社会的到来, 阿尔茨海默病(Alzheimer′s disease, AD)越来越得到人们的重视。Humanin(HN)是新近发现的一种多肽, 它能抑制淀粉样前体蛋白(amyloid precursor protein, APP)、早老素 1(presenilin-1, PS1)、早老素 2(presenilin-2,PS2)突变和β淀粉样蛋白(amyloid β-protein, Aβ)等诱导的神经细胞死亡, 其在体外的抗细胞凋亡和神经保护作用已经被众多研究者证实[1]。我们早期试验已经证实HN和HN肽链第14位氨基酸被Gly取代的突变体[Gly14]-Humanin(HNG)在体内可有效地抑制 Aβ导致的胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)的表达, 本研究通过检测HN对Aβ诱导的OX-42阳性细胞表达变化的影响, 旨在探讨 HN在体内对于小胶质细胞是否同样存在神经保护作用。
1 材料与方法
1.1 实验动物与分组
健康成年雄性昆明小鼠 60只, 2月龄, 体质量25~30 g, 由兰州军区总医院实验动物中心提供, 清洁级。随机分为假手术组(n=15)、Aβ模型组(n=15)和HN治疗组(n=30)。
1.2 试剂
HN、Aβ25~35、羊抗兔OX-42单克隆抗体、链酶亲和素-生物素-过氧化物酶复合物(streptavidin biotin-peroxidase complex, SABC)为美国Sigma公司产品; 其他试剂均为市售分析纯。
1.3 AD模型建立
参照Tihda等[2]的方法, 腹腔注射1%戊巴比妥溶液50 mg/kg, 麻醉小鼠, 固定于立体定向仪, 按照小鼠脑立体定位图谱定位于右侧海马CA1区。应用微量注射器注入Aβ25~351 µl(注射时间10 min, 留针10 min)。HN治疗组在注射Aβ后立即在同一部位缓慢注入 100 µmol/L HN 溶液 1 µl(注射时间 10 min, 留针10 min)。假手术组仅在相同部位入针, 操作同其他两组。动物放置于安静、温暖、避强光的环境中饲养。
1.4 OX-42免疫组织化学染色
注射后分别于第3, 7, 14 d处死小鼠。鼠脑连续切片, 切片厚度 30 µm, 隔 4张取 1张。先后加入OX-42一抗(1:200)、二抗(1:500)、SABC(1:500),采用硫酸镍氨加强法DAB显色, 操作按照说明书。阴性对照组采用同样浓度的普通兔免疫球蛋白(IgG)代替一抗, 其他步骤相同。
1.5 尼式染色
冷冻切片经二甲苯、无水乙醇、95%乙醇、80%乙醇、70%乙醇下行入水, 后用1%焦油紫染色30 min。蒸馏水清洗, 70%乙醇分色数秒至数分钟, 经70%乙醇、80%乙醇、95%乙醇各 2 min脱水, 无水乙醇脱水5 min, 二甲苯透明后树胶封固。
1.6 图像分析处理
采用Image pro plus 5.0软件对组织切片进行定量分析。每只大鼠取4张切片, 200倍视野下, 于每张切片血肿周边随机选取 4个视野, 测出单位面积的OX-42阳性细胞数。
1.7 统计学处理
应用SPSS13.0统计分析软件进行分析, 数据采用±s表示, 方差分析进行多组均数检验, 并用LSD-t检验进行多重比较。P<0.05为差异有统计学意义。
2 结 果
2.1 免疫组织化学方法检测3组小鼠海马区小胶质细胞OX-42蛋白的改变
Aβ组小鼠经Aβ刺激后3d, 小胶质细胞被激活,转化为活化状态, 以注射点为中心, 注射侧海马OX-42阳性细胞明显深染、体积增大、数量增多, 并达到峰值; 细胞形态清楚, 胞体肥大、肿胀, 突起增粗延长; 注射对侧海马也出现活化 OX-42, 细胞增多、体积增大, 但较注射侧弱; 随时间延长, 7, 14d观察可见 OX-42仍深染, 细胞数逐渐减少, 但仍多于假手术组, 胞体仍有肥大、突起增粗延长。而HN治疗组在各时间段小胶质细胞体积均明显小于模型组, 且突起减少; 阳性细胞数目多于假手术组, 但少于模型组(P<0.05; 图1, 表1)。
2.2 尼式染色检测3组小鼠海马区病理改变
Aβ模型组、HN治疗组在手术后各时间点Nissl染色可见皮质有针刺道, 部分有皮质缺损, 边缘不整; Aβ模型组注射侧海马变形, 有明显炎性细胞浸润、肿胀以及胶质细胞增生, CA1~CA3区锥体细胞消失或排列稀疏、紊乱, 其中炎性的病理变化在注射点最重, 其周围逐渐减轻, 随着时间的推移, 上述病理变化减弱; HN治疗组在相同时间点炎性的病理变化弱于Aβ模型组。
3 讨 论
老年斑是 AD的主要病理特征之一。在以 Aβ为核心的老年斑周围聚集着大量活化的小胶质细胞和星形胶质细胞, 同时在神经纤维缠结、损伤的毛细血管周围亦发现有大量的胶质细胞存在, 但其密度最高的部位是在炎性老年斑内及其周围。在AD疾病的早期, 小胶质细胞可吞噬外源性Aβ纤维, 吞噬Aβ后的小胶质细胞被激活, 激活的小胶质细胞在Aβ和神经炎性斑块等病理损害的细胞应答中具有重要作用。研究表明, 星形胶质细胞活化后, 产生的炎性因子能够促进Aβ聚集, 并进一步激活小胶质细胞, 从而形成恶性循环, 加重老年斑周围的炎性反应[3]。越来越多的研究证据表明, 炎性反应在AD形成和发展过程中具有重要作用, 但迄今仍缺乏有效的防治措施[4]。
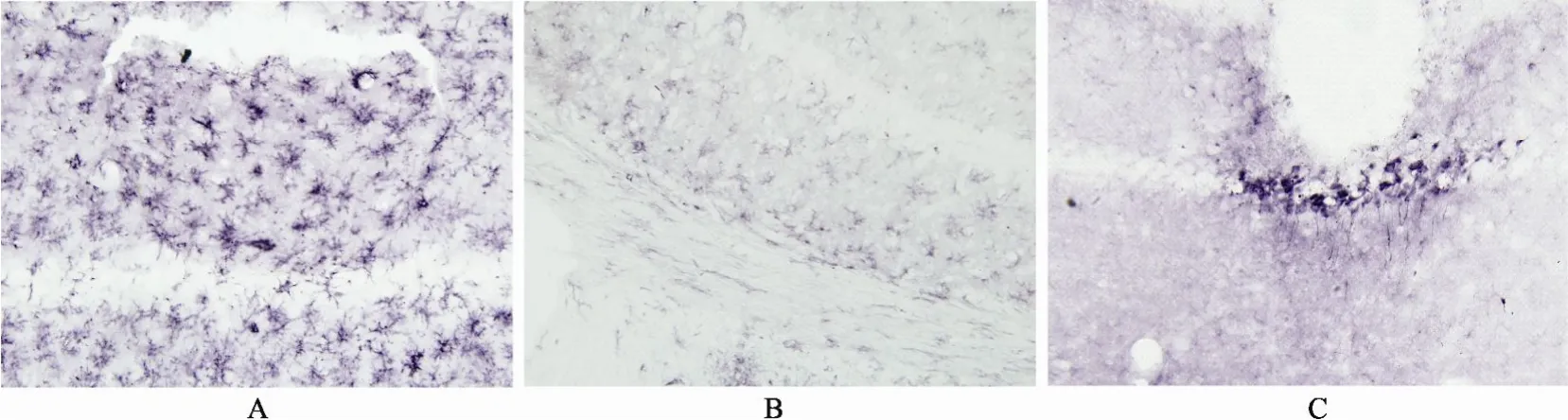
图1 Aβ刺激后3d海马OX-42阳性细胞Figure 1 Expression of OX-42 in hippocampal region on day 3 (SABC ×200)
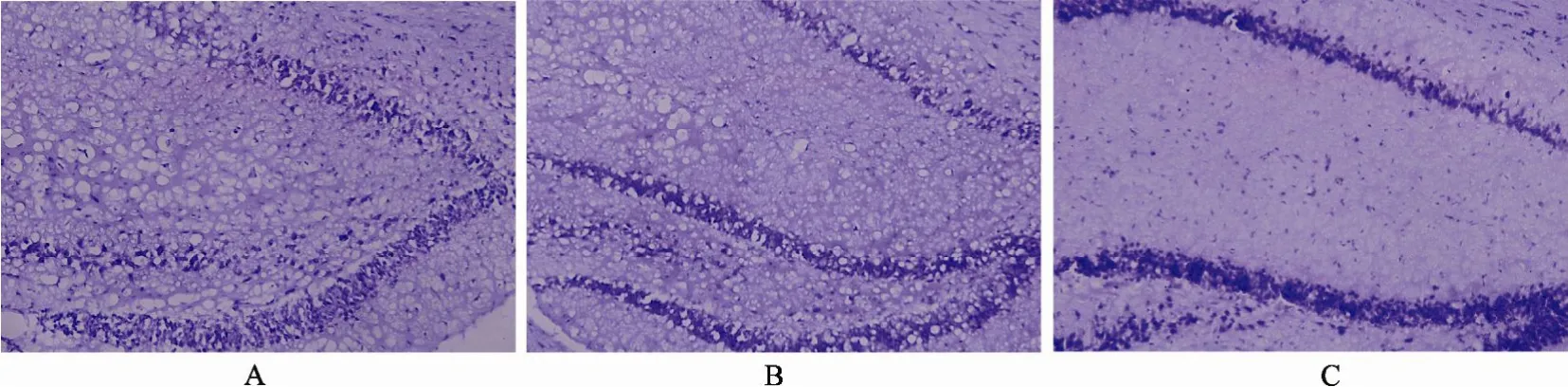
图2 海马区病理改变Figure 2 Pathological changes of hippocampus on day 3 (Nissl staining ×200)
表1 3组小鼠海马阳性OX-42细胞数的变化Table 1 Numbers of OX-42 positive cells in hippocampal region (n=15,±s)
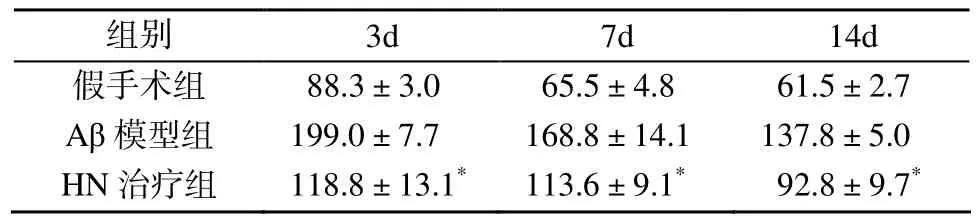
表1 3组小鼠海马阳性OX-42细胞数的变化Table 1 Numbers of OX-42 positive cells in hippocampal region (n=15,±s)
注: 与Aβ模型组比较, *P<0.05
组别 3d 7d 14d假手术组 88.3±3.0 65.5±4.8 61.5±2.7 Aβ模型组 199.0±7.7 168.8±14.1 137.8±5.0 HN治疗组 118.8±13.1* 113.6±9.1* 92.8±9.7*
HN是近年来发现的一种新的内源性神经保护因子, 由24个氨基酸残基组成, 相对分子质量为2656.3。HN是目前发现的一种既可以抑制多种黄素腺嘌呤二核苷酸(flavin adenine dinucleotide, FAD)引起的细胞毒性, 又可抑制Aβ神经毒性的神经保护因子[5]。体外研究证明, HN能够抑制所有的由FAD突变体引起的神经细胞死亡[6]; HN还能阻断由Aβ和抗APP抗体在初级神经元中引起的细胞毒性[7]; 众多的体外研究表明, HN在微克水平即可表现出神经保护作用[8]; Miao等[9]的实验证实, HNG可以有效地改善实验性AD小鼠神经行为缺陷。我们先期的实验发现, HN及HNG在体内均可有效地抑制Aβ毒性导致的GFAP表达, 这种改变有时间依赖特征, 与剂量及浓度显著相关, 且HNG的生物活性作用较HN组更强[10]。
本研究通过观察HN对AD模型小鼠海马区小胶质细胞表达的影响作用, 发现应用HN治疗后, 海马区Aβ注射中心的组织坏死区域范围明显缩小,OX-42的表达显著减少。
总之, 本研究表明, HN在体内可有效地抑制Aβ毒性导致的OX-42表达, 说明HN可以有效治疗Aβ诱导的AD大鼠模型, 具有神经保护作用。HN是否通过抗炎性反应途径而发挥抗AD的神经保护作用,仍需要进一步检测其对炎性细胞介质表达的影响加以证明。
[1]Chiba T, Nishimoto I, Aiso S,et al. Neuroprotection against neurodegenerative diseases: development of a novel hybrid neuroprotective peptide Colivelin[J]. Mol Neurobiol, 2007,35(1): 55-84.
[2]Tihda C, Tamura T, Komatsu K. Repair of amyloid beta(25-35)-induced memory impairment and synaptic loss by a Kampo formula, Zokumei-to[J]. Brain Res, 2003,990(1-2): 141-147.
[3]Li DB, Tang J, Fan XT,et al. Comparative study of histopathology changes between the PS1/APP double transgenic mouse model and Abeta1-40 -injected rat model of Alzheimer's disease[J]. Neurosci Bull, 2006, 22(1): 52-57.
[4]Tuppo EE, Arias HR. The role of inflammation in Alzheimer's disease[J]. Int J Biochem Cell Biol, 2005, 37(2):289-305.
[5]Arakawa T, Niikura T, Kita Y. The biological activity of Humanin analogs correlates with structure stabilities in solution[J]. Int J Biol Macromol, 2011, 49(1): 93-97.
[6]Arakawa T, Kita Y, Niikura T. A rescue factor for Alzheimer's diseases: discovery, activity, structure, and mechanism[J].Curr Med Chem, 2008, 15(21): 2086-2098.
[7]胥显民, 王廷杰, 陈显久, 等. [Gly14]-Humanin多肽对 β淀粉样蛋白引起的神经干细胞毒性的拮抗作用研究[J].中国病理生理杂志, 2006, 22(8): 1623-1627.
[8]Rossini L, Hashimoto Y, Suzuki H,et al. VSTM2L is a novel secreted antagonist of the neuroprotective peptide Humanin[J]. FASEB J, 2011, 25(6): 1983-2000.
[9]Miao J, Zhang W, Yin R,et al. S14G-Humanin ameliorates Abeta25-35-induced behavioral deficits by reducing neuroinflammatory responses and apoptosis in mice[J].Neuropeptides, 2008, 42(5-6): 557-567.
[10]尹 榕, 李柱一, 苗建亭, 等. HN和HNG对AD小鼠海马星形胶质细胞激活影响的实验研究[J]. 中华老年心脑血管病杂志, 2009, 11(6): 457-460.

