自体MSCs/Chondro-Gide®工程化软骨再生修复技术的大动物实验
左镇华,米彦军,方礼明,林 娜,张 军,郑继元,杨 柳
关节软骨损伤及其修复,长期以来是困扰骨科基础研究与临床治疗的棘手问题。随着高能高速创伤的不断增多及人口老龄化进程,导致和加速关节软骨损伤和退变的疾患将显著增加。目前临床治疗关节软骨缺损的方法均存在缺陷。因此,开发一种新型软骨再生修复技术具有十分重要的意义。本实验在AMIC技术的基础上,结合干细胞移植技术[1],通过关节镜或小切口微创方式进行关节软骨缺损的修复,具有操作简单,创伤小等特点,避免了软骨细胞取材对供区的损伤,减省了体外软骨构建过程,借助关节腔的生物及力学环境更有利于骨髓间充质干细胞的自我诱导,实现损伤部位软骨修复,从而为软骨损伤修复的临床前实验提供大动物实验依据。
1 材料与方法
1.1 主要材料和仪器 Stryker关节镜系统、JVC视频监视系统、Stryker电动削刨系统、带刻度的关节镜探针、microfracture手锥、电动磨钻,骨髓穿刺包,DMEM培养液:含有L-谷氨酰胺300 μg/ml,维生素C 50 300 μg/ml,青霉素及链霉素各100 μg/ml的无血清DMEM(美国Gibco)培养液,Chondro-Gide®Ⅰ/Ⅲ型胶原双层薄膜支架(瑞士盖氏公司),Percoll分离液,优质胎牛血清(美国Hycline Logan),磷酸盐缓冲液(PBS),医用生物蛋白胶(广州倍绣生物技术有限公司),SHEL-LAB2300型二氧化碳培养箱(美国Sheldo),IX70-CK2型生物倒置显微镜(日本Olympus)等。
1.2 实验动物 中国青山羊12只,12月龄,体重14.5~15.5 kg,雌雄不限,雄性未去势(第三军医大学实验动物中心提供)。
1.3 实验方法
1.3.1 建立山羊关节软骨缺损模型
1.3.1.1 制造4 cm2缺损区域微骨折最大数并计算干细胞移植的细胞量 在处死山羊的股骨滑车上制造软骨缺损4 cm2,用关节镜微骨折手锥(孔径2.5~2.8 mm,深度3~4 mm,孔间间隔为2~3 mm)最大限度制造微骨折;测量微骨折手锥的尖端直径及长度,测量制造的微骨折孔径的直径。
1.3.1.2 参照以下几个标准化数值 (1)临床上注射的细胞悬液的浓度3 ×107/ml[2];(2)4 ml成人骨髓含3.2×107~6.0×107个单个核细胞,培养3周收获hMSCs 2.5×107~4.3×107,4 ml成人骨髓培养3周所需血清30 ml[3];(3)200 ml全血可提取血清120 ml(北京积水潭医院检验科提供数值)。
1.3.2 自体MSCs/Chondro-Gide®工程化软骨修复技术具体步骤 (1)实验分组:12只成年中国青山羊,将山羊按序编为1~12号,隔离后验血,排除脑膜炎后随机分为实验组、AMIC治疗组及空白对照组,每组4只8膝。(2)采集山羊血液,培养自体血清通过山羊颈静脉采集120 ml全血,制备自体血清。(3)骨髓的采集:肌注氯胺酮(10~20 mg/kg)后进行称重。采用戊巴比妥钠(20~30 mg/kg)静脉复合麻醉,成功后以10%Na2S溶液褪去山羊膝关节手术区域毛发,以碘伏常规术区消毒、铺巾,肝素化的无菌骨穿针以45°倾斜于股骨近端沿其长轴的方向,进入骨髓腔后抽取骨髓3~5 ml,置于肝素化的无菌离心管中。(4)骨髓间充质干细胞的自体血清体外培养。(5)制备山羊膝关节股骨滑车关节面缺损模型以10%Na2S溶液褪去山羊膝关节手术区域毛发,以碘伏常规术区消毒、铺巾,制作膝关节滑车部位4 cm2软骨缺损模型。
1.3.3 动物实验操作 制备骨髓间充质干细胞悬液待用。实验组:首先清理关节软骨缺损部位,修整周缘,用消毒后的铝箔填充缺损部位,修剪铝箔与软骨缺损形状及大小一样作为模具,将模具覆盖在Chondro-Gide®薄膜上,沿边缘修剪;在软骨缺损部位制造微骨折,注射纤维蛋白凝胶,将修整后的薄膜覆盖缺损部位,将细胞悬液均匀注射在薄膜下,髌骨复位后被动活动膝关节,检查薄膜固定牢固性;AMIC组:单纯微骨折加贴薄膜;空白对照组:注入无菌生理盐水1 ml。术后连续3 d肌肉注射青霉素,40万U/只,动物肢体不固定,正常饮食,动物自由活动。
1.4 观察指标
1.4.1 术后一般情况 动物饮食量、肢体活动、伤口愈合情况、有无全身或局部感染等。
1.4.2 关节镜后膝关节MRI检查 术后8周动物麻醉后行关节镜观察及膝关节MRI检查。
1.4.3 大体观察 处死动物,手术显露膝关节,肉眼观察关节有无粘连、有无关节内游离体,以及修复组织色泽、修复面积、修复厚度及与周围组织整合情况。
1.4.4 组织学观察 大体观察完成之后,截取修复的股骨远端,4%多聚甲醛固定48 h,0.5M的EDTA(由不含钙、镁的PBS配制,NaOH调整pH 7.8)脱钙3周、每周更换脱钙液2次,石蜡包埋切片,HE、TB染色。行组织形态和软骨细胞分泌氨基多糖定性观察。
1.4.5 修复效果评分 采用半定量改良的Wakitani评分法[4],观察修复组织细胞种类、基质染色、修复面积、软骨厚度及与正常组织的整合情况。
1.5 统计学处理 应用SPSS10.0统计分析软件ANOVA方差分析法,分析三组软骨修复Wakitani评分值,进行各组间均数(±s)的比较。P<0.05为差异有统计学意义。
2 结 果
2.1 计算数值的结果 4 cm2软骨缺损的微骨折孔数(Max):25个;4 cm2软骨缺损微骨折注入液体总量=25×13 μl=0.32 ml;4 cm2软骨缺损注入液体总量=1.6 ml;细胞总数=3×107/ml×0.32﹢1.6×3×107/ml=4.6×107/ml;所需要采集的骨髓总量=7.36 ml~4.28 ml;所需血清50~60 ml;需采集全血最大量83~100 ml。
2.2 一般情况 修复术后次日,动物活动量及饮食较前略减少,术后3 d大多数实验动物恢复正常饮食,术后7 d全部恢复正常活动;术后7 d切口愈合,缝线自动脱落。
2.3 术后8周关节镜下观察 实验组:关节腔滑膜无增生、充血,关节腔无积液,软骨缺损部位边界光滑,表面光滑无起层,弹性尚可。AMIC组:关节镜下可见关节腔少量积液,滑膜有增生,修复区色泽较正常软骨差别大,软骨表面光滑但低于正常软骨,弹性差。空白对照组:软骨缺损仍存在,缺损周缘有类似纤维肉芽组织增生(图1)。
2.4 术后8周大体观察 软骨修复术后时,大体观察:实验组:修复区表面平整,修复区域色泽较接近周围正常软骨,边界连续无分裂;AMIC组:修复区表面较为平整,色泽暗红与周围正常组织区别明显;空白对照组:仍可见明显缺损,缺损底部肉芽组织形成。
2.5 术后8周膝关节核磁共振影像学评价 (1)实验组:关节腔无积液,滑膜无增生,软骨表面光滑,无缺损;(2)AMIC组:软骨下骨有异常信号改变,软骨表面较为光滑,髌下脂肪垫增生;(3)空白对照组:软骨及软骨下骨缺损,T2像可见关节腔少量积液(图2)。
2.6 软骨修复术后8周时,组织学观察 (1)实验组:HE染色示修复区域与正常组织整合较好,有较多幼稚软骨细胞,修复组织表层下方,细胞体积较小,形态多长梭形,数量多,分布均匀,深层细胞体积较大,排列不规则,能见到伊红深染的少量支架;(2)AMIC组:可见修复区整合尚可,表层下方类似骨髓细胞聚集,细胞数量较少、体积小,排列不规则;(3)空白对照组:缺损区边缘可见软骨组织反应性增生,但不能充填缺损,缺损底部为增生的纤维组织,并有毛细血管长入(图3)。
2.7 修复效果 Wakitani评分结果实验组8周、16周评分值与空白对照组相应评分值比较差异有统计学意义(P<0.01);实验组8周、16周评分值与AMIC组相应时刻评分值比较差异有统计学意义(P<0.01);AMIC组8周评分值与空白对照组比较差异有统计学意义(P<0.01);AMIC组16周评分值与空白对照组相应时刻评分值比较无统计学差异(P>0.05),见表1。改良Wakitani评分结果显示:实验组和AMIC组修复效果均优于空白对照组,且实验组修复效果更优于AMIC组。
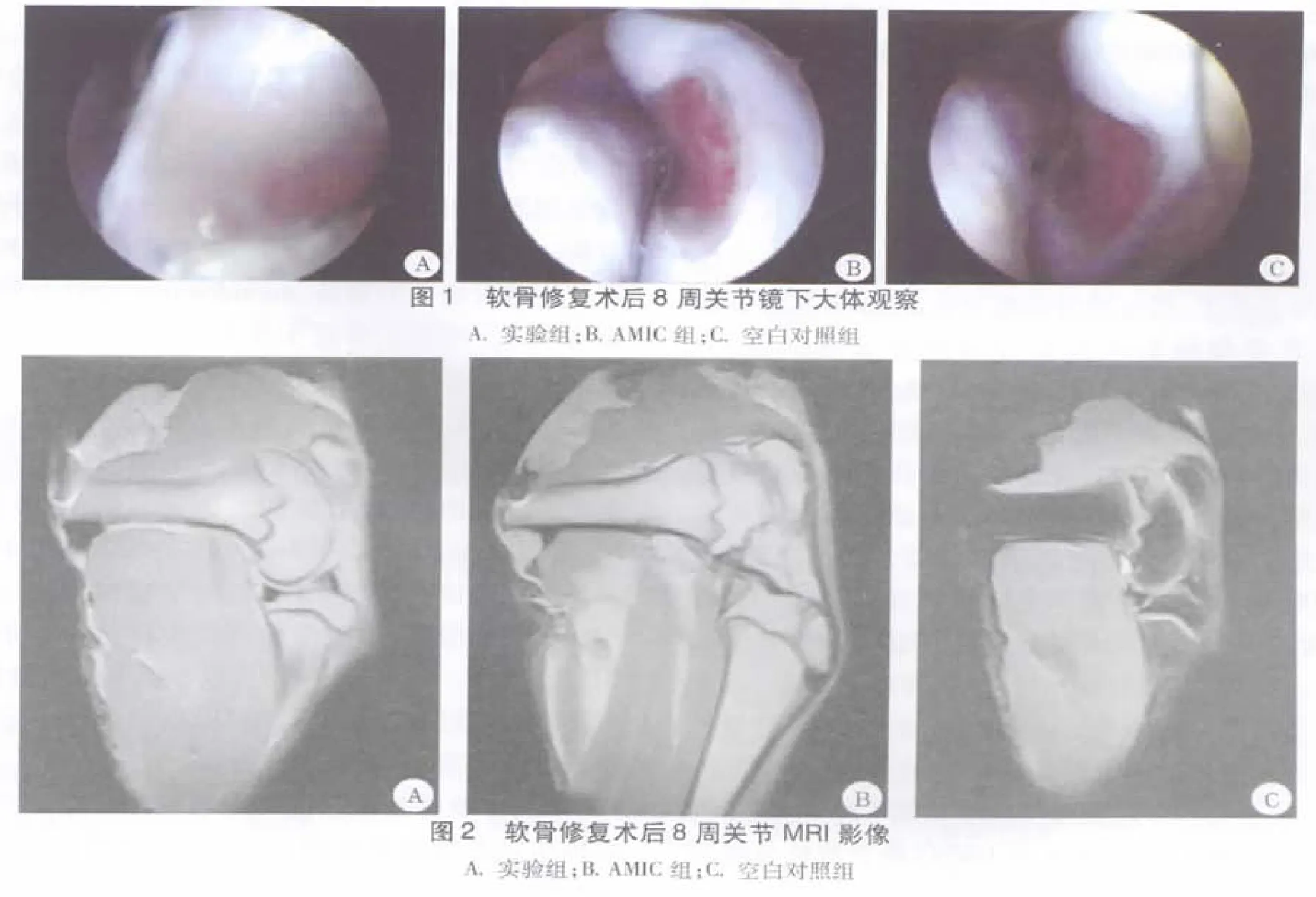
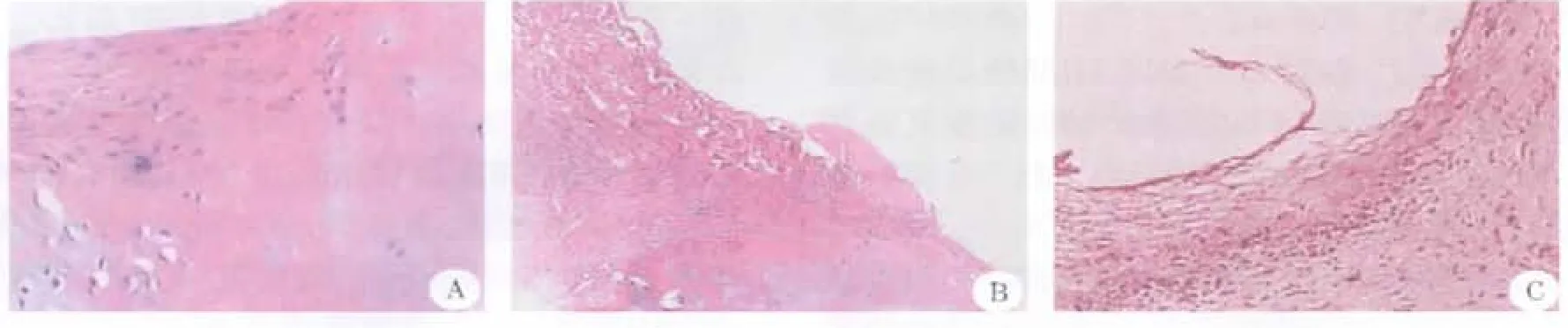
图3 软骨修复术后8周组织学观察(HE,×100)
表1 自体MSCs/Chondro-Gide®工程化软骨修复技术修复关节软骨缺损Wakitani评分值(n=8;±s)

表1 自体MSCs/Chondro-Gide®工程化软骨修复技术修复关节软骨缺损Wakitani评分值(n=8;±s)
注:与空白对照组比,①P<0.01;与AMIC组比,②P<0.01
组别 8周 16周实验组 4.63±1.18①② 3.95±1.02①②11.35±1.86 8.25±1.38 AMIC组 8.70±0.82① 7.06±1.13空白对照组
3 讨 论
本实验按照自体MSCs/Chondro-Gide®工程化软骨修复技术修复山羊膝关节股骨滑车软骨缺损,进一步验证微创条件下临床应用的可行性,自体血清培养骨髓间充质干细胞的可行性,利用胶原蛋白凝胶固定Chondro-Gide®薄膜固定方式的有效性,计算出一定面积的软骨缺损需要采集的骨髓及全血最大量,为临床应用奠定基础。
3.1 间充质干细胞诱导软骨再生可行性分析 间充质干细胞(mesenchymal stem cells,MSCs)在一定的诱导条件下,可向软骨细胞分化,经体外实验证实具有软骨细胞的形态和分泌软骨基质的能力。MSCs可来源于骨髓、骨膜或软骨膜,具有多向分化潜能,根据环境的不同可分化为软骨、骨、肌腱等。它们传代繁殖能力强,连续多次传代仍可保持良好的增殖分化活性,与基质材料复合植入体内后可在新生组织上部形成良好的透明样软骨,而在软骨下区则形成骨组织,从而可达到很好的界面整合。其中,骨髓来源的MSCs(骨髓基质干细胞bone marrow stem cells,BMSC)取材方便,分离和培养简单,成人一次骨穿取材后体外可连续培养30代以上,数量扩增一百万倍以上而依然保持良好的多向分化潜能。而且,虽然BMSC浓度随年龄增长而下降,但其活性依然良好,故有些专家认为BMSC是关节软骨缺损修复的首选种子细胞[5-7]。
3.2 自体血清培养骨髓间充质干细胞的可行性分析 组织工程骨从种子细胞的体外扩增到组织的构建与成熟都离不开血清,不同种类甚至不同批号的血清对于MSCs的贴壁、扩增以及多系潜能的维持均有不同的效果[8]。目前动物实验和临床试验普遍使用的都是牛血清,而组织工程走向临床需要符合生物安全性的产品,为了避免异种血清带来的免疫原,无血清培养技术将是今后的发展方向,但是目前其促增殖效率尚不满意,自体血清代替动物血清可能是今后一段时期内的解决方案[9]。临床上如采用自体血清培养骨髓间充质干细胞获取足够的种子细胞符合伦理委员会相关规定。
3.3 关节镜下制备膝关节软骨缺损的优越性 研究证实关节的机械应力决定关节软骨的修复;开放性手术具有视野清楚、操作方便的优点,但其创伤较大,有可能造成一些不可逆的关节损害,破坏关节的正常应力,从而影响实验结果。本实验研究通过关节镜制备了山羊膝关节软骨缺损模型。在不打开关节囊、不破坏关节内部结构的条件下完成了关节腔内关节软骨缺损的制备、microfracture治疗及种子细胞的注入。术后关节腔未发生感染,关节功能恢复较快。进一步证实设计方案是切实可行的[10]。
3.4 利用胶原蛋白凝胶固定Chondro-Gide®薄膜可行性 通过动物模拟实验,术中能不损伤正常组织情况下简单、有效牢固地固定薄膜,无脱落、起层、皱褶的发生,术后在不制动的条件下膝关节MRI影像学检查证实薄膜无脱落,关节镜探查进一步证实移植物无脱落,组织学检测证实移植物和正常组织结合较好。并且,该操作可以在关节镜下进行,具有简易性、微创性、快捷性等特点,因此该固定方式临床应用切实可行。
3.5 关节软骨缺损修复的可能途径 体内关节软骨损伤后可能的修复途径有:(1)注射的MSCs向病灶部位定向迁移,局部自我诱导分化[11];(2)损伤周围极少数软骨细胞的有丝分裂;(3)microfracture后软骨下骨髓间充质干细胞的诱导分化;局限于软骨层的缺损,缺损边缘极少数软骨细胞可出现有丝分裂现象,基质和细胞增殖迁移,合成基质增加,呈现有限的内源性修复。全层软骨缺损,软骨下骨MSCs进入缺损区,在特定环境中向软骨细胞分化修复缺损[12];(4)干细胞移植增加骨髓间充质细胞在缺损部位的有效浓度[13]。
3.6 存在的问题与不足 本实验软骨组织在物种之间差异很大,因此软骨缺损模型的选择上,马等大动物能更好模拟人的关节力学和生物学。此外,观察期较短,缺乏6个月以上组织学检查及关节镜、膝关节MRI观察;没有对修复软骨组织进行相关力学测试,所修复透明软骨样组织能否长期保持,是否发生软骨退化,是否具备关节软骨的力学要求都需要进一步追踪研究。
本实验在术后的关节制动及后期的康复性功能锻炼没有很好的模拟验证。随着研究的进一步深入,种子细胞、生物支架以及组织构建等方面不断优化改进,相信在不久的将来,组织工程技术将给以组织和器官修复为主的外科学带来革命性变化和广阔的临床应用前景。
[1]段小军,杨 柳.细胞移植技术修复关节软骨缺损的临床应用进展[J].中华关节外科杂志,2010,4(1):74-76.
[2]Alexandros E,Beris,Marios G,Lykissas.Advances in articular cartilage repair injury[J].Int J Care Injured,2005,36:S14-S23.
[3]段小军,杨 柳,顾祖超,等.人间充质干细胞在骨组织工程中的应用[J],中华骨科创伤杂志,2004,6(3):315-318.
[4]Nixon A J,Fortier L A,Williams J,et al.Enhanced repair of extensive articular defects by insulin-like growth factor- I laden fibrin composites[J].J Orthop Res,1999,17:475-487.
[5]Freed L,Martin I,Vun jak.Frontier sin tissue engineering:in vitro modulation of chondrogenesis[J].Clin Orthop,1999,367S:46-58.
[6]Grande D,Breitbart A,Mason J,et al.Cartilage tissue engineering:current limitations and solutions[J].Clin Orthop,1999,367S:176-185.
[7]Johnstone B,Yoo J.Autologous mesenchymal progenitor cells in Articular cartilage repair[J].Clin Orthop,1999,367S:156-162.
[8]Lennon D P,Hayneswoah S E,Young R G,et al.A chemically defined medium supports in vitro proliferation and maintains the osteo chondral potential of rat marrow.derived mesenchymal stem cells[J].Exp Cell Res,l995,2l9(1):2l1-222.
[9]罗 飞,许建中,王序全,等.自体血清对牛血清适应性人间充质干细胞增殖的影响[J].第三军医大学学报,2005,27(16):1634-1636.
[10]ZUO Zhenhua,YANG Liu ,DUAN Xiaojun,et al.Repair of articular cartilage defects in minipigs by microfracture surgery and BMSCs tran splantation[J].J Med Coll PLA,2007,22(5):288-292.
[11]WANG Fuyou,ZHANG Ying,DUAN Xiaojun,et al.Histomorphometric analysis of adult articular calcified cartilage zone[J].J Struct Biol,2009,168(3):359-365.
[12]倪 磊,吕厚山.修复膝关节软骨缺损的关节镜技术-微骨折技术[J].中国微创外科杂志,2005,5(5):350-351.
[13]夏万尧,曹谊林,商庆新,等.自体组织工程化软骨组织在体内最佳形成时间的研究[J].上海第二医科大学学报,2001,21(1):97-100.

