三酰甘油对糖耐量正常的2型糖尿病家系一级亲属代谢状况的影响研究
黄 融,范竹萍,陈雅文,章 明,刘 伟,胡耀敏
中国糖尿病患者合并血脂紊乱的发生率持续增高[1],主要表现为三酰甘油 (TG)水平升高和高密度脂蛋白胆固醇(HDL-C)水平降低,但目前糖、脂代谢紊乱之间的因果关系尚未阐明。本研究以2型糖尿病 (type 2 diabetes mellitus,T2DM)家系为研究对象,旨在探讨TG水平对糖耐量正常的T2DM家系一级亲属代谢状况的影响,从而为高危人群的防治提供依据。
1 资料与方法
1.1 病例纳入标准 入选标准:T2DM家系一级亲属,即家系中至少有两代人,每代中至少有1例T2DM患者,家系的一级亲属指先证者的同胞或子女;无糖尿病病史;糖耐量正常:口服葡萄糖耐量试验 (OGTT)显示空腹血糖<6.1 mmol/L,糖负荷后2 h血糖<7.8 mmol/L为标准。排除标准:有明显心、肝、肾功能异常和甲状腺疾病者;使用过调脂药物者。
1.2 一般资料 选取2009年1月—2010年6月上海仁济医院内分泌科门诊符合上述病例纳入标准的糖耐量正常的T2DM家系一级亲属497例,其中男219例,女278例;年龄31~75岁,平均 (43.8±14.0)岁。受试者均签署知情同意书。
1.3 方法
1.3.1 病史采集及体格检查 对所有受试者进行病史采集和体格检查,空腹测定身高、体质量、腰围、臀围、血压等,计算体质指数 (BMI)。
1.3.2 生化指标检测 (1)OGTT:所有受试者空腹10~12 h后进行OGTT(75 g葡萄糖),于空腹和糖负荷后30、60、120、180 min,分别采用葡萄糖氧化酶法和放射免疫分析法测定血糖和胰岛素水平。(2)采用高压液相法测定糖化血红蛋白 (HbA1c)。(3)采用酶学方法测定血脂,包括TG、总胆固醇 (TC)、高密度脂蛋白 (HDL)、低密度脂蛋白 (LDL)。
1.3.3 胰岛素敏感性及胰岛β细胞功能评估方法 葡萄糖曲线下面积 (AUC-G)=(空腹血糖+糖负荷后180 min血糖)/2+糖负荷后30 min血糖+糖负荷后60 min血糖+糖负荷后120 min血糖。胰岛素敏感性的评估采用稳态模型的胰岛素抵抗指数 (HOMA-IR)=空腹血糖×空腹胰岛素/22.5。胰岛β细胞功能采用以下2个指标综合评价:(1)稳态模型的胰岛素分泌指数 (HOMA-β)=20×空腹胰岛素/(空腹血糖-3.5);(2)糖负荷后30 min胰岛素增值 (△I30)与葡萄糖增值 (△G30)的比值,即△I30/△G30[2]。
1.3.4 分组方法 根据TG的四分位数水平,将497例受试者分为4组:(1)TG1组:TG<0.77 mmol/L,122例;(2)TG2组:0.77≤TG<1.06 mmol/L,123例; (3)TG3组:1.06≤TG<1.58 mmol/L,127例;(4)TG4组:TG≥1.58 mmol/L,125例。比较4组受试者的一般资料、胰岛素敏感性、胰岛β细胞功能,并分析影响血糖的主要危险因素。
1.4 统计学方法 采用SPSS 16.0软件进行统计学分析。计量资料以 ()表示,多组间均数比较采用方差及协方差分析,多因素分析采用多元逐步回归分析。以p<0.05为差异有统计学意义。
2 结果
2.1 4组受试者一般资料比较 4组受试者性别、腰臀比及HbA1c水平比较,差异无统计学意义 (P>0.05)。TG4组收缩压、舒张压、BMI、TC、LDL水平均显著高于 TG1、TG2、TG3组,年龄及AUC-G亦显著高于TG1、TG2组,而HDL水平则显著低于TG1、TG2、TG3组,差异有统计学意义 (p<0.05,见表1)。

表1 4组受试者一般资料比较Table 1 Comparison of clinical data among four groups
2.2 4组受试者胰岛素敏感性及胰岛β细胞功能比较 TG3组HOMA-IR显著高于TG1组,TG4组HOMA-IR显著高于TG1、TG2、TG3组,组间差异有统计学意义 (p<0.05);TG3组和TG4组HOMA-β均显著高于TG1组和TG2组,差异有统计学意义 (p<0.05);提示随着TG水平的增高,HOMA-IR及HOMA-β逐渐增高。从TG1组到TG3组,△I30/△G30逐渐增高,组间两两比较差异有统计学意义 (p<0.05);但TG4组该值与TG3组比较,差异无统计学意义 (P>0.05,见表2)。
2.3 多元逐步回归分析结果 采用协方差分析控制年龄、收缩压、舒张压、BMI等因素,将血脂、HOMA-IR、HOMA-β及△I30/△G30为自变量,AUC-G为应变量进行多元逐步回归分析,最终TG、LDL及△I30/△G30进入回归方程 (见表3),说明三者是影响血糖的主要因素。
表2 4组受试者胰岛素敏感性及胰岛β细胞功能比较 Table 2 Comparison of insulin sensitivity and beta-cell function among 4 groups
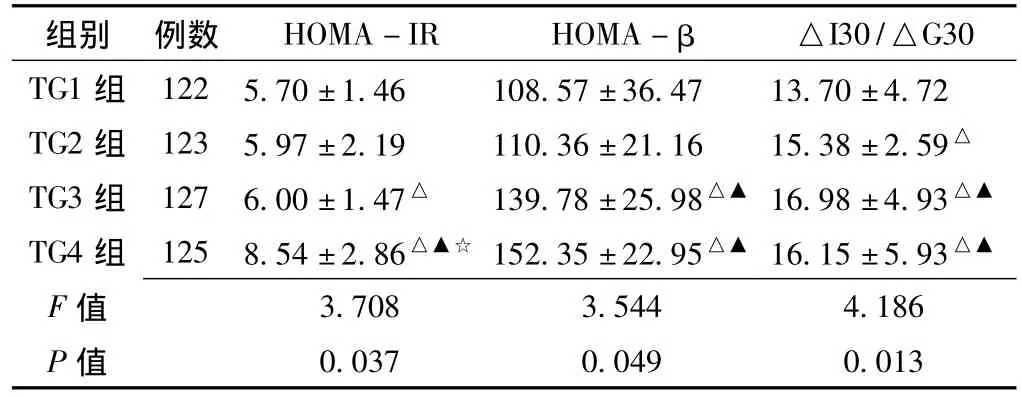
表2 4组受试者胰岛素敏感性及胰岛β细胞功能比较 Table 2 Comparison of insulin sensitivity and beta-cell function among 4 groups
注:HOMA-IR=胰岛素抵抗指数,HOMA-β=胰岛素分泌指数,△I30=糖负荷后30 min胰岛素增值,△G30=糖负荷后30 min葡萄糖增值;与TG1组比较,△p<0.05;与TG2组比较,▲p<0.05;与TG3组比较,☆p<0.05
组别 例数 HOMA-IR HOMA-β △I30/△G30 TG1组 122 5.70±1.46 108.57±36.47 13.70±4.72 TG2组 123 5.97±2.19 110.36±21.16 15.38±2.59△TG3组 127 6.00±1.47△ 139.78±25.98△▲ 16.98±4.93△▲TG4组 125 8.54±2.86△▲☆ 152.35±22.95△▲ 16.15±5.93△▲F 值0.037 0.049 0.013 3.708 3.544 4.186 P值
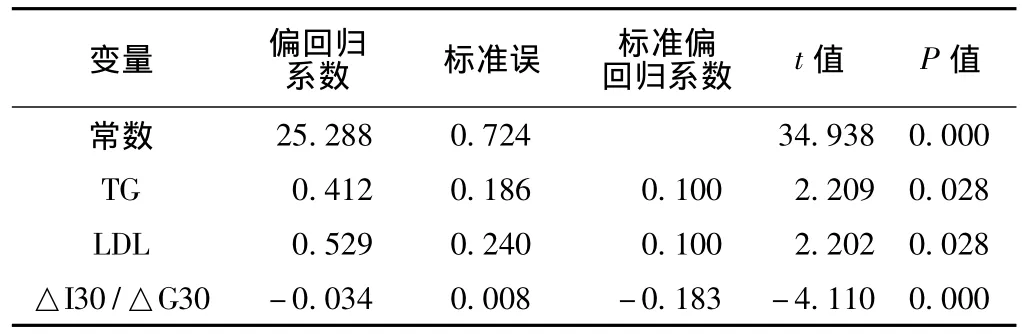
表3 AUC-G的多元逐步回归分析结果Table 3 Results of stepwise regression analysis with AUC-G
3 讨论
高TG血症是常见的血脂紊乱类型,在成年男性中其发病率达20% ~35%[3-4],有研究表明它是心血管疾病死亡的独立危险因素[5]。T2DM是心血管疾病死亡的等危症,患者常合并有血脂代谢紊乱,表现为TG水平升高和HDL-C水平降低。近30年来,我国糖尿病患病率显著增加[6],Yang等[7]报道中国糖尿病的发病率为9.7%,糖尿病前期发病率为15.5%。若能揭示高TG血症与糖尿病在疾病早期阶段之间的关系,可能会给临床上糖尿病防治工作带来实际意义。
在糖尿病前期人群中发现,高TG血症是发生T2DM的一个预测因子[8],采用家系内对照,研究人群的遗传背景、生活方式相近,可以排除许多混杂因素的影响,而以家系为研究对象,分析TG对糖耐量正常人群糖代谢的影响在我国报道甚少。本研究结果显示,TG4组患者的收缩压、舒张压、BMI均显著高于TG1组,随着TG水平增高,虽然HbA1c无显著改变,但AUC-G、HOMA-IR及HOMA-β逐渐增高,TG4组显著高于TG1组。从TG1组到TG3组,作为评价早期β细胞胰岛素分泌功能的指数——△I30/△G30逐渐增高,且在TG2与TG1组间已经存在显著差异。其次,通过多元逐步回归分析发现,TG、LDL和△I30/△G30是影响血糖的主要因素。说明T2DM家系中糖耐量正常的一级亲属即使血糖维持在正常水平,TG处于正常水平 (<1.7 mmol/L),其胰岛素分泌已出现代偿性增加;当TG水平明显增高时,可出现胰岛β细胞功能下降,且以胰岛素早期分泌缺陷更为主要,这与Stadler等[9]的报道结果一致。
TG水平升高可伴随游离脂肪酸 (FFA)水平的升高,FFA与胰岛素敏感性呈负相关[10],升高的TG与葡萄糖竞争进入细胞,影响葡萄糖利用和代谢。另外,FFA会抑制胰岛素与其受体的结合,导致血中胰岛素水平升高,但其生物活性下降。TG在胰岛细胞内堆积,抑制葡萄糖刺激的胰岛素分泌,最终导致胰岛β细胞数量减少、功能减退,进而表现为血糖升高[11-12],高TG血症对糖尿病家族史阳性者的糖代谢影响则更为显著[13]。
总之,在对糖尿病高危人群的防治中,应高度重视高TG血症及临界水平患者,对这部分患者进行积极血脂干预和血糖监测,可在更早阶段发现糖代谢异常。
1 Xu ZR,Molyneaux L,Wang YZ,et al.Clustering of cardiovascular risk factors with diabetes in Chinese patients:the effects of sex and hyperinsulinaemia[J].Diabetes Obes Metab,2001,3(3):157 -162.
2 李光伟.对胰岛β细胞功能评估的再认识 [J].国外医学:内分泌学分册,2005,25(3):164-166.
3 Ford ES,Li C,Zhao G,et al.Hypertriglyceridemia and its pharmacologic treatment among US adults[J].Arch Intern Med,2009,169(6):572-578.
4 Aguilar- Salinas CA,Gomez- Perez FJ,Rull J,et al.Prevalence of dyslipidemias in the Mexican National Health and Nutrition Survey 2006[J].Salud Publica Mex,2010,52(Suppl 1):S44-S53.
5 DeFronzo RA.Insulin resistance,lipotoxicity,type 2 diabetes and atherosclerosis:the missing links.The Claude Bernard Lecture 2009 [J].Diabetologia,2010,53(7):1270-1287.
6 中华医学会糖尿病分会.中国2型糖尿病防治指南 (2010年版)[J].中国糖尿病杂志,2012,20(1):S1-S36.
7 Yang W,Lu J,Weng J,et al.Prevalence of diabetes among men and women in China[J].N Engl J Med,2010,362(12):1090 -1101.
8 Rasmussen SS,Glumer C,Sandbaek A,et al.Determinants of progression from impaired fasting glucose and impaired glucose tolerance to diabetes in a high-risk screened population:3 year follow-up in the ADDITION study,Denmark [J].Diabetologia,2008,51(2):249-257.
9 Stadler M,Pacini G,Petrie J,et al.Beta cell(dys)function in non-diabetic offspring of diabetic patients[J].Diabetologia,2009,52(11):2435-2444.
10 李宏亮,余叶蓉,喻红玲,等.单纯性肥胖患者外周胰岛素抵抗与细胞功能的研究 [J].四川大学学报 (医学版),2005,36(3):378-381.
11 Dubois M,Kerr-Conte J,Gmyr V,et al.Non- esterified fatty acids are deleterious for human pancreatic islet function at physiological glucose concentration [J].Diabetologia,2004,47(3):463 -469.
12 van Wijk JP,Halkes CJ,Erkelens DW,et al.Fasting and daylong triglycerides in obesity with and without type 2 diabetes[J].Metabolism,2003,52(8):1043-1049.
13 Kashyap S,Belfort R,Gastaldelli A,et al.A sustained increase in plasma free fatty acids impairs insulin secretion in nondiabetic subjects genetically predisposed to develop type 2 diabetes [J].Diabetes,2003,52(10):2461-2474.

