太湖猪(二花脸)GH、MyoG和H-FABP基因遗传多态性分析
邵芳,鲍学凯,冯宇,金星方,丁涵高,顾志良
(1.常熟理工学院生物与食品工程学院,江苏常熟 215500;2.苏州大学基础医学与生物科学学院,江苏苏州 215123;3.江苏省常熟市畜牧兽医站,江苏常熟 215500)
太湖猪(二花脸)GH、MyoG和H-FABP基因遗传多态性分析
邵芳1,2,鲍学凯1,冯宇3,金星方3,丁涵高3,顾志良1
(1.常熟理工学院生物与食品工程学院,江苏常熟 215500;2.苏州大学基础医学与生物科学学院,江苏苏州 215123;3.江苏省常熟市畜牧兽医站,江苏常熟 215500)
采用PCR-RFLP方法分析了太湖猪(二花脸)群体中生长激素(growth hormone,GH)、心脏脂肪酸结合蛋白(heart fatty acid-binding protein,H-FABP)和肌细胞生成素(Myogenin,MyoG)基因的多态性.结果表明:在检测的二花脸群体中,GH基因经DraⅠ、MspⅠ酶切无多态性,ApaⅠ酶切出现2个等位基因、3种基因型,基因型频率呈AA>AB>BB的趋势,等位基因A的基因频率大于等位基因B.MyoG基因在PCR1/MspⅠ位点上,基因型AB占据一定的优势;在PCR2/MspⅠ位点上,等位基因A占据绝对的优势,基因型频率趋势为AA>AB>BB.H-FABP基因的HinfⅠ位点上,等位基因h的基因频率有一定的优势.经χ2适合性检验表明,GH、MyoG、H-FABP 3个基因在太湖猪(二花脸)群体中的分布均符合Hardy-Weinberg平衡(P>0.05).
太湖猪;PCR-RFLP;GH;MyoD;H-FABP
生产性能的最大化及肌肉品质的优质化一直以来都是动物生产者所追求的.动物的生长是由促生长激素轴来调控的,促生长激素轴中各激素在动物的生长发育过程中发挥重要的调节作用,其中生长激素(growth hormone,GH)是促进动物生长发育的主要内分泌激素,提高生长轴中GH水平,能促进增重、提高饲料转化率和改善肉品质[1].心脏脂肪酸结合蛋白(heart fatty acid-binding protein,H-FABP)基因是脂肪酸结合蛋白(Fatty Acid Binding Protein,FABP)家族成员之一,参与细胞内脂肪酸的运输,对猪的肌内脂肪(In⁃tramuscular fat,IMF)含量影响显著,被认为是猪肌肉内脂肪沉积的主效基因[2-5].肌细胞生成素(Myogenin,MyoG)属于碱性螺旋-环-螺旋(bHLH)转录因子,是生肌调节因子(myogenic regulatory factors,MRFs)家族成员之一,在肌细胞的形成过程中起着中心调控作用[6],与肌纤维的数量、大小以及生长分化相关[7].
太湖猪(二花脸)以繁殖性能高、母性好、耐粗饲和肉质鲜美等优良特性而著称于世,是我国宝贵的猪种资源,但生长速度较慢,脂肪含量高.结合太湖猪(二花脸)猪种的特点,开展其功能基因的结构研究,寻找与快速生长、高瘦肉率、低脂肪率相关的多态性位点具有现实意义,能短期内实现猪种的改良,从而提高经济效益.鉴于GH、H-FABP和MyoG基因在调控生长、改善肌肉品质方面的重要作用,本研究利用PCR-RFLP技术,对太湖猪GH、H-FABP和MyoG这三个功能基因进行多态性研究,进一步作群体遗传学分析,以期对太湖猪(二花脸)相应基因的功能和群体遗传学结构有更加全面的认识.
1 材料与方法
1.1 试验动物与样品采集
从常熟市畜禽良种有限责任公司采集太湖猪(二花脸)保种群95个个体的耳组织,放入装有75%乙醇的1.5 m L离心管中,于-20℃保存备用.
1.2 耳组织DNA的提取
基因组DNA的提取方法详见分子克隆实验指南,提取的DNA样品用0.7%琼脂糖凝胶电泳检测其质量,NanoDrop2000(Thermo Scientific,USA)测定其浓度,用TE稀释成100 ng/μL,放于-20℃冰箱备用.
1.3 引物设计与合成
实验所用引物参照相关文献设计[8-10],引物序列、产物长度、退火温度等详细信息见表1.引物均由上海生工生物工程有限公司合成.
1.4 PCR反应体系与反应条件
PCR反应体系为25μL:2.5μL 10×Buf⁃fer,2μL dNTP Mix⁃ture(2.5 mmol/L),1μL上游引物(10 pmol/L),0.2μL rTaq DNA聚合酶(5 U/μL),1μL DNA模板(100 ng/ uL),17.3μL ddH2O.反应程序:95℃预变性5 min;95℃变性30 sec,57℃退火30 sec,72℃延伸1 m in,35个循环;72℃延伸10 m in.PCR产物经1%琼脂糖凝胶电泳检测扩增效果.
1.5 PCR-RFLP检测
分别用限制性内切酶ApaⅠ、DraⅠ、MspⅠ消化GH基因PCR扩增产物,酶切体系为15μL:10×buffer 2.0μL,限制性内切酶1.0μL(10 U/μL),PCR产物5.0μL,ddH2O 7.0μL,置37℃恒温水浴中反应4 h.MyoG和H-FABP酶切体系同GH基因.最后根据酶切片段大小,使用不同浓度的琼脂糖凝胶进行电泳、基因型分型.

表1 PCR引物的信息
1.6 遗传统计方法
基因频率:基因频率=某基因总数/等位基因的总数.
基因型频率:基因型频率=基因型个体/测定群体总数.
基因纯合度(Homozygosity,Ho)的计算公式如下:

杂合度(Heterozygosity,He)的计算公式如下:
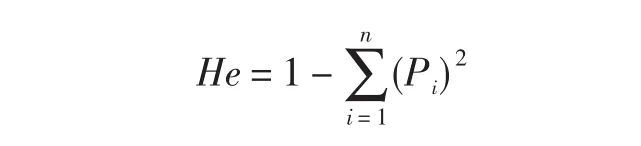
有效等位基因数(Effective number of alleles,Ne)的计算公式如下(其中:n为等位基因数;Pi为第i个等位基因的频率):

多态信息含量(Polymorphism Information Content,PIC)的计算公式如下(其中:k为等位基因数目;Pi和Pj分别为第i和第j个等位基因的频率):

Hardy-Weinberg平衡检验的计算公式如下(其中,Oi为实际观察值;Ei为理论值;n为等位基因数):

2 结果与分析
2.1 二花脸猪GH基因PCR-RFLP检测
以二花脸猪基因组为模板,引物SusGH F/R进行PCR扩增,PCR扩增产物经1%的琼脂糖凝胶电泳检测(见图1A),结果显示,获得长度为576 bp的PCR扩增产物.GH基因的PCR扩增产物经ApaⅠ酶切后产生2个等位基因A(434+142)bp和B(302+274)bp;3种基因型[8](见图1B),即AA型(434 bp,142 bp)、AB型(434 bp,274 bp,142 bp)和BB型(302 bp,274 bp).GH基因PCR扩增产物经MspⅠ(图1C)和DraⅠ(图1D)酶切后仅产生一种基因型,即95个个体全为AA型.
2.2 二花脸猪MyoG基因PCR-RFLP检测
以太湖猪基因组为模板,分别用引物SusMyoG F1/R1、SusMyoG F2/R2进行PCR扩增,PCR扩增产物经1%的琼脂糖凝胶电泳检测,结果如图2A,2B所示.MyoG基因的F1/R1扩增产物片段长度为959 bp,位于外显子2、3及内含子2,经MspⅠ限制性内切酶酶切电泳后(见图2C),出现5条带,分别为418 bp、370 bp、264 bp、171 bp、154 bp.定义(370+264+171+154)bp为等位基因A,(418+370+171)bp为等位基因B[9].MyoG基因的F2/R2扩增产物片段长度为353 bp,位于3’端侧翼序列,经MspⅠ限制性内切酶酶切后,产生两个等位基因A(353 bp)和B(219+134)bp,根据条带的数目和位置,确定有3种基因型(图2D),分别为AA基因型(353 bp)、AB基因型(353 bp,219 bp,134 bp)、BB基因型(219 bp,134 bp)[9].
2.3 二花脸猪H-FABP基因PCR-RFLP检测
H-FABP基因经PCR扩增后获得长度为693 bp的PCR扩增产物(见图3A),HinfⅠ酶切结果见图3B,共有4个HinfⅠ酶切位点.PCR-RFLP结果如图3B所示,根据条带的数目和位置,确定有3种基因型,分别为HH基因型(339 bp,172 bp,98 bp,59 bp,25 bp),Hh基因型(339 bp,231 bp,172 bp,98 bp,59 bp,25 bp),hh基因型(339 bp,231 bp,98 bp,25 bp)[10].
2.4 二花脸猪GH、MyoG、H-FABP基因的等位基因频率和基因型频率
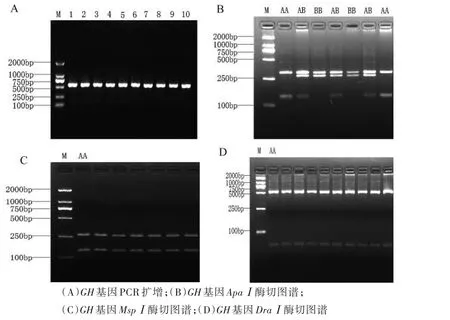
图1 GH基因PCR-RFLP检测结果
由表2可知,对于GH基因,太湖猪以AA基因型为优势基因型,基因型频率为0.5368,其次是AB基因型,BB型基因频率最低,等位基因A为优势基因,基因频率为0.7105.MyoG基因PCR1/MspⅠ多态性位点不同基因型频率呈现趋势为AB>AA>BB,等位基因A与B基因频率相差不大.MyoG基因PCR2/MspⅠ酶切位点,以AA基因型为优势基因型,基因型频率为0.7363,其次是AB基因型,BB型基因频率最低,仅为0.0211.等位基因A为优势基因,基因频率为0.8526.太湖猪H-FABP基因,以Hh基因型为优势基因型,基因型频率为0.5369,其次是hh基因型,HH型基因频率最低,仅为0.0947.等位基因h为优势基因,基因频率为0.6368.
2.5 GH、MyoG和H-FABP基因的群体遗传特性分析
群体遗传分析表明(见表3):太湖猪GH、MyoG和H-FABP基因纯合度均大于杂合度.其中MyoG基因片段2纯合度最高,为0.7487,GH和H-FABP基因纯合度与杂合度差异不明显.MyoG基因片段2多态性信息含量PIC<0.25,为低度多态;GH、MyoG片段1和H-FABP基因PIC均在0.25~0.5之间,为中度多态.Har⁃dy-Weinberg平衡适合性检验结果表明:太湖猪这几个功能基因χ2值均小于5.99,说明均处于Hardy-Weinberg平衡状态(P>0.05).

图2 MyoG基因PCR-RFLP检测结果
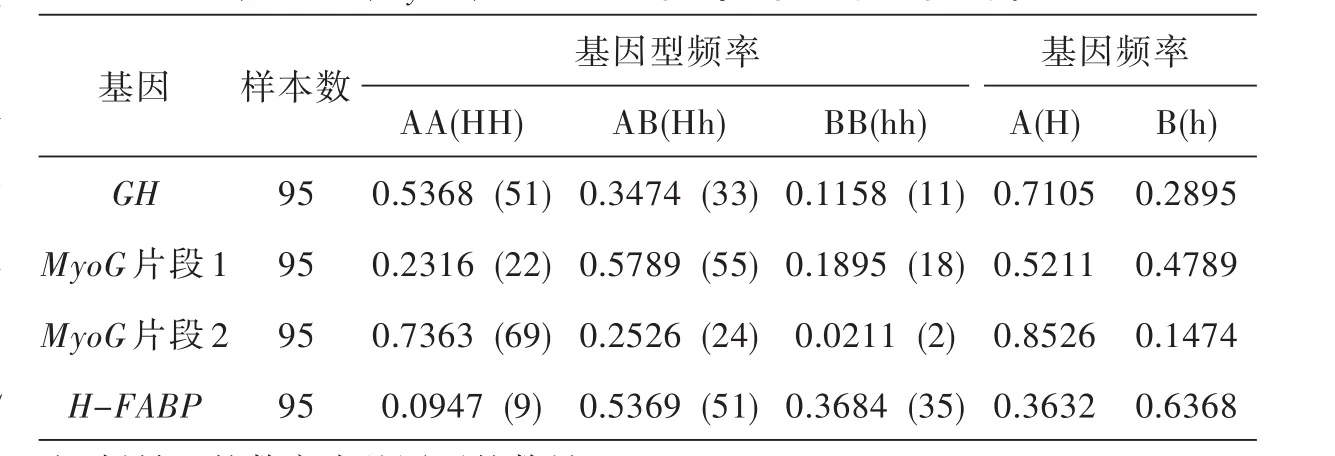
表2 GH、MyoG、H-FABP基因的基因型和基因频率

表3 太湖猪GH、MyoG、H-FABP基因纯合度、杂合度、有效等位基因数、多态信息含量和Ha rdy-W einberg平衡状态检验
3 讨论
3.1 GH基因对猪生长性能的影响
猪生长激素基因(pGH)是促进其生长发育的主效基因,该基因存在多种酶切位点,有较丰富的限制性片段长度多态性(RFLP),与生长发育、胴体性状等生产性能相关[11].pGH基因ApaⅠ是目前研究较多的功能位点,该片段G→A多肽位点,导致ApaⅠ酶切出现2个等位基因、3种基因型,不同品种间表现差异[8,12-13].宋成义等人研究发现GH基因ApaⅠ识别的多态位点的不同基因型对姜曲海猪的70日龄体重影响差异显著,认为该处突变可能对GH基因的表达产生影响[13].胡尚等人研究高坡猪GH基因对其部分生产性能的影响发现,AA基因型的腹围和瘦肉率与BB基因型相比差异显著.本研究发现太湖猪(二花脸)等位基因A(0.7105)的频率明显高于等位基因B(0.2895),AA型为优势基因型,这与皮特兰、杜洛克、长白、香猪、南昌白猪研究结果一致[14].太湖猪群体中GH基因MspⅠ酶切后不同于藏猪、皮特兰、杜洛克和姜曲海猪[13],没有多态性.
3.2 MyoG基因对猪部分生长性状的影响
SoumilIion等用PCR-RFLP检测MyoG基因,发现一个MspⅠ酶切位点位于基因的3’-UTR区,一个位于第2内含子内,另一个梅山猪特异性MspⅠ酶切位点位于启动子内[15].前人研究认为MyoG基因3’端MspⅠ位点不同等位基因对胴体品质和肉质性状的遗传效应主要体现在与肌肉相关的各种生产性状上,不同基因型对不同生产性能的影响存在巨大的差异.大量的研究已经证明,A基因是外种猪群体中的优势等位基因,而大多数中国地方猪种中的优势基因则是等位基因B[16].朱砺等分析了不同品种猪MyoG基因3’端MspⅠ位点多态性,发现等位基因B能极显著地增加胴体瘦肉率和眼肌面积,降低皮脂含量,同时还能显著降低猪肉品质,使pH值、肉色和肌肉内脂肪含量降低,使肌肉吸水能力变差[17].林万华等研究报道,第2内含子内MspⅠ酶切位点上,外来品种杜洛克、长白、大约克及培育品种南昌白猪极大多数个体表现为AA型,个别为BB型,而6个中国地方猪种除乐平花猪外,BB型占优势[18],本实验研究发现太湖猪(二花脸)内含子2 MspⅠ酶切位点,基因型频率呈AB>AA>BB的趋势,等位基因A的频率与等位基因B差异不大.在3’端MspⅠ位点,太湖猪(二花脸)基因型频率呈AA>AB>BB的趋势,等位基因A(0.8526)的频率是等位基因B(0.1474)的近6倍,这与前人所报道的中国地方猪种几乎表现为单一的MM基因型检测结果不一致[9,18].
3.3 H-FABP基因对猪相关性状的影响
Gerbens等对H-FABP基因的单核苷酸多态性位点进行检测,发现多态位点定位于H-FABP基因的5’上游区,由限制性内切酶HinfⅠ识别.高妍等人发现HinfⅠ多态性在所检测的7个猪种中普遍存在,且松辽黑猪H-FABP基因的遗传变异对IMF含量的影响极显著(P<0.01),表现趋势为HH>Hh>hh,三种基因型差异极显著(P<0.01)[10].林万华等人基于候选基因分析H-FABP基因对肌肉粗脂肪含量的影响得出其表现趋势为HH>Hh>hh[19].而本研究中,太湖猪(二花脸)H-FABP不同基因型频率呈现Hh>hh>HH的趋势,等位基因h为优势基因.
本试验对太湖猪(二花脸)群体GH、MyoG、H-FABP基因多态性作了初步的分析,今后还需要通过扩大品种和样本数量进一步研究GH、MyoG、H-FABP基因的多态性,同时,记录不同品种不同个体的经济性状,进一步分析基因多态性与猪生产性能的关系.

图3 H-FABP基因PCR-RFLP检测结果
[1]顾志良,王慧娟,郁建锋.动物GH/IGF-Ⅰ轴调控机制的研究进展[J].中国畜牧兽医,2011,38(10).
[2]Gerbens F,de Koning D J,Harders F L,et al.The effect of adipocyte and heart fatty acid-binding protein genes on intramuscular fatand backfat content in Meishan crossbred pigs[J].JAnim Sci,2000,78(3):552-559.
[3]Gerbens F,Verburg F J,Van Moerkerk H T,et al.Associations of heart and adipocyte fatty acid-binding protein gene expression with intramuscular fat content in pigs[J].JAnim Sci,2001,79(2):347-354.
[4]LiB,Zerby H N,Lee K.Heart fatty acid binding protein is upregulated during porcine adipocyte development[J].JAnim Sci,2007, 85(7):1651-1659.
[5]ArnyasiM,Grindflek E,Javor A,et al.Investigation of two candidate genes formeat quality traits in a quantitative trait locus region on SSC6:the porcine short heterodimer partner and heart fatty acid binding protein genes[J].JAnim Breed Genet,2006,123(3):198-203.
[6]Weintraub H, Davis R, Tapscott S, et al. The myoD gene family: nodal point during specification of the muscle cell lineage[J]. Sci⁃ence, 1991, 251(4995): 761-766.
[7]Sabourin L A,RudnickiM A.Themolecular regulation ofmyogenesis[J].Clin Genet,2000,57(1):16-25.
[8]张浩,强巴央宗,张明明,等.藏猪生长激素基因(p GH)多态性研究[J].西北农业学报,2010,19(2):5.
[9]赵青,钟土木,徐宁迎.金华猪MyoG基因多态性与部分生长性能的关系[J].华南农业大学学报,2010,31(2).
[10]高妍,张永宏,姜宁,等.猪H-FABP基因遗传多态性及与肌内脂肪含量的相关分析[J].中国兽医学报,2008,28(5):5.
[11]Cheng W T,Lee C H,Hung CM,et al.Growth hormone gene polymorphisms and growth performance traits in Duroc,Landrace and Tao-Yuan pigs[J].Theriogenology,2000,54(8):1225-1237.
[12]赵丽莉,聂光军,郭晓令,等.金华猪生长激素基因的多态性及其对经济性状的影响[J].中国畜牧杂志,2006,42(5):4.
[13]宋成义,经荣斌,陶勇,等.猪GH基因部分突变位点对生产性能的影响[J].遗传,2001,23(5):4.
[14]Song C Y,Gao B,Jing R B,et al.Study on pig growth hormone gene polymorphisms in western meat-type breeds and Chinese lo⁃calbreeds[J].JZhejiang Univ Sci,2003,4(6):734-739.
[15]Soumillion A,Erkens JH,Lenstra JA,etal.Genetic variation in the porcinemyogenin gene locus[J].Mamm Genome,1997,8(8): 564-568.
[16]te PasM F,Soumillion A,Harders F L,etal.Influences ofmyogenin genotypes on birth weight,growth rate,carcassweight,back⁃fat thickness,and lean weightof pigs[J].JAnim Sci,1999,77(9):2352-2356.
[17]朱砺,李学伟.MyoG基因的遗传效应分析[J].遗传,2005,27(5):5.
[18]林万华,黄路生,艾华水,等.MyoG基因型对二花脸猪早期生长性状及肌肉组织学特性的影响[J].农业生物技术学报,2002,10(4):6.
[19]林万华,任军,丁能水,等.H-FABP基因型对二花脸猪相关性状影响的初步分析[J].畜牧兽医学报,2003,34(4):7.
Polymorphisms of GH、MyoG、H-FABP Gene in Taihu Pigs
SHAO Fang1,2,BAO Xue-kai1,FENG Yu3,JIN Xing-fang3,Ding Han-gao3,GU Zhi-liang1
(1.School of Biology and Food Technology,Changshu Institute of Technology,Changshu 215500,China; 2.College of Basic Medicine and Biological Science,Soochow University,Suzhou 215123,China; 3.Animal Husbandry and Veterinary Station of Changshu,Changshu 215500,China)
PCR-RFLP was used to analyze the polymorphisms of GH、MyoG and H-FABP gene in Taihu pigs. The results showed that there were no polymorphisms at DraⅠand MspⅠsite,while there were 2 alleles,3 gen⁃otypes(AA,AB and BB)at ApaⅠsite of GH gene.The genotype frequencies of GH gene had a tendency of AA>AB>BB.The frequency of allele B wasmuch higher than A in GH gene.The polymorphisms of two frag⁃ments of MyoG digested by MspⅠwere detected.The polymorphisms at PCR1/MspⅠshowed AB genotype were predom inant.In PCR2-/MspⅠsites,allele A occupied absolute advantage,the genotype frequencies of MyoG gene had a tendency of AA>AB>BB.In the H-FABP HinfⅠsites,allele h with 0.6368 was advantageous com⁃pared with allele H.According to the calculated chi-square value,it verified that three genes were all consistent with the Hardy-Weinberg equilibrium(P>0.05).
Taihu pig;PCR-RFLP;GH;MyoG;H-FABP
S828.8
A
1008-2794(2012)08-0055-06
2012-05-25
常熟市科技(社会发展)计划项目“太湖猪(二花脸)基因库的活体保存与利用”(CS201010)
邵芳(1989—),女,江苏建湖人,苏州大学基础医学与生物科学学院硕士研究生.
顾志良(1968—),男,江苏常熟人,教授,博士,研究方向:动物分子遗传学,E-mail:zhilianggu88@hotmail.com.

