反相高效液相色谱法测定大鼠脑组织中4种氨基酸类神经递质
张宇浩 马昱 郭曦 王勤 曹志娟
(1.复旦大学附属中山医院神经内科,上海 200032;2.复旦大学附属中山医院分部内科,上海 200052;3.空军94789部队机关医院口腔科,江苏南京 210018;4.复旦大学药学院,上海 200032)
存在于脑组织和脑脊液中的多种氨基酸类神经递质,对于调节机体生理活动具有重要作用,其含量及比例的变化伴随着多种中枢神经系统疾病的发生及发展[1]。其中,谷氨酸(glutamate,Glu)和天门冬氨酸(aspartate,Asp)是脑部的兴奋性神经递质,牛磺酸(taurine,Tau)是脑部的抑制性神经递质,γ-氨基丁酸(γ-aminobutyric acid,γ-GABA)的作用较为复杂。测定神经递质含量的变化对于神经系统疾病的诊断、治疗和预后分析有重要的参考价值。常用的氨基酸类神经递质的测定方法为高效液相色谱法、微流控、电泳法分离与衍生化后荧光检测相结合[2-3]。通常采用丹酰氯衍生化、邻苯二甲醛(O-phthalaldehyde,OPA)、2,4-二硝基氟苯、2,6-二甲基-4-喹啉羧酸-N-羟基琥珀酰亚胺酯[4]等试剂进行柱前衍生荧光检测氨基酸的含量[4]。其中,OPA检测的灵敏度高,衍生化反应迅速安全。本研究对大鼠脑组织中的神经递质的测定,采用OPA作为柱前衍生化试剂,建立一种简单、快速、灵敏的高效液相色谱技术,以期为神经系统疾病发病机制的研究提供方法基础。
1 资料与方法
1.1 试剂和仪器 Asp、Glu、γ-GABA、Tau和OPA(纯度80%)购自于上海日初生化有限公司;高丝氨酸(homoserine,Hse)和β-巯基乙醇购自于Sigma公司。乙腈和甲醇购于汉邦试剂有限公司,均为一级色谱纯。高氯酸、磷酸二氢钾、碳酸钾等试剂均购自于国药试剂集团,分析纯。超纯水由Millipore公司生产的Milli-Q纯水仪制备。
液相色谱仪系统:HITACHI L2000型高效液相色谱仪,包括 Hitachi Organizer(试剂架),L-2130型四元泵、L-2200型自动进样器,L-2300型柱温箱,L-2455型二极管阵列检测器,L-2485型荧光检测器,日立色谱工作站,由日本日立公司提供。
1.2 方法
1.2.1 色谱条件 色谱柱为Dikma Inertsil ODS(250mm× 4.6mm,3.5μm),预柱 Dikma,C18,4.0mm×3.0mm。流动相为磷酸二氢钾缓冲液(0.1mol/L,pH 6.0)∶甲醇∶乙腈 (6∶3∶1);流速为1mL/min;检测条件:荧光检测器,激发波长为345nm,发射波长为460nm。柱温40℃,进样量20μL。
1.2.2 试剂配制
1.2.2.1 衍生化试剂的配制及衍生反应 称取13.4mg的OPA溶于1mL的乙醇中,加入20μL β-巯基乙醇以及4mL四硼酸钠缓冲液(0.1mol/L,pH 9.6)。密封后低温保存。隔天加入20μLβ-巯基乙醇。标准溶液和预处理后样品精密量取40 μL,加入OPA衍生剂20μL轻轻混匀,静置2min,进样20μL进行高效液相色谱分析。以保留时间定性,峰面积内标法定量。
1.2.2.2 储备液的配制 精密称定 Asp 13.10 mg、Glu 14.71mg、γ-GABA 10.31mg 和 Tau 12.53mg,分别置10mL容量瓶中,加入含50%甲醇的0.1mol/L碳酸钾溶液(Buffer A)定容,制得浓度为10mmol/L的各种氨基酸母液。精密称取Hse 119.12mg置100mL量瓶中,加入Buffer A溶解,定容制得10mmol/L的内标母液。精密吸取Asp、Glu、γ-GABA和Tau母液各1.0mL,分别置10mL量瓶中,Buffer A稀释定容,作为1号储备液(1mmol/L);再次精密吸取1mL各氨基酸的1号储备液,分别置10mL量瓶中,Buffer A定容作为2号储备液(100μmol/L),-20℃保存。提取回收率储备液配制:精密吸取10mmol/L的 Asp、Glu、γ-GABA和Tau母液0.3mL置于同10mL量瓶中,Buffer A稀释定容即得3号混合标准储备液(0.3 mmol/L)。
精密量取3mL的内标母液置100mL的量瓶中,Buffer A稀释定容可得1号内标储备液(0.3 mmol/L);精密量取1mL的内标母液,置10mL的量瓶中,Buffer A稀释定容可得2号内标储备液(1mmol/L);精密量取2号内标储备液1mL,置100mL容量瓶中,用Buffer A稀释定容得3号内标储备液(10μmol/L)。
1.2.3 标准曲线的绘制 分别精密量取Asp、Glu、γ-GABA、Tau的2号储备液各1.0mL置同一个10mL量瓶中,用Buffer A稀释定容,作为1号工作液(10μmol/L)。随后,精密取1号工作液0.1 mL、0.2mL、0.5mL、1mL、2mL和3号内标储备液1mL置同一个10mL量瓶中,用Buffer A稀释定容,作为2、3、4、5、6号工作溶液,浓度依次为0.1 μmol/L、0.2μmol/L、0.5μmol/L、1μmol/L、2 μmol/L的混合标准品溶液,其中内标液浓度均为1 μmol/L。按以上实验条件进样,每次进样20μL,测定混合标准氨基酸中各组分的峰面积,计算其与内标峰面积的比值,并拟合标准曲线回归方程。
1.2.4 精密度和准确度测定 配制浓度为0.5 μmol/L氨基酸混合标准品溶液5管,按标准曲线制备的方法处理,衍生后进样测定,计算日内精密度和回收率;以相同方法配制相同浓度的标准品5份,连续3d,按上述方法进行测定,计算日间精密度和回收率。
1.2.5 提取回收率 取0.4mL人工脑脊液(配置方法:每100mL蒸馏水含NaCl 730mg,KCl 10 mg,NaH2PO4·H2O 12.5mg,Na2HPO4·12H2O 71mg,MgCl2·6H2O 20mg,CaCl218mg,D-葡萄糖90mg,pH 7.3~7.5),加入50μL的3号混合标准储备液(0.3mmol/L)和50μL的3号内标储备液(0.3mmol/L),再加入1mL 的 HClO4(0.4 mol/L)去蛋白,混匀后,4℃条件下,3 000r/min低温离心15min,取上清液0.5mL,加入2mol/L K2CO3溶液1mL,再加入0.1mol/L K2CO3稀释至5mL,4℃条件下,14 000r/min低温离心20 min,取上清,4℃保存,衍生后,分别取20μL进样,计算提取回收率的4种氨基酸的浓度CX(μmol/L)。按下列公式计算提取回收率。回收率(%)=30 000CX/C0×100%,其中C0为3号混合标准储备液的浓度(0.3mmol/L)。
1.2.6 脑组织样品预处理 SD大鼠(中国科学院上海生命科学研究院实验动物中心提供)1只,体质量248g,快速断头取脑,放在冰盘上分离脑组织,留取海马组织,精密称质量后,加入0.8mL人工脑脊液,手动玻璃匀浆器冰浴匀浆,4℃条件下,3 000r/min低温离心15min,取上清液0.4mL,加入50 μL的3号混合标准储备液(0.3mmol/L)和50μL的3号内标储备液(0.3mmol/L)和1mL的HClO4(0.4mol/L)去蛋白,混匀后,4℃条件下,3 000r/min低温离心15min,取上清液0.5mL,加入2mol/L K2CO3溶液1mL,再加入0.1mol/L K2CO3稀释至5mL,4℃条件下,14 000r/min低温离心20min,取上清液,4℃保存,用前衍生后进样。
2 结 果
2.1 4种氨基酸的分离 4种氨基酸类神经递质在15min内均得以很好的分离,其保留时间分别为:Asp 3.60min,Glu 3.89min,Hse 7.45min,Tau 11.47min,γ-GABA 13.29min。各种氨基酸峰形良好,无重合、双峰、拖尾等现象。样品中的其他杂峰亦可与待测氨基酸完全分离。
2.2 线性范围和相关系数 系列浓度的混合氨基酸标准品(2~6号工作溶液)进行HPLC检测后,各峰面积与浓度间呈现良好线性关系。以各种氨基酸组分浓度(C)为横坐标,相应的峰面积(A)与内标峰面积(A0)的比值为纵坐标,进行回归,其浓度与峰面积呈良好线性关系,得到的回归方程式:y=ax+b。其中y为峰面积比值,a为斜率,x为各氨基酸的浓度,b为截距,相关系数r。见表1。
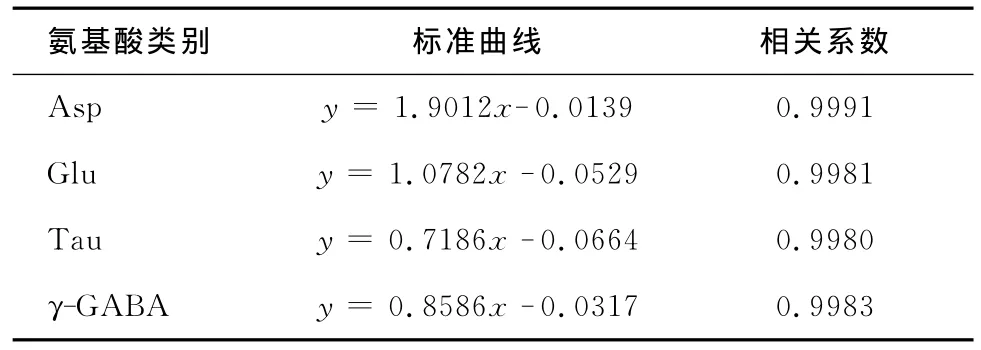
表1 各种氨基酸的标准曲线方程
2.3 精密度和准确度 在所建立的HPLC方法下,测定同一样品中4种氨基酸的精密度,结果显示其重现性较好,高、中、低3个标准溶液连续5次进样,Asp、Glu、Tau和γ-GABA峰面积与内标峰面积比值的日内和日间变异系数分别为0.61%~7.91%、4.78% ~6.26%、10.5% ~16.3% 和 0.27% ~10.98%,回收率分别为90.5%~111.3%、90.8%~101.5%、98.6%~101.9%和95.6%~104.4%。2.4 提取回收率试验 3个空白样品中添加低、中、高3个浓度水平的标准品完成,经过样品预处理方法进行处理后,对比检测量和实际量,多次测定Asp、Glu、Tau 和 γ-GABA 提 取 回 收 率 分 别 为91.1%~112.2%、82.7% ~99.3%、66.8% ~98.8%和86.2%~104.0%。
3 讨 论
本研究采用OPA柱前衍生,建立了一种高效液相-荧光检测技术,方法准确灵敏、重现性好,适合于脑组织样品中各种氨基酸的检测。本研究用的荧光衍生试剂纯度为80%,带入了一些干扰成分,虽然在本研究条件下,干扰成分不影响4种氨基酸的测定,但可考虑在以后的研究中换用更纯的试剂,以降低干扰。由于OPA试剂性质活泼,放置于空气中易氧化,因此在其保存液中加入β-巯基乙醇,对OPA具有保护作用,并将其保存于较低温度也可防止其氧化变质。此外,脑组织样品中也具有多种成分的干扰,本研究中采用60mmol/L磷酸盐浓度作为流动相添加剂,获得了较好的峰形和分离度。从图谱上可以看出,若样品中添加其他的氨基酸如组氨酸(6.12min)、甘氨酸(8.87min)等,其测定将一定程度上受到组织样品的干扰,后续研究将进一步观察流动相组成成分和比例,以期用于更多组分的检测。
[1] Kalra SP,Dube MG,Pu SY,et al.Interacting appetite-regulating pathways in the hypothalamic regulation of body weight[J].Endocrine Rev,1999,20(1):68-100.
[2] Sandlin ZD,Shou MS,Shackman JG,et al.Microfluidic electrophoresis chip coupled to microdialysis for in vivo monitoring of amino acid neurotransmitters[J].Anal Chem,2005,77(23):7702-7708.
[3] Cellar NA,Burns ST,Meiners JC,et al.Microfluidic chip for low-flow push-pull perfusion sampling in vivo with on-line analysis of amino acids[J].Anal Chem,2005,77(21):7067-7073.
[4] Huang KJ,Yu S,Li J,et al.Extraction of neurotransmitters from rat brain using graphene as a solid-phase sorbent,and their fluorescent detection by HPLC[J].Microchim Acta,2012,176(3-4):327-335.

