胃癌组织中microRNA-650的表达及其生物学作用和临床意义
霍守俊 薛锋 孔凡志 李芳 单远州* 周联明* 张学利*
(1.苏州大学,江苏苏州 215006;2.上海市奉贤区中心医院骨科,*普外科,上海 201400)
胃癌是全球高发的恶性肿瘤之一,胃癌患者的5年生存率仅约30%[1],目前胃癌的发病机制尚不清楚。本课题组在前期研究中首次发现miR-650在胃癌中表达异常升高,并初步探讨了miR-650在胃癌发生、发展及预后等方面的调控作用[2]。本研究旨在进一步探讨miR-650参与胃癌发生的相关机制。
1 资料与方法
1.1 胃癌细胞株及培养 KATO III、NUGC4、NCI-N87、SGC-7901及 MKN-45胃癌细胞株的培养条件如下:KATO III培养液为 ATCC-formulated Iscove's Modified Dulbecco's Medium(IMDM)培养基(内含20%胎牛血清);NUGC4、NCI-N87、SGC-7901及 MKN-45细胞株培养液均为RPMI-1640培养基(内含10%胎牛血清);细胞孵育环境为:37℃且含95%空气、5%CO2的培养箱。
1.2 临床资料 根据美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)胃癌临床实践指南(2003版)中收录的诊疗标准,共收集68例于2005年6月—2010年1月在上海市奉贤区中心医院就诊的胃癌患者,所有患者在确诊胃癌后,限期行标准胃癌根治术并辅助放化疗,全部患者至少随访2年以上。该项研究在征得患者及家属同意后签署知情同意书,并征得上海市奉贤区中心医院伦理委员会同意。
1.3 试剂及仪器 iTRAQ试剂盒(美国ABI公司),SYBR PCR试剂盒(日本TaKaRa公司),RNA提取试剂盒(德国 QIAGEN公司),IVIS Spectrum成像系统(美国冷泉港生物科技股份有限公司),LC-MS/MS系统(美国ABI公司)。
1.4 实验方法
1.4.1 实时定量RT-PCR 从冰冻胃癌组织及其配对正常组织中以及5株胃癌细胞株中提取总RNA,检测RNA纯度,在miR分子末端加polyA尾,选择Oligo dT引物,进行逆转录及PCR反应,记录每个反应管中的荧光信号到达所设定的域值时所经历的循环数即Ct值,以U6snRNA作为内参,以2-ΔΔCt表示胃癌组织中miR-650表达量相对于正常组织的变化倍数,其中ΔΔCt=(Ct-CtU6)癌-(Ct-CtU6)正常。肿瘤组织中 miR-650的表达量为正常组织表达量的3倍以上时为miR-650在胃癌组织中高水平表达。
1.4.2 慢病毒包装及滴度测定 按说明书制备编码慢病毒颗粒的重组病毒质粒及其两种辅助包装原件载体质粒,与Lipofectamine 2000混合后加入细胞培养瓶,置于CO2培养箱孵育,收集上清液,离心收集病毒浓缩液,分装后取其中1支进行病毒生物学滴度测定,其余置于-80℃保存。
1.4.3 miR-650模拟剂和抑制剂 合成成熟 miR-650的引物,序列如下:正向:5’-AGGAGGCAGCGCTCTCAGGAC-3’。反 向:5’-CGGGCGCGTT-TTTTTTTTTTT-TTGTCCTGAGAG-3’。 miR-650抑制剂-LNA寡核苷酸序列如下:5’-GTCCTGAGAGCGCTGCCTCCT-3’。以上序列与病毒基因组融合后,通过Lipofectamine 2000转染胃癌细胞株。
1.4.4 细胞增殖分析 SGC-7901及 NCI-N87胃癌细胞株在转染成熟miR-650序列及miR-650抑制剂-LNA寡核苷酸后,置于CO2培养箱孵育,分别于第1、2、3、4天加入CCK-8试剂后在分光光度计下检测450nm的吸光率。
1.4.5 细胞凋亡分析 SGC-7901及 NCI-N87胃癌细胞株在转染成熟miR-650序列及miR-650抑制剂-LNA寡核苷酸后,孵育、离心收集细胞,采用流式细胞仪检测细胞凋亡情况。
1.4.6 定量LC-MS∕ MS KATO III、NUGC4、NCI-N87、SGC-7901及 MKN-45胃癌细胞株在转染成熟 miR-650序列及 miR-650抑制剂后,利用RIPA裂解液裂解细胞,将5种蛋白样品分别进行还原和烷基化,经胰蛋白酶水解后,分别用不同的iTRAQ试剂进行标记,并将所有蛋白样品混合,通过LC-MS/MS系统进行蛋白质定量分析以筛选靶蛋白。
1.4.7 蛋白质印迹(Western blot) SGC-7901及NCI-N87胃癌细胞株在转染成熟miR-650序列及miR-650抑制剂-LNA寡核苷酸后,提取其细胞总蛋白,进行western blot分析靶蛋白表达情况。
1.4.8 裸鼠异种移植模型 用含编码绿色荧光蛋白基因的病毒转染SGC-7901及NCI-N87胃癌细胞株后放入CO2培养箱孵育,取20只BALB/C裸鼠,随机分为2组,每组10只,其中一组裸鼠腹腔注射SGC-7901细胞株,另一组裸鼠腹腔注射NCIN87细胞株,每周通过IVIS成像系统观察腹腔肿瘤情况及裸鼠生长情况,6周后处死并打开腹腔观察肿瘤大小、腹膜后淋巴结转移及肝转移情况。同时,另取20只BALB/C裸鼠随机分为2组,每组10只,其中一组裸鼠腹腔注射SGC-7901细胞株,另一组裸鼠腹腔注射NCI-N87细胞株。每组裸鼠标记5只,每天腹腔给予miR-650抑制剂;同组中另5只裸鼠作为对照组,每天观察肿瘤情况及裸鼠生长情况。
1.5 统计学处理 应用SPSS 17.0软件包进行统计学分析,数据以均数±标准差(¯x±s)表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 胃癌中miR-650表达水平与患者术后生存期密切相关 胃癌患者术后生存期长短与miR-650表达水平密切相关,而与性别、年龄、肿瘤位置、TNM分期、淋巴转移及远处转移等因素无相关性。见表1。
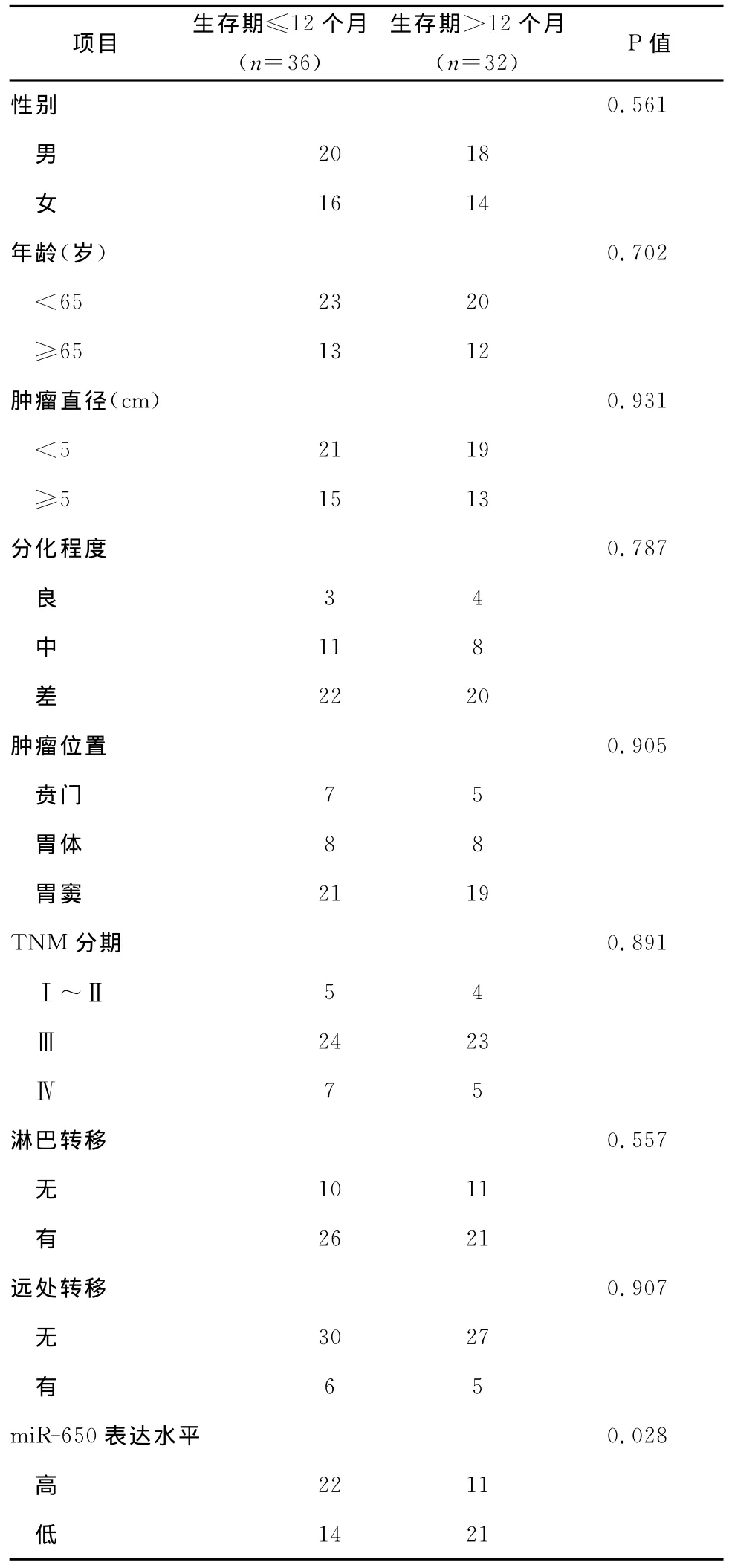
表1 胃癌患者预后相关因素分析
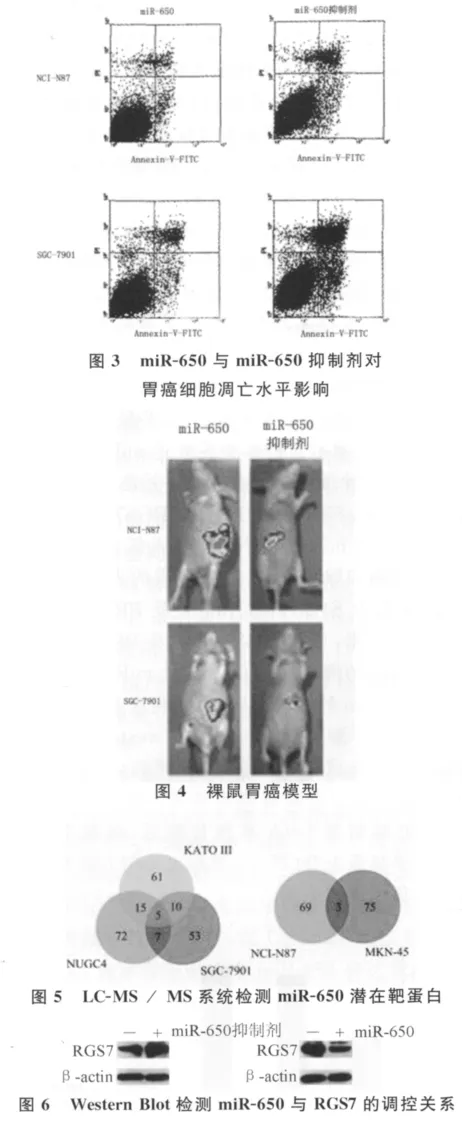
2.2 miR-650异常高表达可促进胃癌细胞增殖及转移并抑制其凋亡 5株胃癌细胞株中,KATO III、NUGC4及SGC-7901细胞株高水平表达miR-650,而NCI-N87及MKN-45细胞株则仅微量表达miR-650(图1)。细胞增殖分析结果显示:与转染了成熟miR-650序列的胃癌细胞株相反,当转染miR-650抑制剂-LNA寡核苷酸后,胃癌细胞株的增殖能力显著下降(图2)。流式细胞仪对凋亡水平检测显示,转染miR-650抑制剂后,胃癌细胞株凋亡数量显著增多(图3)。裸鼠异种移植模型结果同样提示,miR-650高表达可促进胃癌生长及转移;而抑制miR-650表达后,可抑制肿瘤生长并抑制其远处转移及淋巴转移(图4)。
2.3 RGS7蛋白是miR-650的下游靶点之一,并受到miR-650的负性调控 成熟 miR-650序列及miR-650抑制剂转染5株胃癌细胞株后,采用LCMS/MS系统蛋白定量分析。结果显示:miR-650抑制剂-LNA寡核苷酸转染高表达miR-650的3株细胞株后,5种蛋白质的表达水平始终增加,分别是MMP2前体、SERBP1,DLL4,RGS7和PRDX1。然而,将成熟miR-650序列转染入低表达miR-650的2株胃癌细胞后,有3种蛋白质的表达水平始终偏低,分别为S100PBP,RGS7及PRDX1(图5)。综合以上结果,可将RGS7蛋白及PRDX1蛋白视为miR-650的潜在靶蛋白。结合miR靶点预测软件-Targetscan的筛选结果,最终确定RGS7蛋白为miR-650的下游靶点之一。通过western blot进一步证实:转染成熟 miR-650序列后,胃癌细胞株RGS7蛋白表达量较对照组显著下降,而当转染了miR-650抑制剂-LNA寡核苷酸后,细胞中RGS7表达水平显著上升(图6),显示出miR-650对RGS7蛋白的负性调控关系。

3 讨 论
本研究发现,胃癌患者术后生存期长短与miR-650表达水平密切相关(P<0.05),但是,患者生存期与患者性别、年龄、肿瘤位置、TNM分期、淋巴转移及远处转移等因素无显著相关性,可能由于受到样本量及研究对象确定标准等因素的影响,故需进一步增加样本量、重新制定研究对象纳入标准及排除标准并改进研究方法后进行后续研究。
结合前期研究结果,我们假设:胃癌中miR-650的异常高表达通过促进胃癌细胞增殖及转移并抑制其凋亡来促进胃癌的进展,进而影响患者生存期及预后状况。为了验证以上推论正确性,我们设计一系列实验,研究结果提示:①抑制miR-650表达时胃癌细胞增殖能力受到抑制,而miR-650过表达后可促进胃癌细胞增殖;②抑制miR-650表达后可促进胃癌细胞的凋亡,反之,miR-650过表达可抑制胃癌细胞凋亡;③裸鼠胃癌异种移植模型结果同样提示:miR-650可促进胃癌细胞增殖及转移,而抑制其表达可抑制肿瘤生长并抑制远处转移及淋巴转移。以上实验结果与前期研究结果完全一致,但是仍不能明确miR-650下游除ING4以外的潜在靶点。我们综合应用LC-MS/MS系统以及Targetscan软件,最后确定RGS7为miR-650的下游靶点之一。RGS7属于RGS蛋白亚族,RGS7家族成员包括:RGS6、RGS7、RGS9及RGS11等,受G蛋白信号调控[3]。RGS7由3个不同的结构域组成:①RGS区域:该区域相对保守,约120个氨基酸,存在于几乎每个RGS家族成员结构中,通过结合Gα亚基促进GTP水解;②DEP区域:介导与膜锚定蛋白间相互作用;③GGL区域:与Gβ5亚基特异性结合,形成异二聚体调控视网膜细胞光反应、中枢神经元活动等过程[4]。为了探讨miR-650表达与RGS7表达之间的内在联系,我们通过western blot检测miR-650对RGS7表达量的影响,结果发现两者之间存在负性调控关系。
我们的研究结果初步提示,miR-650→RGS7及miR-650→ING4信号通路在胃癌形成过程中发挥作用,但胃癌的形成是一个多因素、多步骤相互作用、相互影响的复杂过程。随着对miR与胃癌关系研究的深入,将逐步明确miR是否可以作为用于胃癌的早期诊断、治疗及预后监测等的新型肿瘤标志物。
[1] Shi Y,Zhou Y.The role of surgery in the treatment of gastric cancer[J].J Surg Oncol,2010,101(8):687-692.
[2] Zhang X,Zhu W,Zhang J,et al.MicroRNA-650targets ING4 to promote gastric cancer tumorigenicity[J].Biochem Biophys Res Commun,2010,395(2):275-280.
[3] Dai J,Gu J,Lu C,et al.Genetic variations in the regulator of G-protein signaling genes are associated with survival in latestage non-small cell lung cancer[J].PLoS One,2011,6(6):e21120.
[4] Sandiford SL,Wang Q,Levay K,et al.Molecular organization of the complex between the muscarinic M3receptor and the regulator of G protein signaling,Gbeta(5)-RGS7[J].Biochemistry,2010,49(24):4998-5006.

