日粮与牛组织中稳定性碳同位素的相关性研究
孙丰梅,王慧文,石光雨,杨曙明
(1.河北北方学院食品科学系,河北 张家口075131;2.中国农业科学院农业质量标准与检测技术研究所,北京100081;3.河北北方学院牧业工程系,河北 张家口075131)
*随着社会经济的发展,人们生活水平的提高,我国人民的食物需求已从温饱型向小康型转变,消费类型从历史上的粮食为主变为肉、蛋、奶消费增加[1],随之而来的动物性食品特别是牛肉的食品安全问题成为人们日益关注的焦点。由于疯牛病、口蹄疫等人畜共患传染病的发生,消费者强烈要求获知动物性食品来源的真实信息。瑞士联邦公共卫生局调查显示,82%的消费者购买食品的主要依据是知晓食品的产地来源[2]。欧盟食品法规规定从2005年1月1日起在欧盟范围内销售的所有食品在生产、加工和流通的各个环节都能追溯[3]。为此,在牛肉生产中急需建立完整的追溯系统。
稳定同位素分析技术在过去的三十年间,已在食品生产的某些领域如蜂蜜、果汁、葡萄酒[4-6]等鉴别食品成分掺假和证实食品产地的真实性中得到成功应用,并且有些同位素分析方法已得到官方分析化学家协会(AOAC)及欧洲标准化委员会(CEN)的承认[7]。近年来,在追溯动物性食品的地理来源如牛乳、奶酪、黄油、牛羊肉[8-14]等,以及牛的饲料[15-17]成分中的应用增多,并且被认为是追溯产品产地的一种有效的、有潜力的方法。光合作用是植物将太阳能转化为化学能的过程,依据其光合作用的不同而分为C3植物、C4植物及CAM类植物,植物适应光环境作用的能力很大程度上决定了它的分布模式[18]。C3植物进化程度低,较为原始,主要分布在北方温带和寒带,而C4植物进化程度高,适宜生长温度较高,在南方热带和亚热带地区生长较多[19]。研究表明,日粮碳同位素组成不同,影响动物组织中的δ13C值,这主要依赖于C3、C4光合作用植物在饲料中所占的比例,因此动物组织中的δ13C值是反映其饲料的良好指示物[15]。Boner和Forstel[14]及Schmidt等[11]指出,牛肉粗蛋白质中的δ13C值可作为有机养殖的判断指标(主要是在北方的温带和寒温带),因为有机养殖的饲料主要是C3植物(牧草),而传统养殖主要是C4植物(玉米ZeaMays)。在牛肉需求量日益增长的今天,为了获得较高的日增重和日产奶量,过多的精饲料用于其中(主要为玉米),因此,越来越多的研究要求将稳定同位素方法作为一种定量技术来推断C3、C4植物成分在日粮中所占的比例[17]。
研究了日粮中C3和C4饲料组成不同时,牛不同组织中δ13C值的变化规律,以建立牛组织中δ13C值和膳食中C4植物比例间的剂量响应关系,为稳定同位素溯源技术在我国牛肉生产中的应用提供理论依据。
1 材料与方法
1.1 试验动物与试验设计
2007年11月,在北京金维福仁有限公司养殖场,选择体质健康、体重大小一致、年龄为12~14月龄的西门塔尔杂种公牛18头作为试验动物,随机分为6组,每组3个重复,每个重复1头牛。试验从11月20日正式开始,至2008年4月1日结束,所有试验用牛被屠宰。日粮配方分为两部分,一部分为基础日粮,一部分为C4植物部分,具体配比量见表1(干物质计)。在基础日粮的基础上分别添加0%,20%,40%,60%,80%和100%C4植物部分。按照配比量计算,1~6组的C4植物在整个日粮中所占比例分别为52.0%,61.6%,71.2%,80.8%,90.4%,100%。
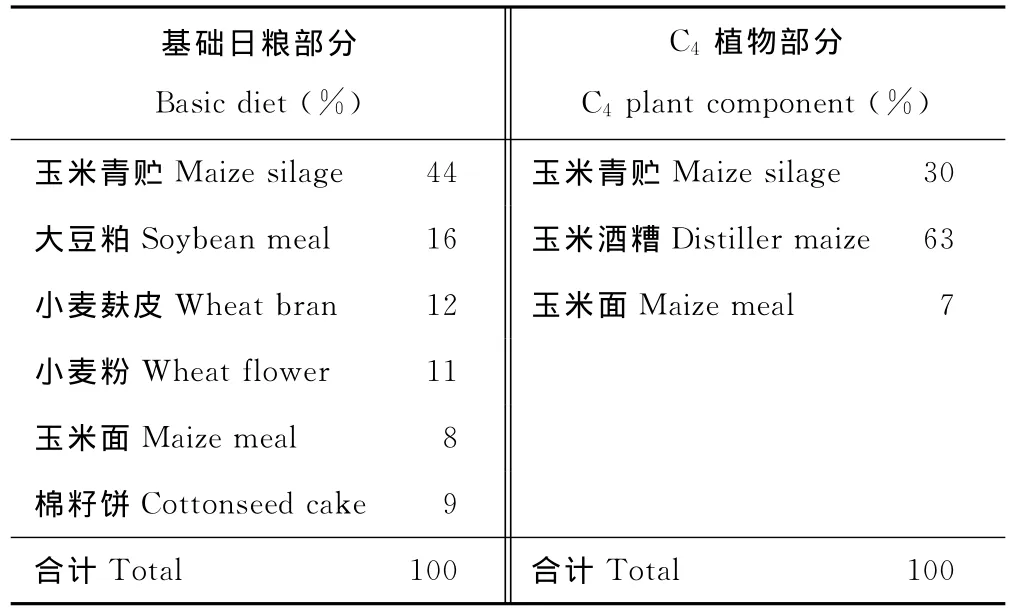
表1 日粮配方Table 1 Dietary formula
1.2 饲料样品
在试验过程中,分别采取各种饲料原料。将各种原料60℃烘干48 h,粉碎,粗饲料玉米青贮过0.177 mm筛,其他原料过0.149 mm筛。
1.3 牛尾毛样品
在试验开始前取每头牛的牛尾毛部分,试验结束时,在原来取牛尾毛的部位再取牛毛。参考Schwertl等[20],郭波莉等[21]及De Smet等[16]的处理方法。剪取靠近根部6 cm的牛尾毛样品,用去离子水浸泡清洗,在60℃恒温干燥12 h,用甲醇∶氯仿(2∶1)混合液浸泡2 h进行脱脂,用去离子水清洗、浸泡30 min,再用甲醇∶氯仿(2∶1)混合液浸泡2 h。最后用去离子水清洗,60℃烘干,剪成1~2 mm备用。试验结束时将整段牛尾毛处理作分析用。
1.4 牛肉及脂肪样品
屠宰时取牛后臀部肌肉500 g,至-20℃冰箱保存。取牛肉样品大约50 g用陶瓷刀切成厚2 mm的薄片,放至冷冻干燥机中干燥。样品完全干燥后,切碎,再用研钵充分研磨至粉末状。用滤纸包好后在索氏提取器中用无水乙醚提取6~8 h,收集脂肪至聚乙烯瓶中。滤纸包及聚乙烯瓶中的样品待乙醚充分挥发后,将脱脂干物质(主要为粗蛋白)过0.074 mm筛后转移至自封袋中,与粗脂肪样品保存在4℃冰箱,直至分析。
1.5 稳定性碳同位素测定
取大约1.0 mg样品,用锡箔杯包装好后通过自动采样器送到元素分析仪(Flash EA1112型)。在此样品中的碳元素转化为纯净的CO2气体,然后进入Thermal Finnigan DELTAPlusXL同位素质谱仪进行检测。
稳定同位素在自然界含量极低,用绝对量表达同位素的差异比较困难,因而国际上公认使用相对量来表示同位素的富集程度,计算公式为:
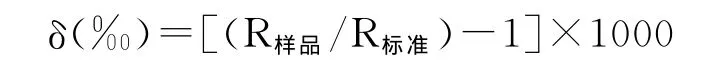
式中,R-重同位素与轻同位素丰度比,即13C/12C。国际通用的标准物质是美国南卡罗来纳州PeeDee建造中白垩系的拟箭石(PDB)。
1.6 数据处理
数据以平均数±标准差表示。利用SPSS软件作单因素方差分析的多项式比较,即作线性和二次分析。利用EXCEL软件作相关和回归分析。
2 结果与分析
2.1 饲料的δ13 C值
各 种饲料原料的δ13C值测定结果显示(表2),植物的光合作用方式不同,其δ13C值显著不同。现今植物界中90%的植物属于C3植物,δ13C值在-21‰~-32‰之间;C4植物的δ13C值较高,在-12‰~-19‰之间。玉米面、玉米酒糟、玉米青贮均属于典型的C4植物,其δ13C值较高;而大豆粕、棉籽饼、小麦麸和小麦粉为C3植物,其δ13C值在-25‰~-28‰之间。由于牛的饲料种类多,多为人工混合,又有秸杆和牧草等粗饲料,难免混合不均匀,因此对饲料原料分别取样,根据其在各组中所占的比例,按δF混合=δF1X1+δF2X2+……+δFnXn(δF,每种饲料的δ13C值;X,每种饲料所占的百分比例)计算每组混合饲料的δ13C值(表3)。通过计算,每组饲料的C4植物含量与其δ13C值呈高度相关(R2=1,P<0.01)。
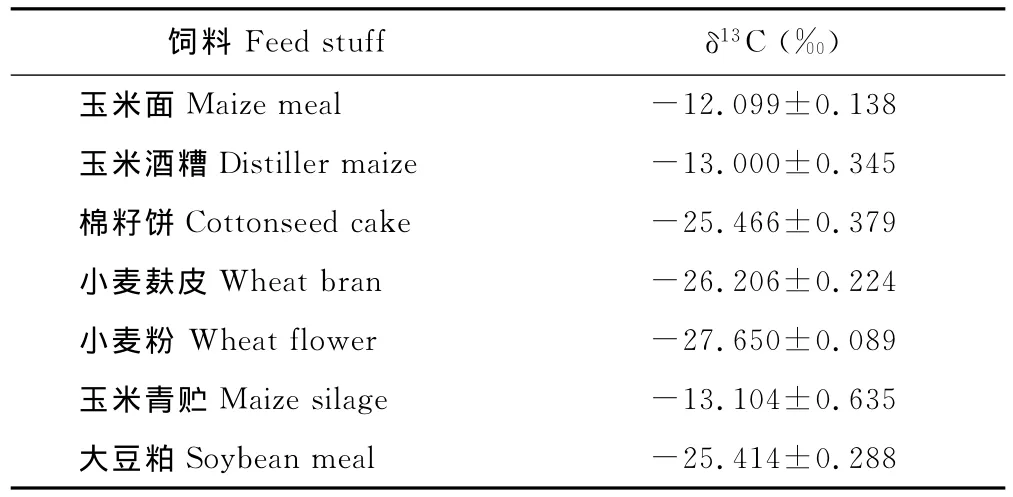
表2 各种饲料原料的δ13 C值Table 2 Theδ13 C values of feed material
2.2 试验开始与结束时牛尾毛中碳同位素的变化
试验开始及结束时,牛尾毛的δ13C值测定结果显示(图1,表3),试验前每组试验牛的δ13C值分散程度很高,变异系数范围在8.9%~23.1%;而当试验结束时,相应的每组牛的δ13C值趋于一致,变异系数均大大降低,其范围在0.89%~8.11%。刚购买来的牛因来源于不同地区,个体之间的碳同位素组成差异较大,给其喂养相同饲料,随着时间的推移,各组中不同个体的牛尾毛的碳同位素组成差异减小。由此可以推断,试验前随机分配到每组的牛,它们的饲料成分不相同,同时说明牛组织中碳同位素组成主要受饲料的影响,而个体对其的影响很小。

表3 饲喂不同含量的C4植物日粮时牛不同组织的δ13 C值Table 3 Theδ13 C values of cattle tissues in different C4 content
2.3 牛不同组织中碳同位素组成情况
试验结束时,随着C4植物含量在牛饲料中的比例增大,对应各组饲料的δ13C值也随之增大(表3)。牛尾毛、脱脂肌肉、粗脂肪中的δ13C值均随着C4植物比例的升高而逐渐增加,这种变化在牛尾毛中最为明显。进一步的方差分析结果表明,无论是在牛的哪一种组织中,各组之间的δ13C值差异均达到极显著水平(P<0.01)(表4),不仅如此,多项式比较结果显示,在3种牛组织中,6个处理组间δ13C值均存在着线性关系(P<0.01)(表4),但二次项比较结果均不存在关系(P>0.05)(表4),不同C4植物含量的处理组别中,牛组织的δ13C值存在显著差异,并在各组之间存在有线性关系。然而,在脱脂肌肉和粗脂肪中,δ13C值却出现了反常现象,即并不是每一组中的δ13C值都随着C4植物含量的增加而增加,如第5组脱脂肌肉和脂肪中的δ13C值反而高于第6组的,并且值比较接近,出现这一现象的原因可能是因为碳同位素在牛不同组织中的代谢更新速度不同造成的,碳同位素在牛尾毛中的更新速率最快,而肌肉和脂肪中则较慢。
2.4 牛组织中碳同位素组成与饲料的相关及回归分析
通过对牛尾毛、脱脂肌肉、粗脂肪中的δ13C值与饲料中C4植物百分含量所作的相关性分析可以看出,它们之间均呈极显著相关性(P<0.01)。牛尾毛中的δ13C值与饲料中C4植物百分含量相关性最高,相关系数为0.99;其次是脱脂肌肉,相关系数为0.96;而粗脂肪的相关性最低,但也达到了高度相关,相关系数为0.94。将饲料中C4植物百分含量与牛尾毛、脱脂肌肉、粗脂肪中的δ13C值分别作一元回归分析(图2),这些结果说明利用C4植物在饲料中所占的比例可以预测出牛组织中的δ13C值。同样地,也可用牛组织中的δ13C值估测饲料中C4植物所占的比例,其准确性增加的顺序依次为粗脂肪、脱脂肌肉、牛尾毛。在本研究中,如饲料中C4植物所占的比例变化10%(95%置信度水平下),δ13C值在牛尾毛、脱脂肌肉、粗脂肪中产生的变化分别为1.2‰~1.4‰,0.9‰~1.0‰,0.7‰~0.8‰。
2.5 牛尾毛与脱脂肌肉、粗脂肪中碳同位素的相关性
试验结束时每组中牛尾毛的δ13C值最高,脱脂牛肉次之,粗脂肪中的最低(表3,图3)。但三者之间的相关性达到极显著水平,脱脂牛肉与牛尾毛、粗脂肪的相关系数分别为0.904(P<0.001)(图3)和0.869(P<0.001),牛尾毛与牛肉粗脂肪的相关系数为0.814(P<0.001)。
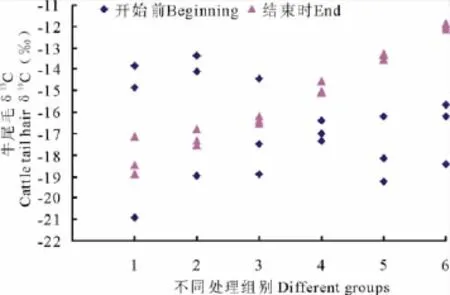
图1 各处理组试验前和结束时牛尾毛δ13 CFig.1 Theδ13 C value of cattle hair for each group in beginning and end

表4 牛不同组织中不同处理组别的δ13 C值多项式比较(线性和二次项分析)Table 4 Results of polynomial(linear and quadratic)forδ13 C values of different groups in cattle tissues
3 讨论
3.1 混合饲料的δ13 C值
青贮玉米营养价值高,气味芳香,柔软多汁,适口性好,是奶牛、肉牛一年四季特别是冬春季节的优良饲料[22],因此,在本试验设计中,C4植物部分使用了大量的青贮玉米,而C3植物则使用了麸皮、棉籽饼、大豆饼和小麦粉。因实际需要,在本次试验过程中,饲料中还添加有少量的食盐,小苏打及膨润土,三者在每组饲料中的比例仅为0.15%。郭波莉等[21]报道,牛组织中的碳同位素组成取决于主饲料成分,少量的浓缩饲料、添加剂等对其影响很小。因此此类添加剂对混和饲料的δ13C值影响忽略不计。
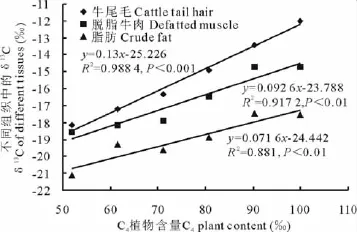
图2 牛不同组织中δ13 C与C4植物含量关系Fig.2 Relationship between the content of C4 plant andδ13 C value of different tissues
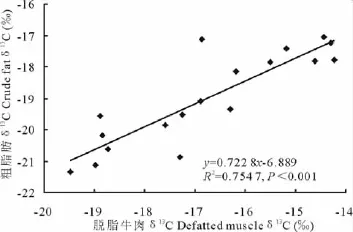
图3 脱脂牛肉与粗脂肪中δ13 C值相关关系Fig.3 Correlation ofδ13 C value between lipid-free muscle and lipid
3.2 牛不同组织中碳同位素组成与饲料的关系
食用相同饲料,同一品种的牛个体间δ13C值无差异,不同品种的个体间差异较小,饲料对牛各组织中δ13C值的影响远大于品种对其的影响[21]。本试验结果与此一致,随着时间的延长,同一品种饲喂同一饲料的牛个体间δ13C值差异逐渐减小。
牛组织中的δ13C值与其饲料密切相关。本试验中,牛尾毛、脱脂肌肉、粗脂肪与饲料中δ13C值、C4植物比例呈极显著相关性,这种关系有助于不同的养殖场用来推测C4植物在饲料中所占的比例。当脱脂肌肉中的δ13C值为-20‰时,认为屠宰前24周,牛饲料中至少含有50%的C4植物[14]。Bahar等[17]报道,脱脂牛肉与脂肪中的δ13C值与膳食中的碳含量呈高度相关。本研究结果与此一致。De Smet等[16]研究发现,牛屠宰后,不同组织如肾脏的脂肪、肝脏、血液、血浆和肌肉中的δ13C值与牛最后育肥阶段饲料的δ13C值呈高度正相关,相关系数变化范围在0.92~0.99。但牛毛样品与最后育肥阶段饲料中的δ13C值相关性未达到显著水平。他们所用的牛毛样品取自颈部,在试验开始前,在牛的颈部选取一部位剪掉其毛发,最后屠宰时,又在同一部位取其毛发。分析牛毛中的δ13C值与屠宰前最后阶段饲料中δ13C值的相关性,即在每一阶段更换饲料前,未重新剪掉毛发,而且在每一阶段,喂养牛的饲料有很大差异,造成牛毛中的δ13C值与饲料中的δ13C值相关性降低。造成这种结果的原因是,他们用整段牛毛样品来分析,前面两阶段长出的牛毛对检测结果会产生影响,使其与最后育肥阶段的饲料相关关系不明显[16]。牛尾毛主要由结构蛋白角蛋白构成,在生长过程中,角蛋白形成在皮下几毫米处,一旦角蛋白的结构确定,毛发组织的代谢就会停止,每段毛发记录的同位素信息为生长时的食物信息[20]。本研究中,在试验开始前,从根部剪掉了牛尾毛,整个试验期内,每组牛的饲料都未改变,因此试验结束时毛发中的δ13C值反映的就是当时的饲料信息。因此,在以牛尾毛作为试验样品时,应根据饲料改变时间和牛尾毛生长速度来确定取样段位。
3.3 牛尾毛与脱脂肌肉、粗脂肪中碳同位素组成关系
在每一组中,牛尾毛中的δ13C值最高,脱脂肌肉次之,粗脂肪中的最低,而且这三者之间有极显著的相关性,这与郭波莉等[21]的报道一致。并且在每一组中,δ13C值在牛尾毛中的变化均小于肌肉中的(表3),这似乎可以说明牛尾毛中的碳同位素更新速率高于肌肉中的。Bahar等[17]指出,单纯用一种组织中的δ13C值不足以用来估计牛饲料中的C4植物含量,原因是肌肉中的碳同位素更新率较慢,而脂肪组织相对更新较快。脂肪在合成过程中对13C有贫化作用,因此其δ13C值相对较低。但是从本研究的结果来看,似乎并不能说明脂肪中的碳同位素更新速率高于肌肉组织,这与Bahar等[17]的报道并不一致。
牛尾毛与其肌肉、脂肪组织中的δ13C值高度相关,这说明可用牛尾毛代替肌肉进行牛肉产地溯源的研究。根据资料报道,牛尾毛的最低生长速度为0.51 mm/d[23]。因此可根据牛育肥期的长短,从根部剪取合适的一段牛尾毛进行分析,即可反映牛育肥期的饲料信息,这样将使同位素溯源技术的应用更为简便。
4 结论
牛组织中碳同位素组成主要受饲料的影响,随着时间的延长,饲喂同一种饲料的牛个体间碳同位素组成差异减小。
牛尾毛、脱脂肌肉、粗脂肪中的δ13C值随着C4植物含量在牛饲料中的比例增大而升高,并且均与C4植物含量呈现极显著的相关性。用牛组织中的δ13C值可以预测食物中C4植物所占的比例。
牛尾毛、脱脂肌肉、粗脂肪中的δ13C值依次降低,三者之间相关性达到极显著水平。这说明各组织中碳同位素组成变化趋势一致,均可作为牛肉溯源的材料。
[1] 黄黔.我国食物供需格局变化和光温水资源战略配置[J].草业学报,2010,19(2):1-6.
[2] Franke B M,Gremaud G,Hadorn R,etal.Geographic origin of meat-elements of an analytical approach to its authentication[J].European Food Research and Technology,2005,221:493-503.
[4] Croft L R.Stable isotope mass spectrometry in honey analysis[J].Tr AC Trends in Analytical Chemistry,1987,6(8):206-209.
[5] Simpkins W A,Patel G,Harrison M,etal.Stable carbon isotope ratio analysis of Australian orange juices[J].Food Chemistry,2000,70:385-390.
[6] Roβmann A,Schmidt H L,Hermann A,etal.Multielement stable isotope ratio analysis of glycerol to determine its origin in wine[J].Zeitschrift fur Lebensmitteluntersuchung und-Forschung A,1998,207(3):404-411.
[7] Roβmann A.Determination of stable isotope ratios in food analysis[J].Food Reviews International,2001,17(3):347-381.
[8] Renou J P,Deponge C,Gachon P,etal.Characterization of animal products according to geographic origin and feeding diet using nuclear magnetic resonance and isotope ratio mass spectrometry:cow milk[J].Food Chemistry,2004,85:63-66.
[9] Manca G,Franco M A,Versini G,etal.Correlation between multielement stable isotope ratio and gepgraphical origin in peretta cows’milk cheese[J].American Dairy Science Association,2006,89:831-839.
[10] Rossmann A,Haberhauer G,Hlzl S,etal.The potential of multielement stable isotope analysis for regional origin assignment of butter[J].European Food Research and Technology,2000,211:32-40.
[11] Schmidt O,Quilter J M,Bahar B,etal.Inferring the origin and dietary history of beef from C,N and S stable isotope ratio analysis[J].Food Chemistry,2005,91:545-549.
[12] Piasentier E,Valusso R,Camin F.Stable isotope ratio analysis for authentication of lamb meat[J].Meat Science,2003,64:239-247.
[13] Camin F,Bontempo L,Heinrich K,etal.Multi-element(H,C,N,S)stable isotope characteristics of lamb meat from different European regions[J].Analytical and Bioanalytical Chemistry,2007,389(1):309-320.
[14] Boner M,Forstel H.Stable isotope variation as a tool to trace the authenticity of beef[J].Analytical and Bioanalytical Chemistry,2004,378:301-310.
[15] Gebbing T,Schellberg J,Kühbauch W.Switching from grass to maize changes the C isotope signature of meat and fat during fattening of steers[A].Lüscher A,Jeangros B,Kessler W,etal.In Proceedings of the 20th General Meeting of the European Grassland Federation[C].Luzern,Switzerland,2004:1130-1132.
[16] De Smet S,Balcaen A,Claeys E,etal.Stable carbon isotope analysis of different tissues of beef animals in relation to their diet[J].Rapid Communications in Mass Spectrometry,2004,18:1227-1232.
[17] Bahar B,Monahan F J,Moloney A P,etal.Alteration of the carbon and nitrogen stable isotope composition of beef by substitution of grass silage with maize silage[J].Rapid Communications in Mass Spectorometry,2005,19:1937-1942.
[18] 闫贵龙,曹春梅,刁其玉,等.日粮中C3、C4植物含量对牛肉品质和主要化学成分的影响[J].草业学报,2010,19(3):139-147.
[19] 莫凌,黄玉清,桂堂辉,等.5个热带禾本科牧草品种的光合-光响应特性研究[J].草业科学,2010,27(9):64-68.
[20] Schwertl M,Auerswald K,Schnyder H.Reconstruction of the isotope history of animal diets by hair segment analysis[J].Rapid Communications in Mass Spectorometry,2003,17:1312-1318.
[21] 郭波莉,魏益民,潘家荣,等.牛不同组织中稳定性碳同位素组成及变化规律研究[J].中国农业科学,2006,39(9):1885-1890.
[22] 徐敏云,李建国,谢帆,等.不同施肥处理对青贮玉米生长和产量的影响[J].草业学报,2010,19(3):245-250.
[23] Schwertl M,Auerswald K,Schufele R,etal.Carbon and nitrogen stable isotope composition of cattle hair:Ecological fingerprints of production system?[J].Agriculture,Ecological and Environment,2005,109:153-165.

