乙醇法制备1,3-丁二烯的研究进展
童 刘,刘宗章,张敏华*
(1.天津大学石油化工技术开发中心,天津 300072; 2.天津大学绿色合成与转化教育部重点实验室,天津 300072)
1,3-丁二烯(以下简称丁二烯)是重要的石油化工基础有机原料,工业用途十分广泛。由于是一种共轭二烯烃,它能进行取代、加成、环化、聚合反应以及和多种化合物共聚等,可用来合成多种有机化工产品。其中合成橡胶工业是丁二烯应用的最重要领域,其消费量占全球丁二烯消费总量的80%,主要用于丁苯橡胶、丁吡橡胶、氯丁橡胶、丁腈橡胶以及聚丁二烯橡胶等的合成。丁二烯在合成树脂中也有广泛的应用,可合成ABS树脂、K树脂、MRS树脂和热塑性弹性体SBS等。此外,少量的丁二烯还用作生产己二腈、己二胺、尼龙66、环丁砜、1,4-丁二醇以及己内酰胺等有机化工产品[1-4]。
近年来,随着生物乙醇技术的快速发展,乙醇来源丰富,可通过蔗糖、谷物和木薯等作物制得[5-7]。发展燃料乙醇以替代部分不可再生的能源,以乙醇为原料的制备多种工业产品都有了广泛的研究,如乙醇重整制氢,乙醇脱氢制乙醛、脱水制乙烯,羰基化制乙苯等[6-14]。乙醇法制备丁二烯就是石油工业发展以前生产丁二烯的主要方法,有重要的发展意义。本论文主要就乙醇法制丁二烯的工艺过程、催化剂研究状况等有关内容做详细介绍,并总结该工艺存在的主要问题以及提出可行的研究方向。
1 丁二烯的生产方法
工业上丁二烯的生产主要经历了不同时代的3种方法。二战时主要采用乙醇法,1944年以后改用石油气中的丁烷-丁烯馏分脱氢制取,1960年以后随着石油工业的发展,主要由乙烯副产抽提工艺提纯得到。脱氢法主要包括丁烷催化脱氢法、丁烯催化脱氢法以及丁烯氧化脱氢法。乙烯副产抽提法主要有乙腈(ACN)法、二甲基甲酰胺(DMF)法、N-甲基吡咯烷酮(NMP)法[15]。目前世界上约98%的丁二烯是采用乙烯裂解副产C4馏分的萃取精馏抽提工艺得到的,占据了当前全球丁二烯产能的主导地位。
乙醇法制取丁二烯是较为传统的方法,目前就其技术经济效益而言,相对乙烯副产抽提法还存在劣势。但是随着石油资源的日益紧张,石油价格的上涨,石油路线生产丁二烯的代价逐渐增大,尤其对于对外石油依存超过50%的我国,发展其他的丁二烯生产路线其重要性不言而喻。随着生物乙醇技术的快速发展,以可再生的乙醇为原料的工艺生产路线来生产丁二烯,会逐渐具有一定的竞争力。
2 乙醇法制备丁二烯
乙醇法是以乙醇为原料,在合适的催化剂作用下,发生脱氢脱水反应,制得丁二烯的过程。乙醇法制丁二烯主要分为一步法和两步法。
一步法以乙醇为原料,在1个反应器中,催化剂作用下,于一定温度下乙醇一步反应制得丁二烯。该过程反应表达式如下:
2C2H5OH→CH2CHCHCH2+H2↑+2H2O
一步法操作简单,设备投资较少,在东欧的一些国家实现了小规模生产。
两步法是由美国人奥斯卓米斯伦斯基在一步法的基础上发明的[16],首先在1个反应器中,乙醇在碱性催化剂(如铜基催化剂)催化作用下脱氢生成乙醛;在另1个反应器中,乙醛再与乙醇发生反应生成丁二烯。美国联碳公司在其工作基础上开发了相关的生产工艺过程,省去乙醇制乙醛的过程,以乙醇和乙醛为原料,在催化剂作用下,生产得到丁二烯。该过程反应表达式如下:
CH3CH2OH→CH3CHO+H2↑
CH3CH2OH+CH3CHO→CH2CHCHCH2+2H2O
乙醇法的一步法和两步法过程相比,各有优缺点,2种方法皆应用于工业化生产,并且各自发挥了重要的作用。一步法虽然存在产品纯度较低,产物分离较为困难的问题,但仅一步反应,设备投资较少,操作简单;两步法过程反应温度较低,耗能稍低,产品纯度较高,但是两步反应,过程较为复杂,设备投资较高。
3 乙醇法制备丁二烯的反应机理
乙醇在酸碱催化剂的作用下,主要发生脱水、脱氢以及耦合3类反应,通过这3类反应生成目标产物丁二烯,但其中具体的反应步骤,还存在一定争议。目前,关于乙醇制丁二烯的催化反应机理,主要有2种,一种是普林斯机理,另一种是醇醛缩合机理。
普林斯(Prins)机理:乙醇在碱性中心上脱氢生成乙醛,同时在酸性中心上分子内脱水生成乙烯,或者乙醇分子间脱水生成乙醚,乙醚再脱水生成2分子乙烯。乙烯与乙醛在酸中心上脱水生成丁二烯。
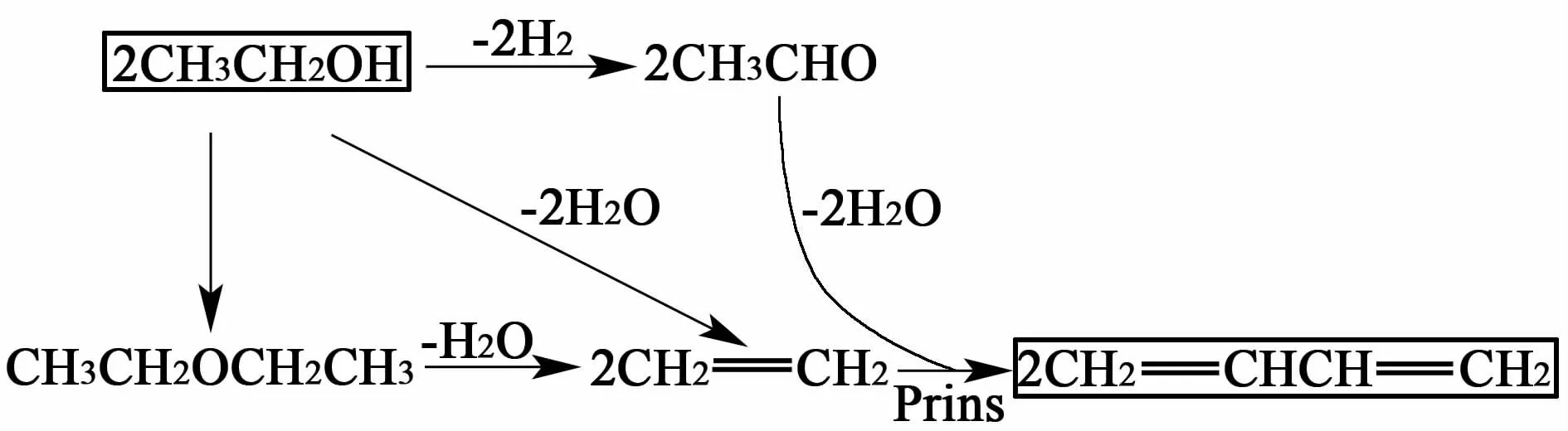
图1 普林斯机理Fig.1 Prins reaction mechanism
醇醛缩合(aldol condensation)机理:乙醇在碱性中心上脱氢生成乙醛,2个乙醛分子发生醇醛缩合反应生成丁间醇醛。丁间醇醛不稳定,在酸性中心上脱水生成丁烯醛,丁烯醛以乙醇为氢源,经氢转移反应生成丁烯醇,丁烯醇脱水即可生成丁二烯。可见乙醇参与了2次反应。
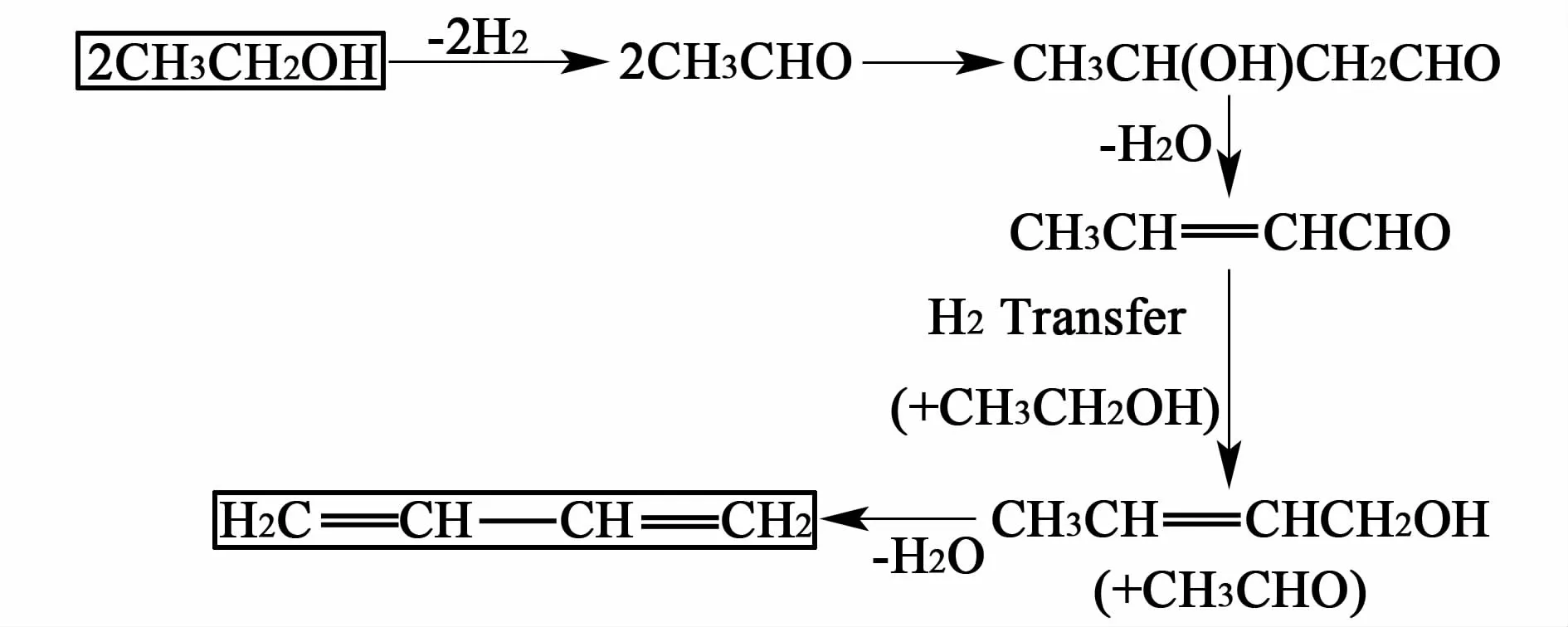
图2 醇醛缩合机理Fig.2 Aldol condensation reaction mechanism
对于醇醛缩合机理,也存在不同的观点。Bhattacharyya等[17]研究了乙醇在固定床上、m(Al2O3)∶m(ZnO)为60∶40的Al2O3/ZnO催化剂催化作用下丁二烯的生成机理。单独以乙醇进料时,对反应产物进行检测,认为丁烯醇可能并不是反应的中间产物,而是由丁烯醛直接生成丁二烯。
虽然乙醇制备丁二烯的反应机理还存在争议,但从2种机理的反应历程来看,乙醇生成丁二烯是一个复杂的反应过程,需要催化剂上酸碱中心的协同作用。由于乙醇在酸碱催化剂的催化作用下,会发生众多反应,乙醇在低温下脱水生成乙醚,乙醇脱氢生成乙醛,乙醛进一步耦合会生成醇醛、n-丁醇等。因此,乙醇法制丁二烯的反应产物中有多种副产物,主要有乙烯、乙醚、乙酸乙酯、丙酮和醇醛等。副产物的有效利用,也具有一定的可行性。
4 乙醇法制备丁二烯的催化剂研究
乙醇制丁二烯的反应过程,对催化剂的要求是同时具有酸性中心和碱性中心的双功能催化剂。氧化物催化剂作为典型的固体酸碱催化剂,通过改变氧化物的种类和配比以及采用不同的合成方法制备催化剂。总的来看,乙醇制丁二烯的催化剂主要是混合氧化物,一步法催化剂主要包括氧化镁/二氧化硅,海泡石,以及氧化锌/氧化铝等几种,两步法催化剂主要是氧化钽/氧化硅,氧化锌/氧化铝等。
4.1 一步法催化剂
4.1.1Al2O3/ZnO催化剂
20世纪60年代以前,乙醇制备丁二烯的研究主要是在于大量催化剂的比较筛选。Bhattacharyya等[18-19]对乙醇一步法制丁二烯的催化剂进行了大量的研究,对15种单一的氧化物、65种二元氧化物组合和40种三元氧化物组合进行了活性考察对乙醇一步法制丁二烯的催化剂进行了研究,对不同的氧化物组合进行了活性考察,比较后得出Al2O3/ZnO(质量比为60∶40) 是活性较高的催化剂,在催化剂用量20 g,反应温度425 ℃,以1 g催化剂为基准时,乙醇进料流率1.875 mL/h,进料乙醇的质量分数为99.36%,丁二烯的收率最大,可达到55.8%。此外,还对进料中乙醇浓度对丁二烯最终收率的影响进行了考察,发现进料中乙醇质量分数低于90%时,丁二烯的收率明显降低。
4.1.2MgO/SiO2催化剂
MgO/SiO2催化剂是应用于工业上的乙醇制备丁二烯的催化剂,丁二烯的收率在30%~40%之间。但是,催化剂的酸碱性质和选择性之间的关系并不明确。因此,80年代后期,一些学者对镁硅催化剂上的酸碱性质进行了相关研究。
Niiyama等[20]研究了硅镁催化剂上的酸碱性质与催化活性之间的关系,得出乙醇在硅镁催化剂上生成丁二烯的过程以及酸碱中心的各自的作用,MgO可以催化醇醛缩合反应,丁烯醛脱水生成丁二烯是发生酸中心上的反应。反应过程的速率控制步骤是碱催化的乙醇脱水反应,因此催化剂的催化活性随着碱性的增强而增强。当氧化镁的质量分数为85%时,酸碱性质最合适,催化活性最好。
Kvisle等[21]研究了硅镁催化剂上的乙醇制丁二烯的反应过程以及催化剂中氧化物各自的作用,尤其是反应过程中的表面中间物的性质以及可能存在的MgO/SiO2之间的相互作用。通过湿混法制备MgO/SiO2催化剂,机械混合制备了MgO+SiO2催化剂,通过比较MgO/SiO2、MgO+SiO2、MgO、SiO2的反应活性,由于湿混法制备的硅镁催化剂比机械混合制得的以及单纯的氧化物的催化剂效果要好,说明硅不仅是重要的组分,而且硅和镁之间还发生了相互作用。但是催化活性是否与催化剂的结构或者实际的Mg-O-Si之间的相互作用有关,还有待研究。
另外,后来的一些学者在镁硅催化剂上添加第3组分,研究了3组分氧化物催化剂对乙醇制备丁二烯的催化作用。Kitayama等[22]制备了镁硅镍三元氧化物催化剂。当MgO质量分数为31%时,反应温度为553 K,乙醇空速12.5 h-1,丁二烯的物质的量收率是53%。比表面积随着氧化镁的组分质量分数从0~25%在183~784 m2/g之间变化,31%的时候,开始明显下降。三元催化剂中形成了一种氢氧镁石的层状结构,这是催化剂形成较大比表面积的原因,镍离子进入了硅酸镁的晶架。乙烯的选择性很低,低于0.5%。将NH3和苯酚加入到催化剂中影响催化剂的活性,说明酸碱中心在反应中都扮演重要的角色,酸碱中心良好匹配的催化剂是有利于丁二烯的形成的。
Ohnishi等[23]在硅镁催化剂上添加碱性氧化物,对镁硅催化剂进行改性,在n(硅)∶n(镁)为1∶1的硅镁催化剂上浸渍负载了质量分数为0.1%的Na2O和K2O,尤其加入Na2O后,反应10 min内乙醇的转化率为100%,丁二烯的收率为87%,反应温度是350 ℃。说明了碱性氧化物对硅镁催化剂的碱性调节,在乙醇制丁二烯的反应中起到了很好的效果。
总的来看,镁硅催化剂是乙醇法制备丁二烯过程中研究较为深入的一种催化剂,氧化镁和氧化硅分别提供反应所需的酸碱中心,二者协同作用,酸中心上进行脱水反应,碱中心上发生脱氢反应。酸碱性质的研究虽然有一定的进展,但反应过程所需的酸碱类型,酸碱中心的数量也并不明确。氧化镁和氧化硅之间的相互作用也有待研究。
4.1.3海泡石催化剂
海泡石是一种具层链状结构的含水富镁硅酸盐黏土矿物,其标准晶体化学式为Mg8(H2O)4[Si6O16]2(OH)4·8H2O,其中SiO2质量分数一般在54%~60%之间,MgO质量分数多在21%~25%范围内。其具有比表面积大,吸附能力强等特点。海泡石是含有酸碱中心的双功能催化剂,因此应用于乙醇制备丁二烯的反应,前人也对其进行了一些研究。
Gruver等[24]研究了铝酸盐海泡石上乙醇的催化转化。采用KAlO2对纤维矿海泡石进行碱处理,得到铝化的海泡石,再进行银离子交换制得Ag-海泡石。将2种海泡石作为催化剂应用到乙醇催化转化反应中,反应条件是280 ℃,氦气气氛,乙醇进料压力是133 Pa,反应产物中乙醛的生成量不同。反应产物乙醛的选择性以及总的催化活性的增加,铝化的海泡石中引入银离子,使得催化体系产生了很好的双功能性,有利于丁二烯的生成。
Kitayama等[25]研究了海泡石上负载锰的催化剂对乙醇制丁二烯的催化作用。通过浸渍法将MnCl2负载到海泡石上,反应评价发现,与单纯的海泡石催化乙醇转化的主要产物是乙烯(乙烯选择性是96.8%)相比,负载锰的海泡石上,催化剂的选择性发生了变化,在反应温度为300 ℃,反应时间7 h,乙醇蒸汽的压力2 666 Pa下,丁二烯的收率达到33.4%,乙烯的收率下降到41.4%,说明负载锰调节了海泡石的酸碱性质,使得丁二烯的收率有所增加。
进入21世纪,学者也对催化剂中载体的作用进行了研究,以及合成类水滑石结构的催化剂应用于乙醇制备丁二烯的反应。
Mattew等[26]研究了硅载体上浸渍了二元或者三元金属氧化物对乙醇制丁二烯过程的催化作用。研究得出载体的酸性至关重要,但是酸性太强会导致副产物的增多;锌锆催化剂都是L酸性的,可以增加催化活性。进料乙醇中加入一定量的乙醛可以提高催化剂活性。通过浸渍法制备的锌锆硅催化剂,按物质的量之比为1∶1,质量分数1%负载在氧化硅上,在反应温度350 ℃,反应催化剂的用量1 g,乙醇进料流速为0.1 mL/min,载气流速为25 mL/min,丁二烯的选择性为47.9%,乙醇转化率为48.0%。
Matthew[27]以镁、铜、钙为2价氧化物,以铝、铬、铁为3价氧化物,采用共沉淀的方法制备了类水滑石结构的二元复合氧化物催化剂。类水滑石(LDHs)是一种具有层状结构、层间离子具有可交换性的一类化合物,其焙烧得到的金属氧化物(LDO)具有比表面较大、碱性较强等优点,能起到较好的催化效果[28-29]。当组分中含有60%~80%的氧化铝时,催化剂的丁二烯选择性最高。采用微量热法[30]对催化剂进行表征,发现较强的碱中心可以促进中间产物乙醛的生成。中间产物乙烯和乙醛的生成有利于丁二烯的形成。Marta等[31-32]对镁铝水滑石上的乙醇缩合反应进行了研究。不同的制备步骤得到的催化剂导致酸碱中心的分布不同,从而带来不同的反应活性。碱中心上进行脱水反应生成乙醛,乙醛在酸中心上氢转移反应生成不同的C4化合物:包括丁醛、1-丁醇、1,3-丁二烯和1-丁烯。通过调变酸碱性质,可以改变不同产物的选择性。
4.2 两步法催化剂
乙醇两步法制备丁二烯的过程是对一步法的优化,虽然该方法在工业生产上发挥了一定的作用,对其催化剂的筛选开展了研究。但是由于该过程是一步法的衍生,其重点集中于工艺条件探究,而较少地涉及催化剂的深入研究。
Corson等[33]对两步法催化剂的研究进行了概述。发现适合此过程较适宜的催化剂组合有:氧化钽/氧化硅,氧化铪/氧化硅,氧化铜/氧化钽/氧化硅,氧化锆/氧化硅等,并对其中催化活性较适宜的一些催化剂进行了工艺条件的优化,最终筛选出用于工业生产的催化剂,即Ta2O5/SiO2[m(Ta2O5)∶m(SiO2)为2∶98],进料中乙醇质量分数69%,乙醛质量分数24%,反应温度为350 ℃,液体空速0.4~0.6 h-1,丁二烯的最终收率为64%。并研究得出该催化剂中硅组分的作用是催化乙醛发生醇醛缩合反应生成丁烯醛,钽组分的作用是催化丁烯醛脱氧生成丁二烯。
Bhattacharyya等[34]对流化床上两步法过程的催化剂进行了筛选,考察了多种单一的氧化物以及二元氧化物组合的催化活性,比较后得出,在375 ℃下,以1 g催化剂为基准,乙醇进料流率是1 mL/h,n(乙醇)∶n(乙醛)的进料比是2.75∶1.00,AI2O3/ZnO(质量比为60:40) 是活性较高的催化剂,丁二烯的收率是43.8%。
5 存在问题及研究方向
总的来说,乙醇法制备丁二烯的催化剂研究,经历了从单纯的筛选到深入研究催化规律的过程,但是系统深入的研究其催化规律还是进行较少。反应过程中副反应较多、丁二烯收率较低的问题依然存在。概括起来,主要是以下2方面问题有待改进。
1) 从反应过程本身来说,乙醇制丁二烯的具体反应历程还存在模糊的地方,反应机理存在争议,而反应机理的掌握对催化剂的开发与优化至关重要。因此,利用现代的催化剂研究手段,先进的表征和评价方法,如原位红外、程序升温表面反应等,明确乙醇制丁二烯的反应机理,掌握催化剂的酸碱中心在每步反应中扮演的作用,对指导催化剂的开发与研制是有重要意义。
2) 从当前催化剂的状况来说,催化剂选择性较低,反应产物复杂,反应温度较高,耗能较大,催化剂容易积碳失活,对原料乙醇的浓度要求较高。针对这些问题,可采取的措施主要有:寻找新的催化剂材料,开发新型的酸碱性质合适的双功能催化剂,提高丁二烯的选择性,如杂多酸催化剂、分子筛催化剂等,通过添加碱性催化剂材料,调节整体的酸碱性质,以达到适合的酸碱性质,是可行的;开发适合低浓度乙醇反应的催化剂,采用低浓度乙醇为原料催化制取丁二烯,从而减少低浓度乙醇浓缩带来的能源消耗和相应的设备投资。
值得注意的是,Sun等[35]设计和制备纳米ZnxZryOz复合氧化物,用于生物乙醇高效的合成异丁烯。将ZnO加入到ZrO2中,可以选择性的钝化ZrO2上的强L酸中心和减弱B酸中心。当ZnO 和ZrO2按照一定的配比(x为1,y为10),以炭黑为硬化模板的方法制备纳米ZnxZryOz复合氧化物催化剂,获得了提供乙醇制备异丁烯所需的平衡的酸碱性质的酸碱双功能催化剂,实现了对副反应乙醇脱水以及丙酮聚合的抑制,提高异丁烯的选择性,其最终收率可达到83%。乙醇制1,3-丁二烯的反应是类似于乙醇制异丁烯的,都经历复杂的反应过程,都需要具有酸碱双功能性的催化剂,酸碱中心协同作用。因此,借鉴其研究方法和思路,对乙醇法制备1,3-丁二烯的研究是具有指导意义的。
对于乙醇制备丁二烯的催化过程研究,现阶段主要侧重对反应机理的研究,通过反应历程的明确,探求每步反应合适的催化剂的酸碱性质,寻找酸碱性质与催化剂选择性之间的关系。然后结合新型催化剂材料的开发和制备方法的进步,开发适合反应所需催化剂,从而达到提高丁二烯的收率的目的。
6 结语
我国生物质资源丰富,生物乙醇技术较为成熟,以秸秆等为原料的纤维素、半纤维素、木质素等制乙醇的技术也在快速的发展[36-38],势必会带来乙醇原料成本的降低。因此,在能源日趋紧张的局势下,有效发挥国内生物质资源优势,通过生物乙醇来制备丁二烯,补充或替代石油裂解制得的丁二烯,是可行的。但要想实现大规模工业化生产,还有很多工作要做,开发新的高效的酸碱双功能催化剂,完善乙醇法制丁二烯的生产路线,建立成套的、具有一定经济效益和环境效益的生产工艺,走出一条可持续发展的绿色化工路线,这对缓解石油资源不断消耗带来的压力具有重要意义。
参考文献:
[1]李玉芳,李明.丁二烯技术生产技术进展与市场分析[J].化学工业,2007,25(12):24-33
[2]张伦,马忠龙.丁二烯路线制己内酰胺技术研究进展[J].化学工业与工程,2004,21(1):48-52
[3]GRUB J,LÖSER E.Butadiene[M]//Ullmann’s Encyclopedia of Industrial Chemistry,Weinheim:Wiley-VCH Verlag GmbH & Co KGaA,2000
[4]杨学萍.丁二烯生产技术及化工利用新途径的开发[J].精细石油化工进展,2003,4(5):7-11
[5]SANCHEZ O J,CARDONA C A.Trends in biotechnological production of fuel ethanol from different feedstocks[J].Bioresource Technology,2008,99:5 270-5 295
[6]BALAT M,BALAT H.Recent trends in global production and utilization of bio-ethanol fuel[J].Applied Energy,2009,86:2 273-2 282
[7]BALAT M,BALAT H,CAHIDE O Z.Progress in bio-ethanol processing[J].Progress in Energy and Combustion Science,2008,34:551-573
[8]GRAY K A,ZHAO L,EMPTAGE M.Bioethanol[J].Current Opinion in Chemical Biology,2006,10:141-146
[9]GOLDEMBERG J.Ethanol for a sustainable energy future[J].Science,2007,315:808-810
[10]MENG N,LEUNG D Y C,LEUNG M K H.A review on reforming bio-ethanol for hydrogen production[J].International Journal of Hydrogen Energy,2007,32:3 238-3 247
[11]CHANG F,YANG H,ROSELIN L S,etal.Ethanol dehydrogenation over copper catalysts on rice husk ash prepared by ion exchange[J].Applied Catalysis A:General,2006,304:30-39
[12]张悦.乙醇催化脱氢合成乙醛Cu/SiO2催化剂的研究[D].天津:天津大学,2007
[13]BRASKEM S A,C TECNOLOGIA I B,TRIUNFO R S,etal.Bio-ethanol based ethylene[J].Journal of Macromolecular Science,Part C:Polymer Reviews,2009,49:79-84
[14]VIJAYARAGHAVAN V R.Ethylation of benzene with ethanol over substituted large pore aluminophosphate-based molecular sieves[J].Journal of Molecular Catalysis A:Chemical,2004,207:41-50
[15]张爱民.丁二烯抽提技术的比较和分析[J].石油化工,2006,35(10):907-918
[16]WANG Z.Ostromislensky Process.Comprehensive Organic Name Reactions and Reagents[M].Wiley-Blackwell,2010
[17]BHATTACHARYYA S K,SANYA S K.Kinetic study on the mechanism of the catalytic conversion of ethanol to butadiene[J].Journal of Catalysis,1967(7):152-158
[18]BHATTACHARYYA S K,GANGULY N D.One-step catalytic conversion of ethanol to butadiene in the fixed bed I.Single-oxide catalysts[J].J Appl Chem,1962,12:97-104
[19]BHATTACHARYYA S K,GANGULY N D.One-step catalytic conversion of ethanol to butadiene in the fixed bed I.Binary-and ternary-oxide catalysts[J].J Appl Chem,1962,12(3):105-110
[20]NIIYAMA H,MORII S,ECHIGOYA E.Butadiene formation from ethanol over silica-magnesia catalysts[J].Bulletin of the Chemical Society of Japan,1972,45:655-659
[21]KVISLE A A,SNEEDEN R P A.Transformation of ethanol into 1,3-butadiene over magnesium oxide/silica catalysts[J].Applied Catalysis,1988,43:117-131
[22]KITAYAMA Y,SATOH M,KODAMA T.Preparation of large surface area nickel magnesium silicate and its catalytic activity for conversion of ethanol into buta-1,3-diene[J].Catalysis Letters,1996,36:95-97
[23]OHNISHI R,AKIMOTO T,TANABE K.Pronounced catalytic activity and selectivity of MgO-SiO2-Na2O for synthesis of buta-1,3-diene from ethanol[J].J Chem Soc Chem Commum,1985,22:1 613-1 614
[24]GRUVER V,SUN A,FRIPIAT J J.Catalytic properties of aluminated sepiolite in ethanol conversion [J].Catalysis Letters,1995,34:359-364
[25]KITAYAMA Y,MICHISHITA A. Catalytic activity of fibrous clay mineral sepiolite for butadiene formation from ethanol[J].J C S Chem Comm,1981:401-402
[26]MATTHEW D,CALLUM G,CALRLO D,etal.Investigation into the conversion of ethanol into 1,3-butadiene[J].Catal Sci Technol,2011,1:267-272
[27]MATTHEW R.Production of 1,3-butadiene from ethanol over mixed oxide catalysts[D].USA:University of Missouri-Columbia,2005
[28]PRIKHOD’KO R V,SYCHEV M V,ASTRELIN I M,etal.Synthesis and structural transformations of hydrotalcite-like materials Mg-Al and Zn-Al[J].Russian Journal of Applied Chemistry,2001,74(10):1 621-1 626
[29]杨小丽,杨金香.类水滑石化合物的制备及应用[J].化工中间体,2010,1:7-11
[30]屠迈,李大塘,沈俭一,等.微量吸附量热法研究氧化物催化剂的酸碱性质[J].高等学校化学学报,1998,6:946-949
[31]MARTA L,EVA D,SALVADOR O.Ethanol catalytic condensation over Mg-Al mixed oxides derived from hydrotalcites[J].Catalysis Today,2011,164:436-442
[32]MARTA L,EVA D,AURELIO V,etal. Consequences of the iron-aluminium exchange on the performance of hydrotalcite-derived mixed oxides for ethanol condensation[J].Applied Catalysis B:Environmental,2011,102:590-599
[33]CORSON B B,JONES H E. Butadiene from ethyl alcohol[J].Industrial and Engineering Chemistry,1950,42:359-373
[34]BHATTACHARYYA S K,AVASITHI B N.Catalytic conversion of ethanol to butadiene by two-step process in fluidized bed[J].J Appl Chem,1966,16:239-244
[35]SUN J,ZHU K,GAO F,etal.Direct conversion of bio-ethanol to isobutene on nanosized ZnxZryOzmixed oxides with balanced acid base sites[J].J Am Chem Soc,2011,133:11 096-11 099
[36]赵彩云,王异静,关东明.纤维素乙醇研究进展[J].酿酒科技,2009,10:87-90
[37]MARGEOT A,HAHN-HAGERDAL B,EDLUND M.New improvements for lignocellulosic ethanol[J].Current Opinion in Biotechnology,2009,20:372-380

