西仑吉肽的合成制备
孔 毅,黄 海,赖伊丽,黄世龙,刘会敏
(中国药科大学生命科学与技术学院,江苏 南京 210009)
西仑吉肽(cilengitide,EMD- 121974)是德国化学家Kessler设计的含有RGD序列的环肽c[RGDf(N-Me)V]。该肽基于体内αvβ3整合素配体,通过综合运用环化、空间筛选和甲基化扫描而得,对αvβ3整合素具有高亲和性和选择性[1]。临床试验表明,该肽不仅能较好抑制黑色素瘤和胶质细胞瘤生长,而且与放射治疗配合能提高其他肿瘤如头颈鳞状细胞瘤的治愈率[2],具有较好的市场前景和潜力。
除西仑吉肽发明者提供合成方法外[1],目前尚未见西仑吉肽合成工艺细节研究的报道。本研究尝试对西仑吉肽合成方法进行优化,采用Fmoc固相合成与液相合成相结合的方法,以HBTU,PyBOP/HOBt为缩合剂,对合成方法特别是难以缩合的氨基酸的缩合方法进行了研究,对环化条件进行了探索。本方法合成效率高、原料易得、路线简单易行、具有一定的工业化应用前景。

图1 西仑吉肽分子结构式[1]Fig.1 The molecular structure of cilengitide[1]
1 材料与方法
1.1 仪器与设备
砂芯玻璃管,4号砂芯;循环水式真空泵,予华SHZ-DⅢ,河南巩义予华仪器有限公司;紫外-可见分光光度计,752,上海菁华科技仪器有限公司;半制备型高效液相色谱仪,BioLogic DuoFlow Pathfinder 20/80 System,美国Bio-RAD;高效液相色谱仪,岛津20A;冻干机,Labconco;质谱仪,岛津2010MS。
1.2 材料与试剂
2-CTC树脂,载量为0.9 mmol/g;9-芴甲氧基羰基(Fmoc)-氨基酸[Fmoc-Arg(Mtr)-OH;Fmoc-Gly-OH;Fmoc-(Otbu-)Asp-OH;Fmoc-D-Phe-OH;Fmoc-(N-Me-)Val-OH];苯并三氮唑-N,N,N’,N’-四甲基脲六氟磷酸酯(HBTU);六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷(PyBOP);1-羟基苯丙三氮唑(HOBT);N, N-二异丙基乙胺(DIEA) ;乙二硫醇(EDT);三异丙基硅烷(TIS),均为上海吉尔生化公司产品。二氯甲烷(DCM);无水甲醇;无水乙醇;无水乙醚;三氟乙酸(TFA);六氢吡啶(哌啶,PIP);N, N-二甲基甲酰胺(DMF);茚三酮;均为国产分析纯。乙腈,美国TEDIA,色谱纯;纯净水,乐百氏牌。
1.3 方法
1.3.1树脂溶胀
称取2 g 2-CTC树脂于烧杯中,用20 mL DMF浸泡30 min后倒出约一半体积DMF,加入10 mL DCM浸泡30 min,用DMF洗涤树脂2~3次后,用真空泵将树脂抽滤干。
1.3.2线性肽的合成
1)首个氨基酸上载:称取Fmoc-Arg(Mtr)-OH 4.16 g溶于10 mLDMF,再加入DIEA 2 mL,溶解完全后与树脂混合均匀,通氮气室温25 ℃下搅拌反应2 h;取少量于EP管中,加20%(体积比)PIP/DMF脱保护5 min,茚三酮法(Kaiser法)[3]定性检测反应进行的程度,判断各步接肽的终点,反应结束后,加入2 mL甲醇,继续反应0.5 h后,抽滤掉反应液后。以DMF洗涤2次后,再以DMF,无水甲醇交替洗涤2次。真空干燥称重测肽树脂担载率,mmol/g。
2)脱保护:加入30 mL 20%PIP/DMF浸没肽树脂,氮气搅拌,分别经过5和15 min的2次脱保护后,茚三酮法检测,反应完全后抽滤掉反应液,DMF洗涤树脂3~4次,抽干。
3)上载下一个氨基酸:称取Fmoc-(N-Me-)Val-OH 1.20 g 溶于适量DMF,再加入HBTU 1.29 g,HOBt 0.5 g,DIEA 1 mL溶解完全后与肽树脂混合均匀,通氮气室温25 ℃下搅拌反应2 h;茚三酮法检测,反应完全后抽滤掉反应液,DMF洗涤3~4次。Fmoc-(N-Me-)Val-OH为困难氨基酸,单纯使用HBTU不能完全缩合,尝试改用缩合剂PyBOP和延长反应时间来完成缩合。
4)上载其他3个氨基酸:重复2)和3),把剩下的Fmoc-D-Phe-OH、Fmoc-(Otbu-)Asp-OH和Fmoc-Gly-OH依次接到肽树脂上。
1.3.3Fmoc法[4]测定连接效率
称取Fmoc-Gly-OH(相对分子质量:339.4)5 mg置于小玻璃瓶,加1 mL体积分数为20%的PIP/DMF,脱保护30 min,无水甲醇定容至100 mL;再稀释10倍后, 依次取1、2、3、5、6 和 7 mL置于10 mL容量瓶中,无水甲醇定容,分别与空白即体积分数为20%的PIP/DMF对照,测301 nm的紫外吸收值。利用标准曲线计算肽树脂的缩合效率。
1.3.4肽树脂切割与肽沉淀
在树脂上将线性肽合成完成后,用DMF洗涤3次,甲醇洗涤1次,DMF 洗涤1次,甲醇洗涤1次后真空干燥后,称重,按1 g肽树脂5 mL裂解液TFA/DMF(体积比5∶95)的比例加入裂解液,冰浴搅拌反应2 h。然后将裂解液抽滤,并用少量裂解液冲洗树脂2~3次,冲洗液和裂解液收集到一起。加无水乙醚沉淀得到线性肽粗品,HPLC/MS分析。
1.3.5环肽的合成
线性肽粗品0.85 g溶解于2 000 mL DCM中,加入PyBOP 1.52 g,HOBt 0.4 g,和DIEA 1.2 mL,冰浴搅拌反应24 h。将反应液减压旋蒸至约20 mL。分别用10%HCl/H2O(体积比),饱和NaHCO3,饱和NaCl依次萃取后,加入等体积裂解液TFA∶TIS∶EDT∶H2O为95∶2∶2∶1冰浴反应2 h。无水乙醚沉淀得环肽粗品。
1.3.6环肽的分离纯化和鉴定
用高效液相色谱(HPLC)分析环肽粗品,液相色谱条件: Kromasil C18(4.6 mm×250 mm) 色谱柱; 波长λ为214 nm; 流动相,A为纯净水∶乙腈∶TFA为90.0∶10.0∶0.1 (体积比), B为乙腈∶纯净水∶TFA为90.0∶10.0∶0.1 (体积比);进样量10 μL; 流速1 mL/min。经MS分析确定主峰与目标肽相对分子质量一致后,用制备型高效液相色谱(HPLC)纯化环肽粗品后,冷冻干燥。纯化后的环肽用分析HPLC检测纯度,并用质谱与核磁共振研究其结构。
2 结果与分析
2.1 树脂的选择
选择2-CTC树脂(分子式见图2, P表示树脂珠),因为一方面,与其他树脂相比,2-CTC树脂具有很强的活性;氨基酸羧基端与2-CTC树脂的反应为取代反应,是不可逆反应。另一方面,由于2-CTC树脂反应位点附近位阻较大,大大减少了二肽时由于分子内环化生成哌嗪二酮(DKP)[5]的可能性。

图2 二氯树脂Fig.2 2-CTC resin
2.2 接肽反应
普通氨基酸用HBTU的缩合效率达到95%以上;N-甲基氨基酸属于困难氨基酸,其反应活性很低,为提高共缩合效率,分别考察HBTU和PyBOP在不同时间2,4,6,8,10 h的缩合效率,结果如图3。

图3 HBTU和PyBOP反应进度图Fig.3 The extent of reaction with HBTU & PyBOP
确定8 h为最适宜反应时间后,考虑到HBTU有一定的缩合效率,而PyBOP虽然缩合效率高但价格较贵,于是采用HBTU和PyBOP以一定比例混合使用,分别以HBTU∶PyBOP(体积比)为1∶2,1∶1,2∶1,3∶1考察缩合效率,试验结果显示2∶1为最适宜配比。
2.3 α-氨基保护集基团的脱除
在每一步接肽反应完成后, 下一个氨基酸接入之前, 需要除去保护基团。本次试验采用的是PIP/DMF的溶液,基团的脱除效果与哌啶的含量及其脱除时间关系见图4。
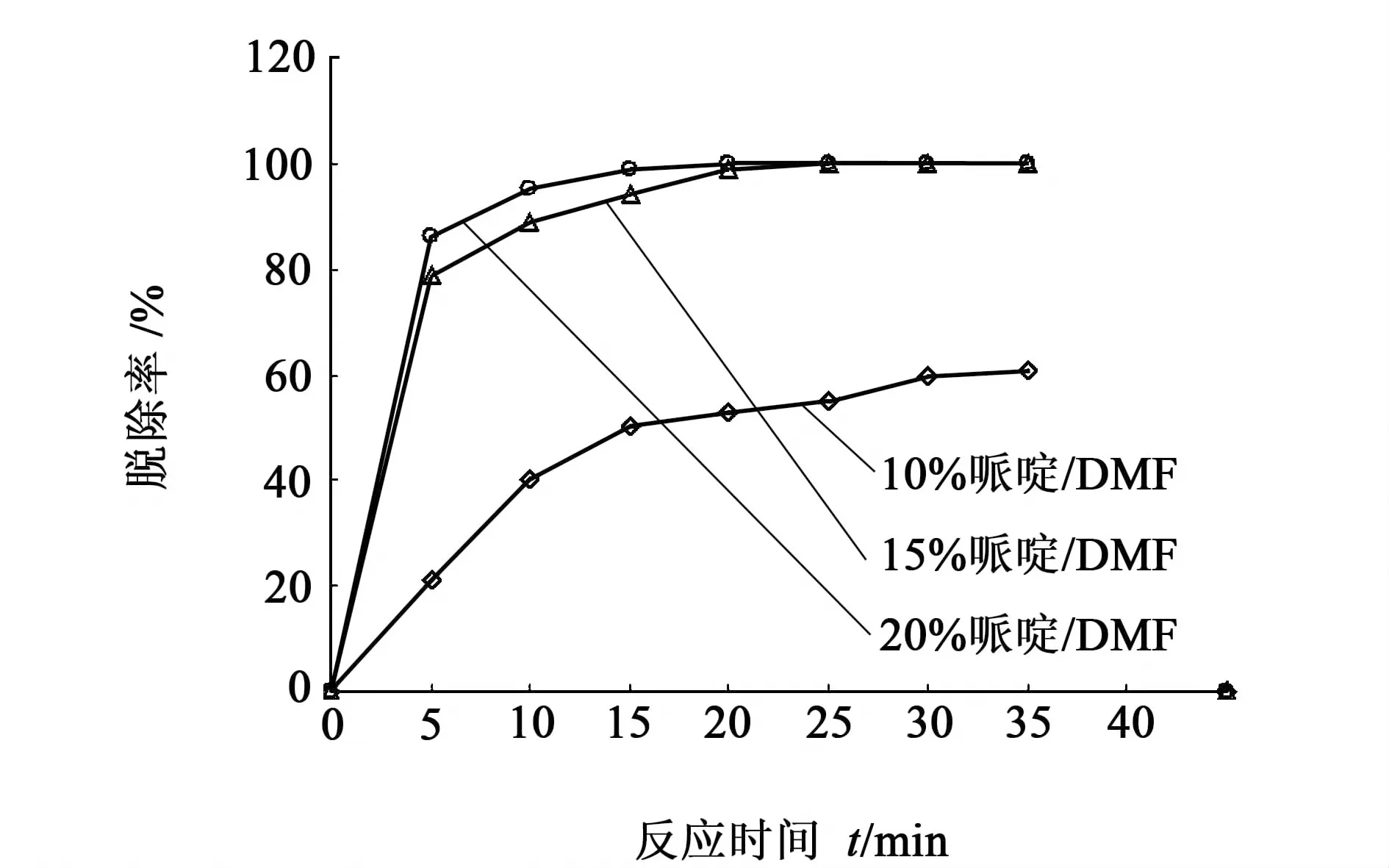
图4 不同浓度哌啶Fmoc脱除率Fig.4 The Fmoc deprotection ratio of piperidine at different concentration
图4可以看出,随着哌啶浓度的增加,脱保护率增加且脱保护的时间缩短。使用20%浓度的保护试剂在10 min时脱保护效率可达99%。
2.4 线性肽粗品HPLC和MS结果分析
线性肽粗品HPLC和MS分析结果见图5和图6。色谱条件:流动相A为乙腈/水(10%,含0.1 %TFA ,体积分数,下同),B为乙腈/水(90%,含0.1% TFA),梯度洗脱0~30 min,20%~40% B。紫外检测器,波长范围为214 nm;色谱柱为Kromasil C18,规格为4.6×250 mm,流速为0.2 mL/min。样品进样量为10 μL 。
质谱条件:离子检测方式SCAN,离子极性正离子,离子化方式为电喷雾离子化,检测电压1.5 kV,雾化气体流速1.5 L/min;曲线脱溶剂装置(CDL)温度250 ℃,加热块(block)温度200 ℃。

图5 线性肽粗品HPLC图Fig.5 The HPLC of the crude linear cilengitide

图6 线性肽粗品主峰质谱图Fig.6 The MS of the crude linear cilengitide
2.5 环化方法的选择
一般环肽按照成环所含键分为2类:全部为酰胺键的均环肽为一类,除酰胺键外还有二硫键和醚键等的杂环肽为另一类。而按照桥连位置分的话,分为头尾相连环肽、头侧相连环肽、侧侧相连环肽。其中头尾相连合成难度最大,因为线性肽分子趋于能量较低的稳定形态,也就是舒展的状态。这样分子的反应位点,即两端的羧基和氨基空间相距较远,靠近的可能性较低,反应活性降低。
液相合成环肽,其中发生的反应主要是分子内的反应和分子间的反应。为了减少副反应分子间反应形成的多聚体,应该尽量将肽反应浓度降低,一般控制在10-3~10-4mol/L高度稀释的溶液里反应。常用的液相合成法有:活泼酯法、叠氮法、混合酸酐法、直接法、硫酯法和辅助成环法[6]。其中活泼酯法、叠氮法和混合酸酐法需要制备中间体,且需要低温反应。根据实际情况,最终确定使用直接法,反应浓度控制范围1×10-3~1×10-4mol/L,环化过程用HPLC检测至反初始应物峰消失。
2.6 环肽粗品的HPLC分析结果
沉淀后得白色环肽粗品560 mg,HPLC分析结果如图7。
色谱条件:流动相A为乙腈/水(10%,含0.1%TFA,体积分数,下同),B为乙腈/水(90%,含0.1% TFA) ,梯度洗脱为0~30 min,10%~100% B,紫外检测器,波长范围为214 nm;色谱柱为反相C18,规格为4.6×250 mm,流速为0.2 mL/min。样品进样量为10 μL 。

图7 环肽粗品HPLC图Fig.7 The HPLC of the crude cilengitide
2.7 环肽纯化后的HPLC、MS和NMR分析结果
目标峰液体真空冷冻干燥得到189 mg 西仑吉肽,在粗品中质量分数为33.8%;西仑吉肽纯度为98.3%,总产率为28.2%(以首个氨基酸上载量1.14 mmol记)。
HPLC结果见图8,MS结果见图9。 NMR结果与文献报道的NMR图谱[11]一致。

图8 环肽纯化后HPLC图Fig.8 The HPLC of the purified cilengitide
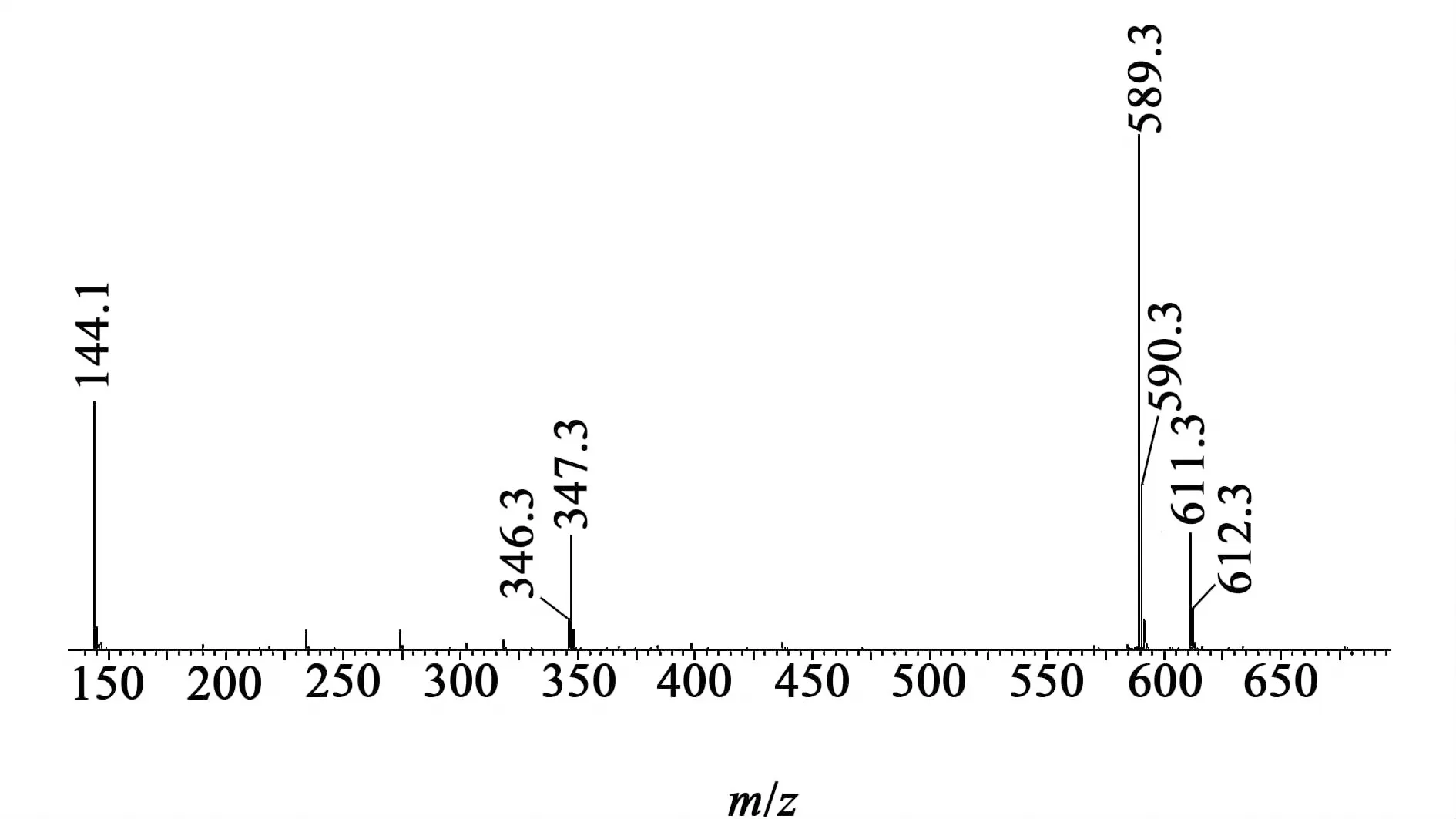
图9 环肽纯化后质谱图Fig.9 The MS of the purified cilengitide
3 结论
本研究采用Fmoc固相法合成线性肽,然后采用液相法环化合成了西仑吉肽。合成中,解决了难以缩合氨基酸的缩合效率问题,合成了高纯度的线性肽;并选择合适的液相环化条件合成环肽。所合成环肽纯度为98.3%,相对分子质量与理论相对分子质量588相符,NMR图谱与文献报道一致,说明该方法合成的西仑吉肽结构正确。本方法合成效率高,原料易得,路线简单易行,具有一定的工业化应用前景。
参考文献:
[1]MAS-MORUNO C,RECHENMACHER F,KESSLER H.Cilengitide:The first anti-angiogenic small molecule drug candidate.Design,synthesis and clinical evaluation[J].Anti-Cancer Agents in Medicinal Chemistry,2010,10:753-768
[2]HEHLGANS S,MICHAEL H,NILS C.Signalling via integrins:Implications for cell survival and anticancer strategies[J].Biochimica et Biophysica Acta,2007,(1775):163-180
[3]KALSER E,COLESCOTT R L,BOSSING C D,etal.Color test for detection of terminal amino groups in the solid phase synthesis of peptides[J ].Anal Biochem,1970,34:595-598
[4]张俊,杨明,王安明,等.微波作用下大位阻氨基酸与H-Pro-CTC 树脂的高效缩合[J].有机化学,2008,28,(12): 2 119-2 125
[5]林浩,王德心.哌嗪二酮衍生物的合成研究进展[J].药学学报,2003,38(5):395-400
[6]唐艳春,田桂玲,叶蕴华.环肽合成方法的研究进展[J].高等学校化学学报,2000,21(7):1 056-1 063
[7]吴蕾,任云霞,景文鹏.神经降压素的固相合成工艺研究[J].化学工业与工程,2009,26(4):292-297
[8]黄惟德,陈常庆.多肽合成[M].北京:科学出版社,1985
[9]王德心.固相有机合成:原理及应用指南[M].北京:化学工业出版社,2004
[10]SEWALD N,JAKUBKE H J.Peptides-Chemistry and biology[M].Germany:Wiley-VCH,2002
[11]CUPIDO T,SPENGLER J,RUIZ-RODRIGUEZ J,etal.Amide-to-ester substitution allows fine-tuning of the cyclopeptide conformational ensemble[J].Angew Chem Int Ed Engl,2010,49(15):2 732-2 737
[12]CLARK R J,AKCAN M,KAAS Q,etal.Cyclization of conotoxins to improve their biopharmaceutical properties[J/OL].Toxicon (2010),doi:10.1016/j.toxicon.2010-12-03
[13]DAI X,SU Z,LIU J.An improved synthesis of a selectiveαvβ3-integrin antagonist cyclo(-RGDfK-)[J].Tetrahedron Letters,2000(41):6 295-6 298

