外源性孕酮对去势大鼠学习记忆的影响
胡志英 方马荣 王 静
孕酮治疗月经病已广泛应用于临床,近年研究表明,其作用远超出生殖功能范畴,被称为“活性神经类固醇”。但有关它对学习记忆的影响,不同的研究结果不尽相同。本实验运用行为认知学检测手段,对3月龄和5月龄健康雌性SD大鼠,卵巢切除去势后皮下注射孕酮,采用Morris水迷宫测试大鼠学习记忆能力变化,探讨外源性孕酮对去势大鼠的学习记忆能力的影响,以期为临床上医源性卵巢去势后的激素替代及某些疾病如早老性痴呆的治疗探索新的治疗线索并提供理论基础。
资料与方法
1.动物和分组:实验动物为3月龄及5月龄,体质量为250±20g的健康雌性SD大鼠各60只[浙江大学实验动物中心提供,SYXK(浙)2007-0099]。每年龄组随机为6组:①正常组;②卵切组;③卵切+孕酮组;④卵切+芝麻油组;⑤假手术+孕酮组;⑥假手术+芝麻油组。
2.方法:(1)分组给药:正常组:不做任何处理;卵切组:切除卵巢,不给予任何治疗;卵切+孕酮组:切除卵巢,皮下注射孕酮20mg/kg进行治疗;卵切+芝麻油组:切除卵巢,皮下注射等体积的无菌芝麻油进行治疗;假手术+孕酮组:打开腹腔,不切除卵巢,但是给予皮下注射孕酮20mg/kg进行治疗;假手术+芝麻油组:打开腹腔,不切除卵巢,给予皮下注射等体积的无菌芝麻油进行治疗。以后每7天给药1次,共4次。(2)Morris水迷宫行为学检测:给药3周后,参照Morris水迷宫,对大鼠进行空间记忆的训练和测试[1]。水迷宫为直径130cm,高50cm的圆形水池,水深30cm,水温保持在20± 1℃左右,平台为透明有机玻璃,实验过程中周围环境条件保持安静、稳定,实验分为训练期和测试期。第1天进行训练,将大鼠沿壁轻放入水中,记录大鼠的逃避潜伏期:即从大鼠入水到找到水下平台所需要的时间,若大鼠120s内未找到平台,则引导大鼠找到平台,逃避潜伏期以120s计。大鼠找到平台或被引导到平台上后停留10s。然后擦干放回笼内。第2天开始直到第5天进行实际的行为学测验,以找到平台所需的时间的平均值(平均潜伏期)和找到平台的次数(平台次数)来表示。
结果
1.3月龄青年期大鼠:潜伏期是指在规定的2min内,需要多长时间能够找到平台。与正常组比较,3月龄青年期大鼠卵巢切除去势后平均潜伏期明显延长(P<0.01);与卵切组及卵切+芝麻油组比较,卵切+孕酮组、假手术+孕酮组及假手术+芝麻油组逃避学习成绩明显提高(P<0.01);假手术+孕酮组与正常组及假手术+芝麻油组比较学习成绩无显著差异(P>0.05,表1、图1)。

表1 3月龄青年期大鼠平均潜伏期
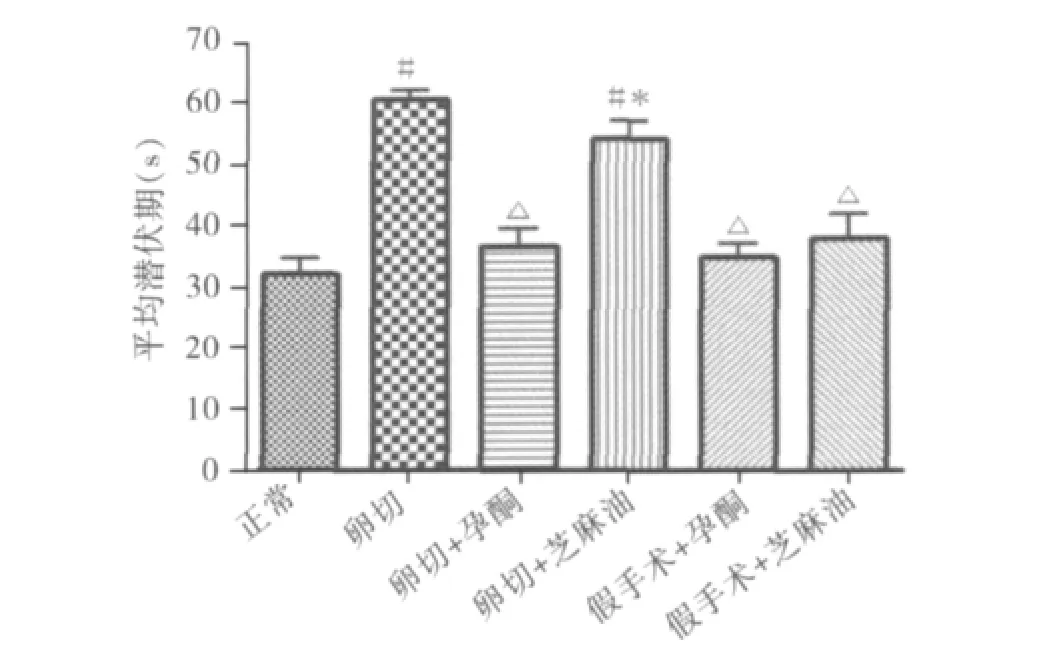
图1 3月龄青年期大鼠不同组别平均潜伏期比较
2.平台次数:平台次数是指在规定的2min内找到平台的次数。与正常组比较,3月龄青年期大鼠卵巢切除去势后平台次数明显减少(P<0.01);与卵切组比较卵切+孕酮组、假手术+孕酮组及假手术+芝麻油组空间记忆能力稍有改善(P<0.05);假手术+孕酮组与正常组及假手术+芝麻油组比较学习成绩无显著差异(P>0.05,表2、图2)。

表2 3月龄青年期大鼠平台次数

图2 3月龄青年期大鼠不同组别平台次数比较
3.5 月龄成年期大鼠:(1)平均潜伏期:与正常组比较,5月龄成年期大鼠卵巢切除去势后平均潜伏期延长(P<0.05);假手术+孕酮组学习成绩明显优于卵切组及卵切+芝麻油组(P<0.01);与卵切组及卵切+芝麻油组比较卵切+孕酮组学习成绩无显著差异(P>0.05);假手术+孕酮组与正常组及假手术+芝麻油组比较学习成绩亦无显著差异(P>0.05,表3、图3)。(2)平台次数:与正常组比较,5月龄成年期大鼠卵巢切除去势后平台次数明显减少(P<0.01);假手术+孕酮组学习成绩优于卵切组(P<0.05,表4、图4)。

表3 5月龄成年期大鼠平均潜伏期

图3 5月龄成年期大鼠不同组别平均潜伏期比较

表4 5月龄成年期大鼠平台次数
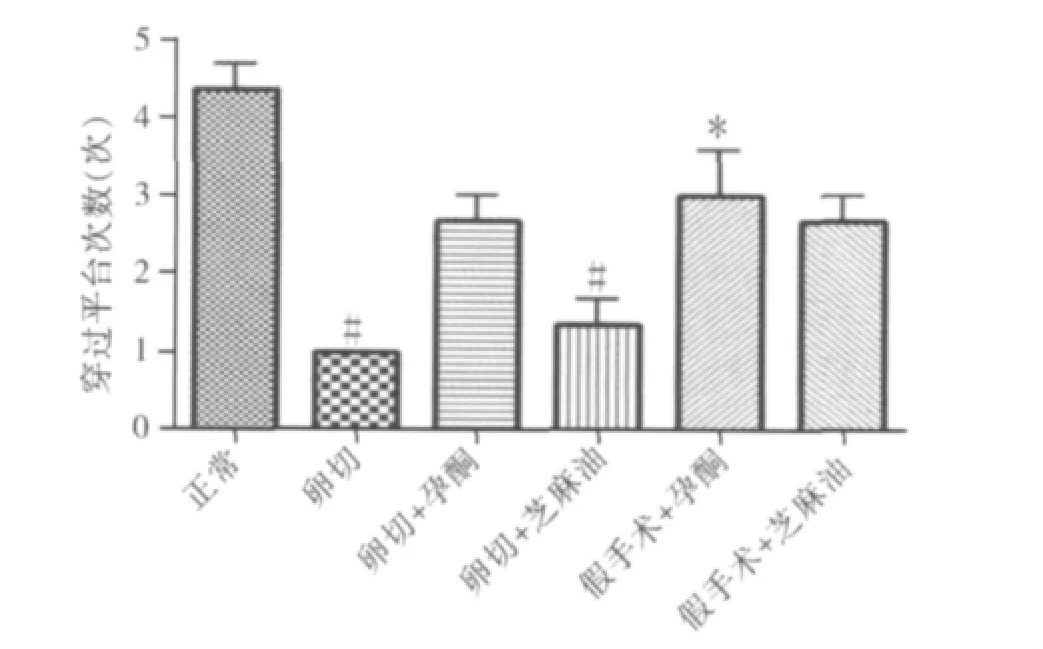
图4 5月龄成年期大鼠不同组别平台次数比较
讨论
Morris水迷宫(Morriswatermaze,MWM)是英国心理学家Morris于20世纪80年代初设计的用于研究大鼠空间学习记忆的装置[2],是神经科学领域检测动物学习记忆能力的常用工具,在世界上已经得到广泛地认可,是医学院校开展行为学研究尤其是学习与记忆研究的首选经典实验[3]。Morris水迷宫实验的基础是,啮齿类动物在水中有强烈的逃避水环境的动机,并以最快、最直接的途径逃离水环境。学会逃避水环境的过程体现动物的学习能力;根据周围环境进行空间定位,有目的地游往水中安全的地方(平台),体现动物的空间记忆能力。
经典的水迷宫试验分为空间定向航行(place navigation)试验和空间搜索(spatial probe)试验两部分,其中定向航行试验用于测量大鼠对水迷宫学习的能力,以动物潜伏期时间的长短衡量其学习能力,潜伏期愈短其学习能力愈强;而空间搜索试验用于测量大鼠学会寻找平台后,对平台空间位置记忆的能力,以动物站台区域停留时间和穿越站台区域次数评价其空间记忆能力,动物穿越站台区域次数愈多则表明其空间记忆能力愈强。本实验以Morris水迷宫试验作为动物学习记忆能力测试手段,为排除手术及皮下注射的干扰,将卵切+孕酮组(即切除卵巢,皮下注射孕酮进行治疗)作为实验观察组,将正常组(即不做任何处理)、卵切组(即切除卵巢,不给予任何治疗)、卵切+芝麻油组(即切除卵巢,皮下注射等体积的无菌芝麻油)及假手术+孕酮组(即打开腹腔,不切除卵巢,但给予皮下注射孕酮进行治疗)和假手术+芝麻油组(即打开腹腔,不切除卵巢,皮下注射等体积的无菌芝麻油)作为实验对照组,观察研究外源性孕酮对去势大鼠学习记忆能力的影响。实验发现卵巢切除去势对3月龄青年期和5月龄成年期SD大鼠的学习及记忆能力均是有害的,表现为寻找隐匿平台的平均潜伏期延长,穿过平台区域的次数减少,提示大鼠对水迷宫学习记忆能力明显下降可能与卵巢切除去势后雌、孕激素的缺乏有关。
学习记忆与海马神经元突触可塑性密切相关,而生殖内分泌的状态、卵巢缺失以及出现早老性痴呆(AD)相关的病理学变化都会调整卵巢类固醇激素引起的神经可塑性。已证实围绝经期及绝经后妇女应用激素替代治疗(HRT)能改善围绝经期症状,在词汇记忆、警觉和推理等方面均有改善,可能减少或延迟AD的发生。妇女在绝经期激素丧失会使认知能力退化,使女性的AD患病率明显高于男性,有研究提示HRT能通过减少痴呆发病的风险来抵消这种AD发病率的性别差异,改善脑部功能退化,延缓或预防AD的发生[4~6]。而近年美国一项大规模的临床前瞻性研究报道了令学者们困惑的结果:雌孕激素联合治疗可能会增加妇女患AD的风险[7]。雌孕激素联合治疗对AD患者认知能力可能是有损害的,而单用雌激素治疗有益于认知能力[8~10]。故目前有人主张对女性绝经后应补充小剂量雌激素,认为可以减少脑卒中和老年痴呆的发病率,对是否同时应用孕激素,目前尚有争议[7,11,12]。
孕酮对女性的生理和病理生理影响已有很多的研究及实际的临床应用,但对神经系统作用直至近年方引起关注。近年的研究表明,孕酮的作用已远远超出生殖功能的范畴,它不仅可在神经系统中合成分泌,并且能影响神经系统的结构和功能,是神经系统中一种重要的信号分子。在类固醇激素家族中,孕酮作为一种可以在神经系统合成并发挥作用的神经活性甾体,其作用机制正逐渐被国内外学者所研究。尽管孕酮作用机制尚不很清楚,但对这一传统类固醇激素有了新的认识,而最近不断的一些新发现也逐渐引起人们对其在临床应用上的一些新思索[13]。近年来,孕酮对脑、脊髓和周围神经的保护及损伤后修复等研究引起了人们极大的兴趣。研究发现孕酮在多种脑损伤动物模型的治疗中具有神经保护作用,能改善模型动物的学习记忆能力,减轻脑水肿、延缓神经细胞的凋亡、防止神经元的减少和促进神经髓鞘的合成[7,14,15]。有学者在实验动物脑损伤前或后的一段时间,发现给予动物外源性孕酮治疗,能减轻损伤所致的组织学和行为学的损害。尽管众多实验证实了孕酮对缺血再灌注损伤脑的保护作用,但也有不一致的结果,如Murphy等的结果显示孕酮加重去卵巢大鼠局灶性脑缺血后纹状体的损伤程度,而外源性孕酮对去势造成绝经大鼠模型的学习记忆能力的影响,对空间学习记忆能力的改善有利抑或有害尚未见相关文献报道。为此,我们将3月龄和5月龄SD大鼠卵巢切除去势后皮下注射孕酮,采用Morris水迷宫进行学习记忆能力检测,观察孕酮对大鼠行为认知能力的影响,实验观察到外源性孕酮能改善青年期去势大鼠的学习记忆能力,使逃避学习成绩明显提高,平台次数稍有增加,但不能提高成年期去势大鼠的认知能力,提示外源性孕酮对去势大鼠学习记忆能力的改善与年龄有关,与Singh等报道一致,可能与孕酮可减少与年龄相关的神经易损性的毒性损伤有关[7,14]。Anderson等研究发现不同剂量孕酮对DNA损伤应答、细胞增殖和凋亡的调控、先天的免疫应答及血管的重塑等均有不同的反应。本实验中外源性孕酮不能提高成年期去势大鼠的学习记忆能力,是否还与成年期大鼠生殖内分泌的状态有关:即体内已含有一定量的雌孕激素,这样要达到孕酮保护作用的阈值比较高,而使得孕酮的应用未达到适当的治疗或保护剂量有关?
总之,孕酮在许多方面具有潜在的应用价值,且目前国内外已有不少有关临床应用治疗各种神经损伤的报道。本研究为孕酮安全用于激素替代,并可作为一种临床治疗医源性的卵巢去势引起的学习记忆能力的下降,以及有可能用于某些疾病如早老性痴呆的治疗探索新的治疗线索并提供一定理论基础。但仍存在一些问题需进一步解决,如因经费问题未同时观察外源性孕酮对老年期去势大鼠学习记忆的影响、治疗不同剂量和治疗时间窗的选择以及孕酮发挥作用的途径等方面尚需在以后的研究中进一步探讨。
1 Harburger LL,Bennett JC,Frick KM.Effects of estrogen and progesterone on spatialmemory consolidation in aged females[J].Neurobiol Aging,2007,28(4):602-610
2 Morris RGM.Spatial localization doesnot require the presence of local cues[J].LearnMotiv,1981,12:239-260
3 D'Hooge R,De Deyn PP.Application of the Morriswatermaze in the study of learning and memory[J].Brain research reviews,2001,36 (1):60-90
4 Baum LW.Sex,hormones,and Alzheimer's disease[J].JGerontol A Biol SciMed Sci,2005,60(6):736-743
5 Resnick SM,Maki PM,Rapp SR,etal.Effects of combination estrogen plus progestin hormone treatment on cognition and affect[J].J Clin Endocrinol Metab,2006,91(5):1802-1810
6 Barnes LL,Wilson RS,Schneider JA,et al.Gender,cognitive decline,and risk of AD in older persons[J].Neurology,2003,60 (11):1777-1781
7 Singh M.Mechanisms of progesterone-induced neuroprotection[J].Ann N Y Acad Sci,2005,1052(1):145-151
8 Culhane NS.Estrogen plus progestin may increase incidence of dementia[J].JFam Pract,2003,52(10):754-755
9 Yoon BK.Effects of estrogen plus progestin on risk of dementia.[J]JAMA,2003,290(13):1707-1708
10 Shumaker SA,Legault C,Kuller L,et al.Women's Health Initiative Memory Study.Conjugated equine estrogens and incidence of probable dementia and mild cognitive impairment in postmenopausal women: Women's Health Initiative Memory Study[J].JAMA,2004,291 (24):2947-2958
11 Wojtal K,TrojnarMK,Czuczwar SJ.Endogenousneuroprotective factors:neurosteroids[J].Pharmacol Rep,2006,58(3):335-340
12 Maki PM,Zonderman AB,Resnick SM.Enhanced verbalmemory in nondemented elderly women receiving hormone-replacement therapy[J].Am JPsychiatry,2001,158(2):227-233
13 何璐,李云生.孕酮对神经系统作用机制的研究进展[J].解剖与临床,2006,11(4):291-293
14 Singh M,Sumien N,Kyser C,et al.Estrogens and progesterone as neuroprotectants:what animal models teach us[J].Front Biosci,2008,13(5):1083-1089
15 Wise PM.Estrogen therapy:does it help or hurt the adult and aging brain?Insights derived from animalmodels[J].Neuroscience,2006,138(3):831-835

