羧甲基硫脲壳聚糖的结构表征及抑菌活性研究
李小芳,马金满,冯小强,王廷璞,杨 声,张红娟,孔旭娥
(1.天水师范学院生命科学与化学学院,甘肃 天水 741001;2.甘谷一中,甘肃 甘谷 741200)
羧甲基硫脲壳聚糖的结构表征及抑菌活性研究
李小芳1,马金满2,冯小强1,王廷璞1,杨 声1,张红娟1,孔旭娥1
(1.天水师范学院生命科学与化学学院,甘肃 天水 741001;2.甘谷一中,甘肃 甘谷 741200)
运用红外光谱、紫外光谱和差热-热重分析对合成的羧甲基硫脲壳聚糖进行结构表征,并研究羧甲基硫脲壳聚糖对大肠杆菌、金黄色葡萄球菌的抑菌活性。结果表明:硫脲壳聚糖中羟基发生了羧甲基化反应,与壳聚糖相比热稳定性降低;羧甲基硫脲壳聚糖对大肠杆菌、金黄色葡萄球菌的抑菌活性较壳聚糖本身增强,对大肠杆菌、金黄色葡萄球菌最小抑菌质量浓度(MIC)均为0.20mg/mL。
壳聚糖;羧甲基硫脲壳聚糖;表征;抑菌活性
壳聚糖(chitosan,CS)具有无毒无害、安全、可靠、易生物降解,具有抑菌活性高、广谱、杀灭率高和无毒等优点[1-4],但壳聚糖只溶于酸或酸性溶液中,而不溶于水,故对壳聚糖进行化学改性以提高其溶解性,是壳聚糖研究中最活跃的课题。其中,对羧甲基壳聚糖和硫脲壳聚糖(thiourea chitosan,TCS)研究较多[5-6]。但是,对于羧甲基硫脲壳聚糖(carboxymethyl thiourea chitosan,CMTCS)的制备却鲜有报道。
本实验合成了羧甲基硫脲壳聚糖,采用红外、紫外和差热-热重分析手段表征其结构与性质,并考察其对大肠杆菌、金黄色葡萄球菌的抑菌活性。该研究旨在为壳聚糖及其衍生物的临床应用提供更加充分的实验依据,扩大壳聚糖在医药和食品工业等领域的应用范围。
1 材料与方法
1.1 材料、试剂与仪器
壳聚糖(Mw=50kD,纯度90%,用体积分数1.0% HAc溶解) 浙江玉环壳聚糖有限公司;氯乙酸、硫脲(分析纯) 天津化学试剂公司。
大肠杆菌(E.coli,ATCC 35218)、金黄色葡萄球菌(St.aureus,ATCC 26113)由天水市中医院化验科提供。
Spectrum One 3.0傅里叶变换红外光谱仪、差热-热重分析仪 美国Perkin Elmer公司;UV-2450紫外-可见分光光度计 日本岛津公司。
1.2 方法
1.2.1 羧甲基硫脲壳聚糖的制备
称取3.22g壳聚糖和3.04g硫脲,加入到含有60mL无水乙醇的烧瓶中,80℃回流12h后,冷却至室温,抽滤,用无水乙醇洗涤3次,将滤饼溶解在500mL1% HAc溶液中,向该溶液中加入10g/100mL NaOH溶液至沉淀完全,过滤,用蒸馏水洗涤,干燥,得硫脲壳聚糖[7]。元素分析法测得硫脲基团的取代度为10%。
称取1.81g硫脲壳聚糖,加人23mL 42g/100mL NaOH溶液,冰水浴中搅拌2h。将4.53g氯乙酸溶于23mL异丙醇中,0.5h内滴入硫脲壳聚糖的NaOH溶液中,温度控制在40~60℃,回流48h,过滤,将滤渣溶解在92mL蒸馏水中,用2.5mol/L的HCl调节pH值为7.0,离心分离,向滤液中加入无水乙醇,至不再有沉淀析出,抽滤,用无水乙醇洗涤3次,干燥得羧甲基硫脲壳聚糖。酸碱滴定法测得羧甲基基团的取代度为65%[8]。
1.2.2 结构表征
采用KBr压片法,400~4000cm-1范围扫描红外光谱;用1.0% HAc溶解配制1.0mg/mL羧甲基硫脲壳聚糖、硫脲壳聚糖和壳聚糖溶液,在波长200~500nm范围内扫描紫外光谱;以α-Al2O3为参比,N2保护下以10℃/min升温速度升温至800℃,测定壳聚糖、硫脲壳聚糖和羧甲基硫脲壳聚糖的差热-热重曲线。
1.2.3 抑菌实验
将受试标准菌株接种于液体培养基(0.6g牛肉膏、2.0g蛋白胨、1.0g氯化钠、200mL 水,调pH值为7.4~7.6),37℃活化24h。分别配制5.0mg/mL的壳聚糖、硫脲壳聚糖和羧甲基硫脲壳聚糖作为母液备用。1.0mL 5.0mg/mL壳聚糖、硫脲壳聚糖、羧甲基硫脲壳聚糖和15mL含有受试菌的液体培养基混合于试管中,以1.0mL1.0% HAc溶液作为空白对照,37℃、120r/min摇床振荡培养24~48h,测定不同时间内的OD610nm值。光密度越小,抑菌活性越强。
1.2.4 最小抑菌质量浓度测定
将一定体积的5mg/mL羧甲基硫脲壳聚糖和固体培养基混合均匀,使其最终质量浓度分别为0、0.025、0.05、0.1、0.15、0.20mg/mL和0.25mg/mL,灭菌后倒平板,待冷却后,接入100μL菌悬液涂布均匀,置于37℃条件下恒温培养,计算菌落数并拍照。以肉眼观察不到菌落时对应的质量浓度即为羧甲基硫脲壳聚糖对E.coli和St.aureus的最小抑菌质量浓度(MIC)。
2 结果与分析
2.1 红外光谱分析结果
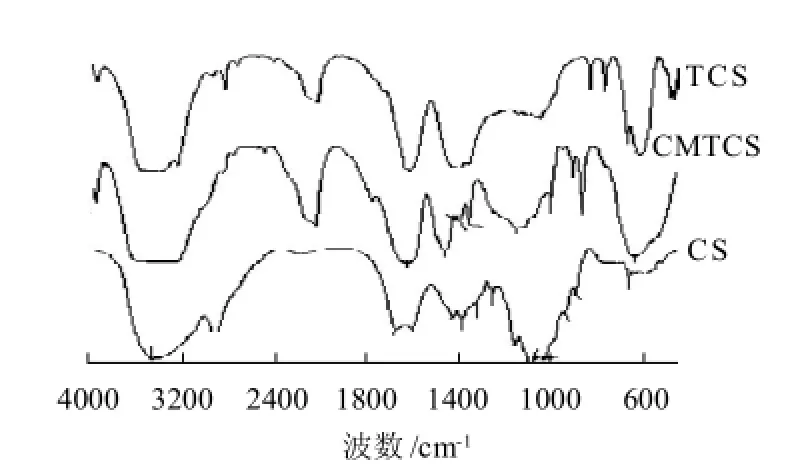
图1 壳聚糖、硫脲壳聚糖和羧甲基硫脲壳聚糖的红外光谱Fig.1 IR spectra of CS, TCS and CMTCS
壳聚糖、硫脲壳聚糖和羧甲基硫脲壳聚糖的红外光谱如图1所示。壳聚糖位于3445cm-1处宽且强的吸收峰为N-H和O-H的伸缩振动峰,在脲壳聚糖中该吸收峰明显变窄,体现-NH2和-OH形成的氢键能力减弱;890cm-1附近的吸收峰始终存在β-构型糖苷键的特征吸收峰,这就说明反应前后壳聚糖的环状构型未发生任何改变;在1455cm-1附近有一新吸收峰,说明壳聚糖分子中引入了-C=S基团[9];壳聚糖1600cm-1处N-H剪式振动吸收峰位移至1615、1035cm-1和1082cm-1处伯醇和仲醇C-O伸缩振动峰分别位移至1050cm-1和1069cm-1,说明壳聚糖中的氨基和羟基均参与了反应。
羧甲基硫脲壳聚糖在890cm-1附近有β-构型糖苷键的特征吸收峰,说明接枝反应没有破坏壳聚糖分子链节中的吡喃苷的六元环结构;在1774cm-1处产生新吸收峰,归属于羧基中-C=O的伸缩振动峰;原硫脲壳聚糖1050cm-1和1069cm-1处伯醇和仲醇C—O伸缩振动峰,在羧甲基硫脲壳聚糖中分别位移至1055cm-1和1119cm-1,表明硫脲壳聚糖中羟基发生了羧甲基化反应;位于1615cm-1处的氨基吸收带仍然存在,表明硫脲壳聚糖分子链上的大量-NH2没有发生羧甲基化反应。
2.2 紫外光谱分析结果

图2 壳聚糖、硫脲壳聚糖、羧甲基硫脲壳聚糖的紫外光谱Fig.2 Ultraviolet spectra of CS, TCS and CMTCS
壳聚糖、硫脲壳聚糖和羧甲基硫脲壳聚糖分别在波长 224.50、235.00nm和232.00nm处有强吸收峰(图2),这是由于配合物中氮、氧和硫的孤对电子发生n→σ*跃迁和π→π*跃迁,导致电子光谱发生的变化所致,且在同一质量浓度下,硫脲壳聚糖的吸收强度强于壳聚糖。
2.3 差热热重分析结果
壳聚糖、硫脲壳聚糖、羧甲基硫脲壳聚糖的差热-热重分析如图3所示。壳聚糖的降解分为3个阶段[10]:第一个阶段在80℃开始,失重7.6%,主要是失去水分子;第二个阶段失重在219℃开始,到283.6℃失重达最大,失重58.6%,主要是壳聚糖的分解,也涉及氧化分解等;第三个阶段失重在382.9℃开始,到543℃时壳聚糖完全分解,失重38.8%。硫脲壳聚糖的降解的第一个阶段在75℃开始,主要是水的失重;第二个阶段在187.3℃开始,在250.8℃失重达最大,失重37%,当温度升至800℃时,质量还剩余37%。羧甲基硫脲壳聚糖降解的第一个阶段在76℃开始,失重12%,第二个阶段在203℃开始,在360℃失重达最大值为32%,在276℃出现一个强放热峰,当温度升至800℃时,质量还剩余35%。由此表明,硫脲壳聚糖和羧甲基硫脲壳聚糖主链断裂的温度明显低于壳聚糖主链断裂的温度,与壳聚糖相比不稳定,它们的不稳定性是由于缺少自由的氨基,在制备衍生物时氨基被硫脲基团取代,壳聚糖因其自由的氨基而更稳定[11]。因此,温度较低时壳聚糖比较稳定,而温度较高时硫脲壳聚糖和羧甲基硫脲壳聚糖比较稳定。
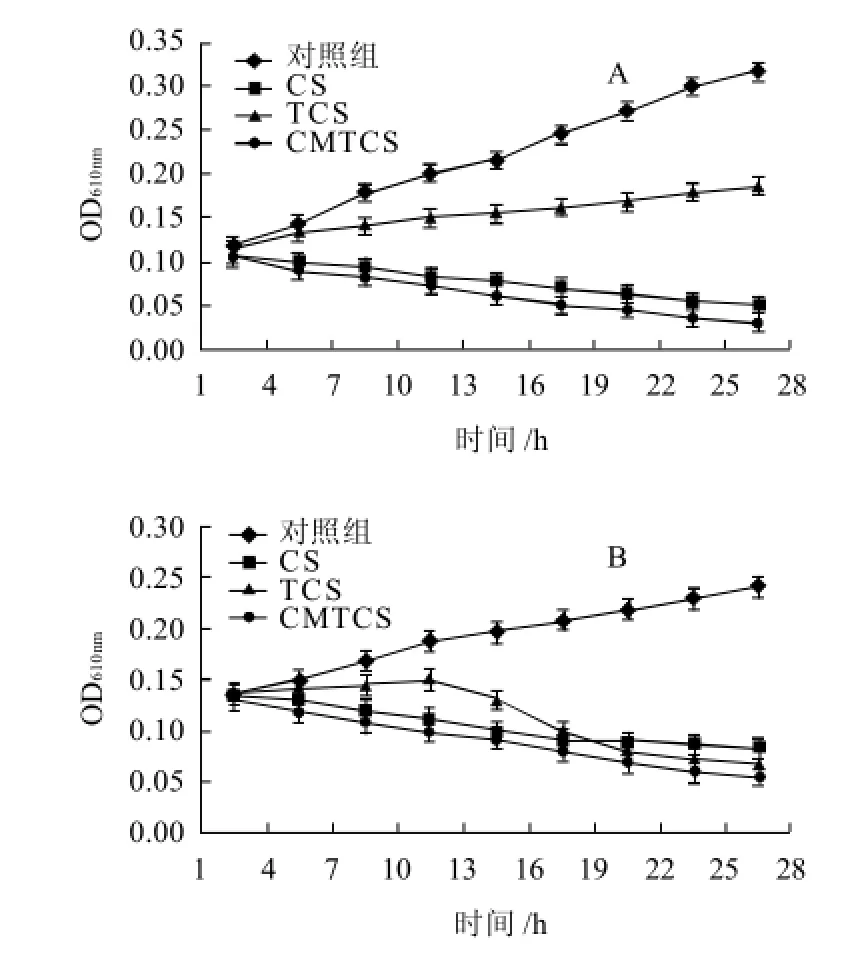
图4 不同作用时间内壳聚糖及其衍生物E.coli(A)、St.aureus (B)的OD610nm值Fig.4 Growth inhibitory effects of CS, TCS and CMTCS on E.coli and St.aureus

图3 壳聚糖、硫脲壳聚糖和羧甲基硫脲壳聚糖的差热-热重分析Fig.3 TG-DTA-DTG analysis of CS, TCS and CMTCS
2.4 抑菌实验结果
由图4可知,壳聚糖、硫脲壳聚糖和羧甲基硫脲壳聚糖与大肠杆菌和金黄色葡萄球菌作用后,对应的OD610nm均小于对照组,表明壳聚糖、硫脲壳聚糖和羧甲基硫脲壳聚糖均具有较好的抑菌性能,并且羧甲基硫脲壳聚糖的抑菌活性最强,其次为壳聚糖,硫脲壳聚糖抑菌活性最弱。
一般认为壳聚糖的抑菌活性与其胺基含量有关[12]。硫脲改性的壳聚糖抑菌活性较壳聚糖大大降低,是由于硫脲壳聚糖中-NH2上引入了硫脲基团,减少了壳聚糖自身自由胺基的含量,同时也说明了壳聚糖对大肠杆菌和金黄色葡萄球菌的抑制作用主要与-NH2的质子化有关。但是硫脲壳聚糖仍然具有抑菌活性,并且发现随着时间的延长,对金黄色葡萄球菌的抑菌活性较壳聚糖稍有增强,这可能是硫脲壳聚糖中存在-C=S,容易螯合细菌细胞膜表面的Ca2+和Mg2+,紊乱了细菌细胞正常的生理功能而引起的。在羧甲基硫脲壳聚糖中,NH2上引入了硫脲的同时,在C6位上亦引入了亲水性的羧甲基基团,一方面增加了其在水中的溶解性,另一方面,增加了和细菌表面接触的可能性程度,故对大肠杆菌和金黄色葡萄球菌的抑制作用均强于壳聚糖和硫脲壳聚糖。
由图5可知,当羧甲基硫脲壳聚糖的质量浓度为0.20mg/mL时,培养基中不再有细菌生长,说明羧甲基硫脲壳聚糖对大肠杆菌和金黄色葡萄球菌的MIC均为0.20mg/mL。而壳聚糖对大肠杆菌和金黄色葡萄球菌的MIC均为0.5mg/mL[13]。所以,与壳聚糖相比,羧甲基硫脲壳聚糖对大肠杆菌和金黄色葡萄球菌的MIC均所降低,该结果亦表明:羧甲基硫脲壳聚糖对大肠杆菌和金黄色葡萄球菌的抑菌活性较壳聚糖本身增强。
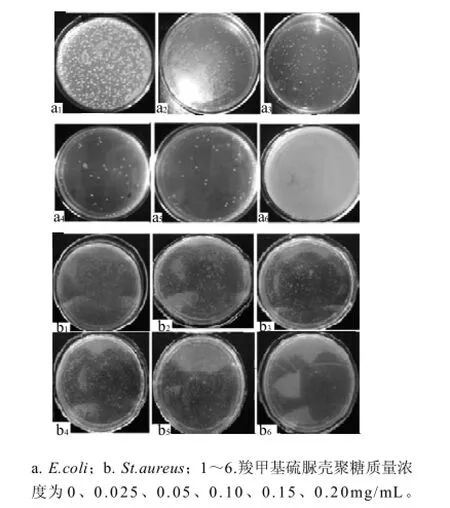
图5 羧甲基硫脲壳聚糖对E.coli (a)和St.aureus (b)生长的影响Fig.5 Effect of CMTCS on the growth of E.coli and St.aureus
3 结 论
硫脲壳聚糖中羟基发生了羧甲基化反应,与壳聚糖相比热稳定性降低。羧甲基硫脲壳聚糖对大肠杆菌、金黄色葡萄球菌的抑菌活性较壳聚糖增强,且对两种细菌的最小抑菌质量浓度均0.20mg/mL。
[1]CHUNG Y C, CHEN C Y. Antibacterial characteristics and activity of acid-soluble chitosan[J]. Bioresource Technol, 2008, 99: 2806-2814.
[2]JE J Y, KIM S K. Chitosan derivatives killed bacteria by disrupting the outer and inner membrane[J]. Journal of Agricultural and Food Chemistry, 2006, 54(18): 6629-6633.
[3]SEBTI I, MARTIAL-GROS A, CARNET-PANTIEZ A, et al. Chitosan polyer as bioactive coating and film against Aspergillus niger contamination[J]. Journal of Food Science, 2005, 70(2): 100-104.
[4]KIM C H, KIM S Y, CHOI K S. Synthesis and antibacterial activity of water-soluble chitin derivatives[J]. Polymers of Advanced Technologies, 1997, 8: 319-325.
[5]彭时军, 赵纪强. 硫脲乙酸壳聚糖(C6)的合成[J]. 安徽化工, 2006(1): 35-36.
[6]赵爱杰, 原继波, 常津. O-羧甲基化壳聚糖的制备及应用研究进展[J]. 高分子通报, 2004(4): 59-63.
[7]CHEN Shuiping, WU Guozhong, ZENG Hongyan. Prepration of high antimicrobial activity thiourea chitosan-Ag+complex[J]. Carbohydrate Polymers, 2005, 60: 33-38.
[8]陈凌云, 杜予民, 肖玲, 等. 羧甲基壳聚糖的取代度及保湿性[J]. 应用化学, 2001, 18(1): 5-8.
[9]PADHYE S B, KAUFFMANN G B. Transition metal complexes of semicarbazones and thiosemicarbazones[J]. Coordination Chemical Review, 1985, 63: 127-135.
[10]蒋挺大. 壳聚糖[M]. 北京: 化学工业出版社, 2003: 17-18.
[11]TOIDA T, CHAIDEDGUMJORN A, LINHARDT R J. Structure and bioactivity of sulfated polysaccharides[J]. Trends in Glycoscience and Glycotechnology, 2003, 15: 29-46.
[12]王鸿, 沈月新. 不同脱乙酰度壳聚糖的抑菌性[J]. 上海水产大学学报, 2001, 10(4): 380-382.
[13]冯小强, 李小芳, 杨声, 等. 壳聚糖对细菌细胞膜及膜蛋白的作用[J].食品科学, 2009, 30(13): 84-88.
Structural Characterization and Antibacterial Activity of Carboxymethyl Thiourea Chitosan
LI Xiao-fang1,MA Jin-man2,FENG Xiao-qiang1,WANG Ting-pu1,YANG Sheng1,ZHANG Hong-juan1,KONG Xu-e1
(1. College of Life Science and Chemistry, Tianshui Normal University, Tianshui 741001, China;2. No. 1 Middle School of Gangu, Gangu 741200, China)
Carboxymethyl thiourea chitosan (CMTCS) was prepared and characterized by infrared spectrometry (FT-IR), ultraviolet spectrometry (UV) and differential thermal and thermogravimetry analysis (TG-DTA) methods. The antibacterial activity of CMTCS against E.coli and St.aureus were investigated in vitro. The results showed that the antibacterial activity of CMTCS was obviously higher than that of chitosan with an MIC of 0.20 mg/mL against both E.coli and St.aureus.
chitosan;carboxymethyl thiourea chitosan;characterization;antibacterial activity
TQ929.2
A
1002-6630(2012)01-0064-04
2011-01-05
天水师院物理无机化学重点学科基金项目(ZD0840);天水师院“青蓝”人才工程和中青年教师科研资助项目(TSA1003)
李小芳(1983—),女,助教,硕士,主要从事天然高分子生物活性研究。E-mail:lixiaofang1982@lzu.cn

