牦牛乳脂肪球膜组成分析及蛋白热稳定性
何胜华,马 莺,崔艳华,李海梅,董爱军
(哈尔滨工业大学 食品科学与工程学院,150090 哈尔滨)
乳脂肪球(MFG)以一种微小的球状物存在于奶中,直径约0.2 ~15.0 μm[1],外面被一层很薄的膜包围,这层膜称为乳脂肪球膜(MFGM)[2].MFGM中含有25% ~60%的蛋白质,这些蛋白质在其他奶相中含量很少,MFGM中蛋白质占奶中总蛋白的 1% ~2%[3].通过聚丙烯凝胶电泳(SDS-PAGE)分离牛奶MFGM中蛋白质,会出现7 ~8 条主要的蛋白带[4],如黏蛋白(MUC1)、黄嘌呤脱氢酶/氧化酶(XDH/XO)、过碘酸稀夫Ⅲ(PASⅢ)、过碘酸稀夫Ⅳ(PASⅣ)、嗜乳脂蛋白(BTN)、过碘酸稀夫6/7(PAS6/7)和GTP结合蛋白(GTPrS).近几年,MFGM原料作为一种有价值的成分应用于食品加工新技术中,MFGM蛋白的功能特性引起广泛兴趣,特别是有报道称MFGM蛋白有抗癌、防止幽门螺杆菌的感染和对脑脊髓炎的自身免疫作用[5-8].但是奶加工的一些过程,如常见的冷却、加热和均质都会很大程度地破坏MFGM蛋白的稳定性,其中加热是奶加工的一个关键过程,因此,研究热处理对MFGM蛋白的稳定性尤其重要.我国在MFGM方面的研究还处在初级阶段,对奶MFGM的分离和组成及MFGM蛋白的热稳定性几乎没有报道.
牦牛乳含有较高的脂肪(5% ~8%),而且脂肪球粒径较大(4.39 μm),很适合分离奶油及MFGM.本文主要从牦牛乳脂肪中提取分离MFGM,通过十二烷基磺酸钠聚丙烯酰胺凝胶电泳(Sodium Dodecylsulfate Polyacrylamide Gel Electrophoresis,SDS-PAGE)确定牦牛MFGM中的主要蛋白、组成及其热稳定性,并对牦牛MFGM蛋白的氨基酸组成进行分析.
1 实验
1.1 实验材料
麦洼牦牛奶:采自四川红原县;邻苯二胺(OPD):北京索莱宝科技有限公司;唾液酸(N-乙酰神经氨酸)标准品(购自sigma).
1.2 实验设备
Agilent 1100型高效液相色谱仪,配备四元梯度泵,100位自动进样器,二极管阵列检测器(DAD),化学工作站,离心机.日立835-50型氨基酸分析仪.电泳仪:DYY-8C,北京六一仪器厂.
1.3 实验方法
1.3.1 牦牛奶MFGM的分离提取
取新鲜牦牛乳,向每100 mL牦牛乳中加入蔗糖5 g,于42℃用小型乳脂分离机分离出奶油,将分离出的奶油不经洗涤和用1.5 g·L-1的KCl于小型乳脂分离机中洗涤3次并收集奶油,洗涤的目的是去除附着于脂肪上的酪蛋白和乳清蛋白,洗后和未洗的奶油于4℃冷藏12 h后于42℃溶解,溶解后的奶油用搅拌器搅乳10 min,加少量去离子水,分离出黄油和酪乳.分离出的黄油于60℃加热融化,然后加入等体积的去离子水,形成的浆液在4 kr/min离心15 min,收集上清液并与酪乳混合,用0.01 mol/L的HCl将上述合并液调至 pH4.8于室温(25℃)净置30 min使MFGM蛋白沉淀,于4 kr/min离心15 min收集沉淀物和悬浮的MFGM小体,向收集物中加蒸馏水并用0.01 mol/L的NaOH调至pH6.8.纯化后的MFGM储存于-20℃,待分析.
1.3.2 牦牛MFGM透射电镜
将分离提纯的MFGM用戊二醛在4℃固定在2.5 h以上,然后用0.1 mol/L磷酸缓冲溶液(PBS)pH7.2清洗3次,每次15 min,洗涤后用1%锇酸固定1.5 h,接着用0.1 mol/L PBS pH7.2再清洗3次,每次15 min,洗涤后分别用体积分数为50%、70%、90%的乙醇梯度脱水15 min,最后用100%乙醇脱水两次,每次10 min.用100%乙醇与100%丙酮(体积比为1∶1)继续脱水10 min后,再用100%丙酮脱水10 min,接着用100%丙酮与 812树脂(体积比为 1∶1)包埋30 min,再用100%丙酮与812树脂(体积比为1∶2)包埋2 h,梯度聚合3 d后,修块、切成厚度为60 nm的小块,电镜双重染色后进行观察.
1.3.3 牦牛MFGM的成分分析
牦牛MFGM的蛋白质含量分析采用凯氏定氮法(AOAC,1974).总脂质含量分析采用文献[9]方法.己糖含量采用苯酚-硫酸法,参照文献[10].唾液酸含量采用高效液相色谱法,色谱条件为:色谱柱,Agilent TC-C18柱(4.6 mm×250 mm,5 μm);柱温,35 ℃;流动相,1.0% 四氢呋喃水溶液(含0.2% 磷酸)-乙腈(体积比为92∶8);检测波长,230 nm;流速,1.0 mL/min;进样体积,10 μL.
样品处理:准确称取1 g牦牛奶MFGM,用浓度为0.1 mol/L的硫酸溶液8 mL水解,在水浴锅中80℃条件下水解 2 h,取出后冷却,于4 kr/min离心15 min,取上清液调pH值至4~6,将滤液定容至10 mL,用移液管准确移取2 mL滤液,加入10g/L邻苯二氨盐酸盐溶液(用0.2 mol/L硫酸氢钠溶液溶解)1 mL,再置于80℃水浴锅中加热 30 min,取出后冷却,经0.45 μm膜过滤后精密吸取上述溶液10 μL注入液相色谱仪,记录峰面积.以唾液酸标准品作标准曲线,计算出唾液酸的含量;牦牛MFGM灰分含量的测定通过用马福炉于550℃灼烧完全后质量的变化来计算.
1.3.4 牦牛MFGM蛋白的SDS-PAGE分析
将分离的牦牛MFGM用上样液稀释后,取10 μL上样于15%的SDS-PAGE,电泳槽开始电压稳定在85 V,进入分离胶后电压稳定在120 V,分离的蛋白用考马斯亮兰染色1 h,然后用脱色液(V(冰乙酸)∶V(无水乙醇)∶V(水)=100∶50∶850)进行脱色,最后经凝胶成像获得MFGM蛋白分离图.
1.3.5 牦牛MFGM蛋白的热稳定性
新鲜的牦牛奶脂肪经KCl洗涤1次后分别在40、50、60、70 和80 ℃加热 15 min,冷却至室温后按照1.3.1的方法提取分离牦牛MFGM,在提取过程中不再需要用KCl洗涤脂肪,目的是观察牦牛MFGM蛋白和牦牛乳中酪蛋白和乳清蛋白的相互作用.以不加热为对照组.分离的MFGM蛋白进行SDS-PAGE(质量分数分别为15%的浓缩胶和5%的分离胶)分析.
1.3.6 牦牛乳MFGM的氨基酸分析
应用日立835-50型氨基酸分析仪附可见光检测器进行氨基酸的测定.色谱条件:分析柱为150 mm,Φ4.0不锈钢柱(2169#树脂);去氨柱,120 mm,Φ4.0不锈钢柱(2150#树脂).泵1流速为0.55 mL/min(压力为90~140 kg/cm2);柱温58℃,反应盘温度100℃.采用外标法进行定量.样品制备采取蛋白质保护性氧化酸水解法.
2 结果与讨论
2.1 牦牛MFGM的分离及透射电镜
MFGM的分离主要有物理和化学分离两种方法,物理方法主要是分离的乳脂肪经过KCl洗涤后,通过反复的冷冻和溶解,最后通过搅打使MFGM从MFG上脱落并释放出来进入水相,再通过沉淀和高速离心收集MFGM.化学方法是通过利用极性对质子惰性溶剂、胆汁盐或非离子型洗涤剂使MFGM直接释放出来.但是直接提取可导致MFGM得率偏低,另外应用化学物质的浓度、提取的时间和温度也可以造成MFGM组分在一定程度上发生变化.
图1是牦牛乳脂肪洗涤前和洗涤后分离的MFGM蛋白的 SDS-PAGE图.可以看出,牦牛MFGM蛋白主要由一些分子质量较大的蛋白(47.8~225.6 ku)组成,主要有 5种:黏蛋白(MUC1),分子质量为225.6 ku,该蛋白的分子质量在牛奶、羊奶和牦牛奶中存在一些差别,不同品种的奶MFGM,该蛋白的分子质量可能不一样,但其范围在170~225 ku;黄嘌呤脱氢酶(XO),分子质量为157.4 ku,该物质有较强的抑菌作用;过碘酸稀夫III/IV的分子质量为78~98 ku,模糊的PAS III/IV蛋白条带显示了较低的浓度,主要是PAS III/IV蛋白与 MFGM结合较松,而且是MFGM的外围蛋白,很容易被KCl溶液洗涤下来而损失掉;嗜乳脂蛋白(BUT),分子质量为67.5 ku、类似的蛋白在母乳中也被分离和发现,分子质量在67~70 ku.过碘酸稀夫6(PAS6)和过碘酸稀夫7(PAS7),分子质量分别为50.2 ku和47.8 ku.
本实验对牦牛MFGM的分离采用物理分离法,图1(a),(b)是MFGM在分离之前未经过KCl洗涤脂肪和经过KCl洗涤脂肪3次后的MFGM蛋白的SDS-PAGE图.可以看出,未经过KCl洗涤脂肪分离的MFGM含有大量的酪蛋白,而经过KCl洗涤3次后的MFGM的酪蛋白含量明显减少.但是与MFGM结合较松的过碘酸稀夫Ⅲ(PASⅢ)和过碘酸稀夫Ⅳ(PASⅣ)经过KCl洗涤后含量有所下降.因此,KCl溶液洗涤3次比较合适.

图1 牦牛乳脂肪洗涤前后分离的MFGM聚丙烯酰胺凝胶电泳图
图2是牦牛MFGM的透射电镜图(TEM),可以看出,MFGM片段是折叠的和无规则的,在MFGM上还是结合了一部分酪蛋白胶束,虽然这种结合看起来是简单的物理结合,但酪蛋白也有可能与MFGM通过化学方法相互结合在一起.

图2 牦牛MFGM的透射电镜
2.2 牦牛乳MFGM的基本组成
牦牛MFGM的基本化学组成见表1,主要由蛋白质和脂类两大物质组成,其MFGM(干基)蛋白质质量分数为(0.27±0.01)g/g,脂质为(0.70±0.05)g/g,这两种物质占MFGM总质量分数的97.27%,这一结果与Kanno和 Kim报道的牛奶MFGM中的蛋白(28%)和脂质(64%)的质量分数基本一致[11].另外,牦牛奶 MFGM(干基)还含有(0.10±0.03)mg/g的己糖、(0.005±0.010)g/g的唾液酸和(0.006±0.010)g/g的灰分,其中唾液酸是一族神经氨酸(neuraminic acid)的衍生物,在脑的发育和维护细胞膜、膜受体以及亚细胞器的正常生理功能中起到重要作用[12].它参与细胞表面的多种生理功能,促进婴儿的记忆力和智力发育.大量的唾液酸存在于脑神经节苷酯中,也有一些存在于外神经系组织和体液中.记忆形成研究表明脑神经节苷酯中的唾液酸在信息的传递和储藏方面起着关键的作用[13].另外,唾液酸是构成细胞膜黏液素、糖蛋白和糖脂的主要成分.
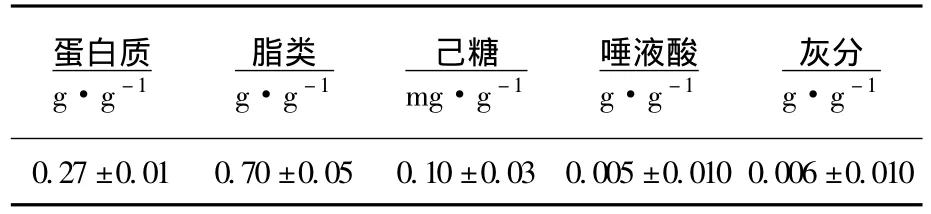
表1 牦牛MFGM的基本化学组成
2.3 牦牛MFGM蛋白的热稳定性
加热是奶加工过程中的一个很重要的环节,有必要研究热对牦牛MFGM蛋白稳定性的影响.牦牛奶脂肪经KCl洗涤1次后经不同温度加热后分离的MFGM蛋白的SDS-PAGE见图3.可以看出,当加热温度达60℃时,MFGM蛋白特别是黄嘌呤氧化酶(XO)、过碘酸稀夫6(PAS6)和过碘酸稀夫 7(PAS7)损失较大.过碘酸稀夫6(PAS6)和过碘酸稀夫7(PAS7)似乎迁移进入乳清中,但这种迁移机制至今不很清楚.可能是β-乳球蛋白和牦牛MFGM的复杂性改变了膜的结构和环境,导致 PAS6和 PAS7的迁移和损失[14].这种相对较温和的温度导致牦牛MFGM蛋白的损失还有待研究,然而,这种作用在40℃就能发生,原因可能是脂质相的熔点在大于40℃后导致脂肪球表面结构发生变化,使得MFGM蛋白损失[15].
从图3还可以看出,β-乳球蛋白在60℃没有损失,浓度反而有所增加,这主要是β-乳球蛋白与MFGM发生了结合.该结合温度低于β-乳球蛋白的解链温度(78℃),β-乳球蛋白与牦牛奶MFGM结合的机制还不很清楚,但这里似乎存在一些可能的途径.据牛奶 β-乳球蛋白与MFGM结合的文献可以推断出牦牛奶β-乳球蛋白与牦牛MFGM的结合可能通过巯基与二硫键的相互结合,或许是通过直接竞争或MFGM在加热过程中被破坏,留下了空隙使乳清蛋白吸附到新暴露的脂肪球表面而使得β-乳球蛋白的浓度不断增加[16-17].
同样,图3也显示了α-乳白蛋白在60℃也与牦牛MFGM发生了结合.也有一些关于牛奶中α-乳白蛋白与MFGM结合的报道,这种结合的发生同样可以用来推断牦牛奶α-乳白蛋白与牦牛MFGM的结合也可能是通过巯基二硫键的相互作用,该结合方式与β-乳球蛋白相似,但是牦牛奶中的酪蛋白在整个加热过程中几乎没有发生变化[18].
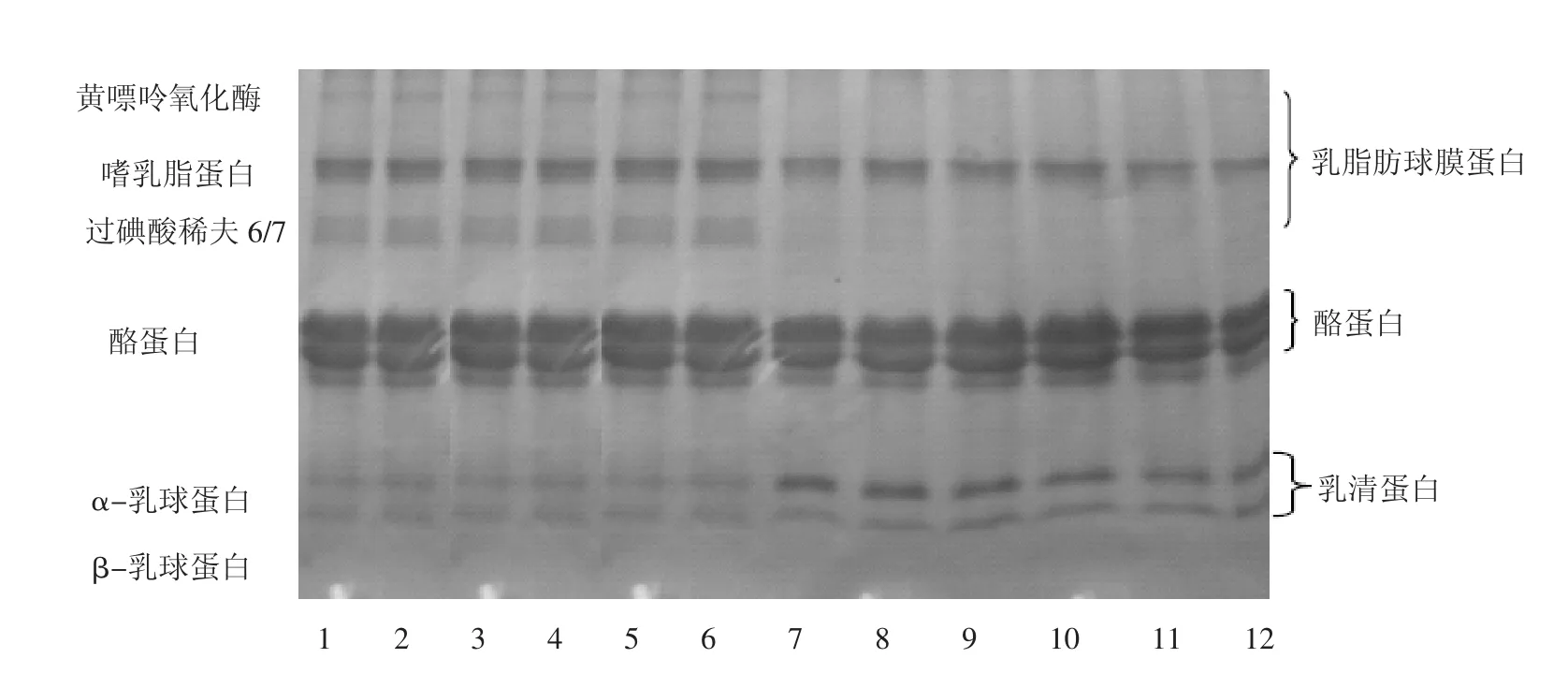
图3 牦牛奶脂肪在不同加热温度下分离的MFGM的SDS-PAGE图
2.4 牦牛MFGM的氨基酸组成
牦牛MFGM的氨基酸组成见表2,列出了牦牛MFGM的15种氨基酸质量分数.其中蛋白质量分数最高的氨基酸是谷氨酸(200.1 mg/g),其次是亮氨酸(110.8 mg/g),紧接着是丝氨酸(96.7 mg/g)、赖氨酸(82.6 mg/g)等,牦牛MFGM中的必需氨基酸占整个氨基酸的49.48%.非必需氨基酸占50.52%,两者之比接近于1.0,说明牦牛乳MFGM蛋白氨基酸组成比例较合理.

表2 牦牛MFGM蛋白的氨基酸组成
3 结论
1)采用物理方法对牦牛MFGM进行分离,KCl溶液洗涤3次效果较好.透射电镜(TEM)分析表明,MFGM片段是折叠的和无规则的,在MFGM上还是结合了一部分的酪蛋白胶束.
2)牦牛奶MFGM主要由蛋白质和脂类物质组成,其MFGM蛋白质质量分数为(0.27±0.01)g/g,脂质为(0.70±0.04)g/g,另外,牦牛MFGM还含有(0.09±0.02)mg/g的己糖、(0.005±0.010)g/g的唾液酸和0.006±0.010 g/g的灰分.
3)牦牛MFGM蛋白中的黄嘌呤氧化酶(XO)、过碘酸稀夫6(PAS6)和过碘酸稀夫7(PAS7)加热到60℃损失较大.另外,β-乳球蛋白和α-乳白蛋白在60℃开始与牦牛MFGM结合,随着温度升高,结合量不断增加.
4)牦牛奶中主要的氨基酸是谷氨酸、亮氨酸、丝氨酸、赖氨酸等,其中必需氨基酸占整个氨基酸的49.48%.
[1]MARIE-CAROLINE M,MICHEL O.Native fat globules of different sizes selected from raw milk:thermal and structural behavior[J].Chemistry and Physics of Lipids,2004,132:247-261.
[2]KOEN D,ROELAND R,NATACHA T,et al.Nutritional and technological aspects of milk fat globule membrane material[J].International Dairy Journal,2008,18:436-457.
[3]BERTRAM Y F,CARMEN S N,ALASTAIR K H,et al.Protein and lipid composition of bovine mmilk-fatglobule membrane [J].International Dairy Journal,2006,17:275-288.
[4] HARJINDER S.The milk fat globule membrane-A biophysical system for food applications[J].Current Opinion in Colloid& Interface Science,2006,11:154-163.
[5]SPITSBERG V L,GOREWIT R C.Isolation,purification and characterization of fatty-acid-binding protein from milk fat globule membrane:effect of bovine growth hormone treatment[J].Pak J Nutr,2002(1):43 -48.
[6]ITO O,KAMATA S,HAYASHI M,et al.Inhibitory effect of cream and milk fat globule membrane on hypercholesterolemia in the rat[J].Anim Sci Technol,Japan,1992,63:1022-1027.
[7]SPITSBERG V L,GOREWIT R C.Anti-cancer proteins found in milk cals news[J].J Dairy Sci,1997,3(5):80-87.
[8]WANG X,HIRMO S,MILLENR,et al.Inhibition of helicobacter pylori infection by bovine milk glycoconjugates in a BALB/cA mouse model[J].FEMS Immunol Med Microbiol,2001,20:275 -281.
[9]VANIERM T,HOLM M,OHMAN R,et al.Developmental profiles of gangliosides in human and rat brain[J].Journal of Neurochemistry,1971,18:581 -592.
[10]DUBOIS K A,GILLES J K,HAMILTON P A,et al.Colorlmetric method for determination of sugars and related substances[J].Anal Chem,1956,28:350.
[11]KANNO C,KIM D H.A simple procedure for the preparation of bovine milk fat globule membrane and a comparison of its composition,enzymatic activities,and electrophoretic properties with those prepared by other methods[J].Agric Biol Chem,1990,54:2845 -2854.
[12]FERRARI G,BATISTATOU A,GREENCE L A,et al.Gangliosides rescue neural cells from death after trophic factor deprivation[J].Neurosci,1993,13:1879 -1887.
[13]KARIM M,WANG Bing.Is sialic acid in milk food for the brain[J].Perspectives in Agriculture,Veterinary Science,Nutrition and Natural Resources,2006(1):1-11.
[14]HE Shenghua,MA Yang,WANG Jiaqi,et al.Characterization of fat globules and milk fat globule membrane proteins in milk of different yak breeds[J].Dairy Science and Technology,2010,90(5):601-609.
[15]KEENA T W,DYLEWSKI D P.Intracellular origin of milk lipid globules and the nature of structure of milk fat globule membrane,advanced dairy chemistry, lipids Vol.2[M].London:Chapman & Hall,1995.
[16]MATHER I H.A review and proposed nomenclature for major proteins of the milk-fat globule membrane[J].Journal of Dairy Science,2000,83:203-247.
[17]DALGLEISH D G,BANKS J M.The formation of complexes between serum proteins and fat globules during heating of whole milk[J].Milchwissenschaft,1991,46:75 -78.
[18]YE A,SINGH H,TAYLOR M W,et al.Interactions of whey proteins with milk fat globule membrane proteins during heat treatment of whole milk[J].Lait,2004,84:269-283.
