丁酸梭菌对蛋用仔公鸡生长性能、免疫指标及空肠组织相关细胞因子基因mRNA表达的影响
刘亭婷 滑 静 王晓霞 刘莉如 海 鹏
随着抗生素作为饲料添加剂的广泛应用,它的弊端也逐渐被人们所认识,如导致动物胃肠道正常菌群失调,产生耐药性和药物残留等副作用,给畜禽和人类的健康都带来了危害,有些国家已从立法上限制了抗生素的使用。因此,寻求绿色、无公害并能够提高畜禽营养素利用率和免疫功能的添加剂越来越受到人们的关注。研究发现,微生态制剂能够提高饲料报酬、促进动物生长、降低幼畜禽死亡率、防治消化道疾病等[1]。丁酸梭菌是普遍存在于人和动物肠道内的一种益生菌,丁酸梭菌代谢可以产生丁酸,从而抑制肠道有害菌生长和繁殖,同时刺激黏膜免疫;还可以产生B族维生素、维生素K、叶酸和多种酶类物质等,对机体有重要的生理功能。目前,对该菌的研究主要集中在人的腹泻、炎症性肠病的防治与预防上,然而,在动物,尤其在蛋用仔公鸡生产上应用的研究鲜有报道。本试验旨在通过在蛋用仔公鸡基础饲粮中添加丁酸梭菌,测定蛋用仔公鸡的生长性能、免疫器官指数和血清免疫指标等,来探讨该菌对生长和免疫的影响,并从分子水平探讨丁酸梭菌对机体细胞因子的影响机理,为其在家禽生产中的应用提供科学理论依据。
1 材料与方法
1.1 试验材料
丁酸梭菌由浙江惠嘉生物科技有限公司提供,其中活菌数≥1.0×108CFU/g。
1.2 试验设计与饲粮组成
试验采用单因子完全随机区组设计,选用1日龄健康的海兰褐蛋用仔公鸡240只,平均体重为(39.36±0.11)g,随机分为6组,每组4个重复,每个重复10只鸡。对照组饲喂基础饲粮,抗生素组饲喂在基础饲粮中添加150 mg/kg金霉素的饲粮,试验组饲喂分别在基础饲粮中添加250、500、750、1 000 mg/kg丁酸梭菌的饲粮。基础饲粮是根据美国NRC(1994)推荐的肉仔鸡营养需要配制的玉米-豆粕型饲粮,其组成及营养水平见表1。
1.3 饲养管理
试验鸡采用3层笼养,自由采食和饮水,光照、温度和湿度严格按照常规饲养管理要求进行,按照常规免疫程序进行免疫,并定期清扫鸡舍和消毒保持鸡舍清洁卫生。试验期为42 d。
1.4 检测指标与方法
1.4.1 生长性能指标
试验鸡空腹12 h,以重复为单位分别在试验的第14、28和42天称重结料,并记录死亡鸡只数,及时结料用于计算平均体重(average body weight,ABW)、平均日采食量(average daily feed intake,ADFI)、平 均 日 增 重 (average daily gain,ADG)和料重比(f eed/gain ratio,F/G)。
1.4.2 免疫器官指数
于试验的第42天对试验鸡无菌采样,每个重复随机取1只鸡称重后屠宰,屠宰时采血,制备血清,样品于-20℃保存待测。摘取胸腺、脾脏和法氏囊,剔除脂肪后称鲜重。用所得的免疫器官重与体重的比计算免疫器官指数[公式:免疫器官指数(g/kg)=免疫器官重(g)/体重(kg)]。
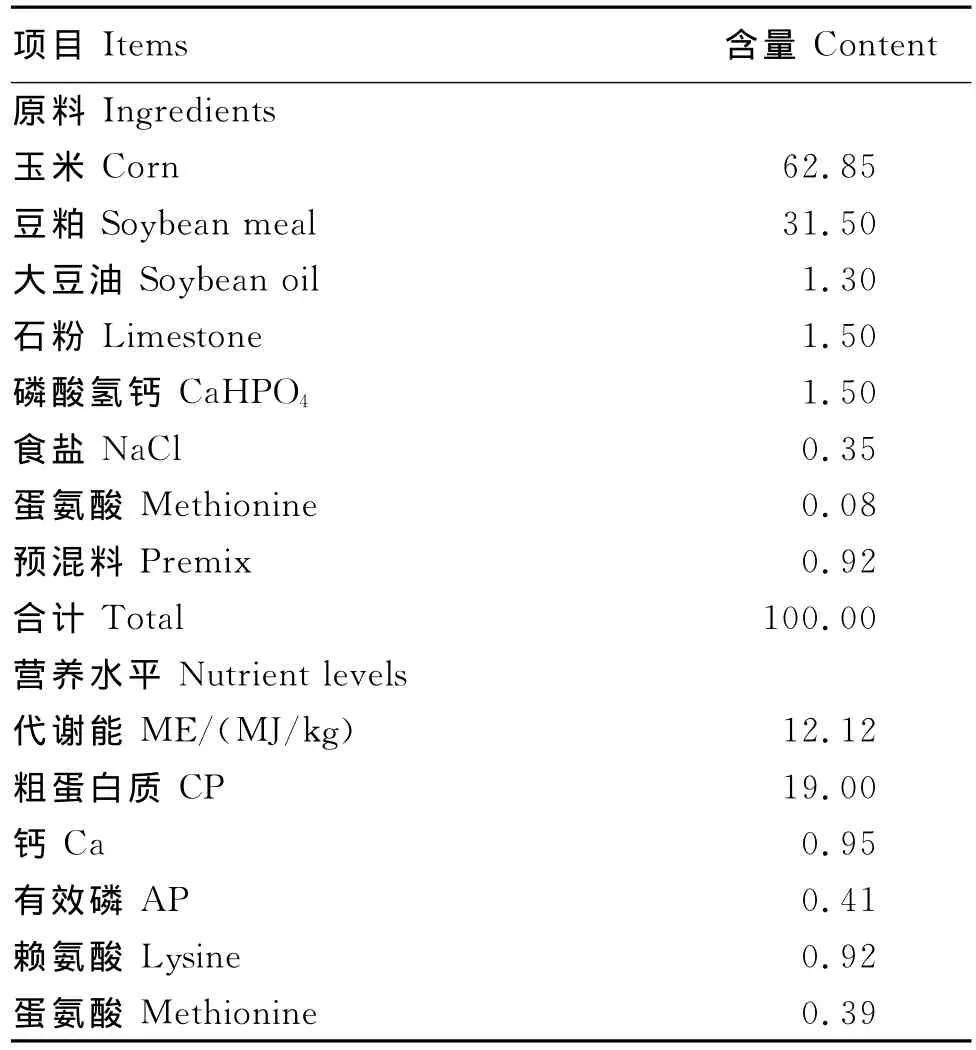
表1 基础饲粮组成及营养水平(风干基础)Table 1 Co mposition and nutrient levels of the basal diet(air-dry basis) %
1.4.3 血清免疫指标
血清中的免疫球蛋白G(Ig G)、免疫球蛋白A(Ig A)和免疫球蛋白M(Ig M)含量采用免疫透射比浊法进行测定,补体3(C3)、补体4(C4)含量采用ELISA试剂盒检测,溶菌酶活性测定采用比色法,所用试剂盒均购于北京康源瑞得生物技术有限公司。
1.4.4 空肠组织中相关细胞因子的基因mRNA相对表达水平
1.4.4.1 引物设计与合成
根据Gen Bank公布的鸡基因序列设计引物如表2,引物由北京优博奥生物技术有限公司合成。
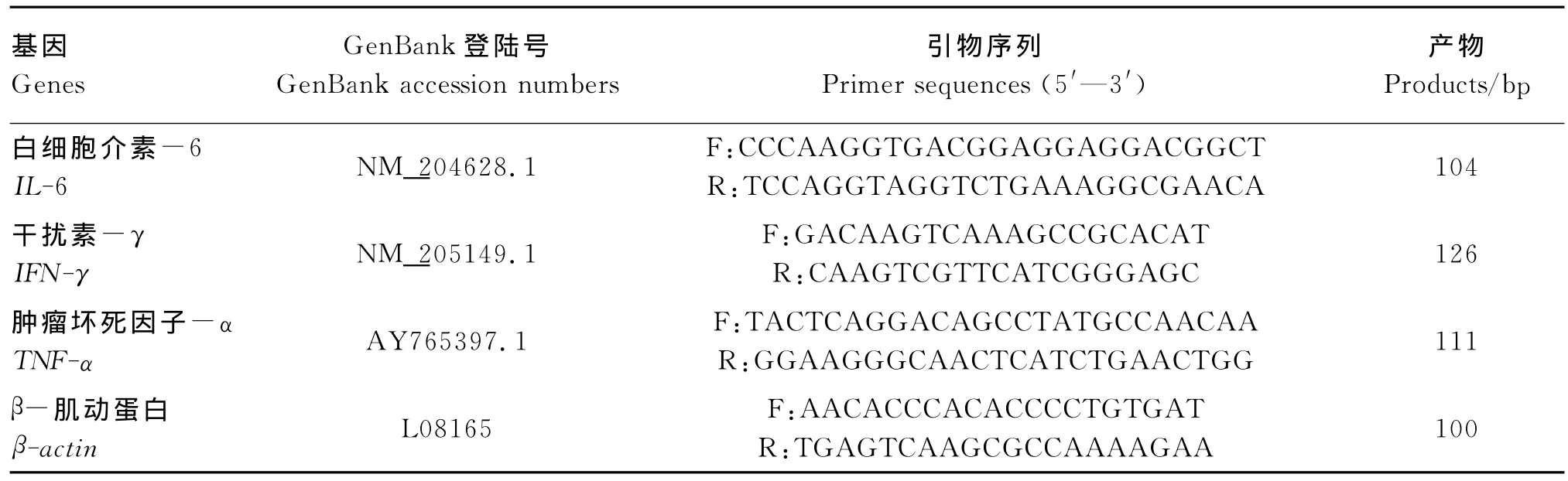
表2 实时荧光定量PCR引物序列Table 2 Pri mer sequences f or fluorescence-based quantitative real-ti me PCR
1.4.4.2 组织样本总RNA的提取和反转录
用超纯 RNA提取试剂盒(CWbio.Co.,Ltd.,Cat#CW0581)提取组织样本中总 RNA。操作按照产品说明书进行。对所提取的RNA进行检测,判断有无污染。c DNA合成按Hi Fi-MMLV c DNA第1链合成试剂盒(CWbio.Co.,Ltd.,Cat#CW0744)说明书操作。
1.4.4.3 实时荧光定量PCR扩增条件
采用20μL反应体系:Real SYBR Mixture(2×)10μL,10μmol/L上、下游引物各0.4μL,c DNA 2μL,加入去离子水至20μL。反应条件:95℃10 min,(95℃15 s,60℃60 s)×40个循环。
1.4.4.4 标准曲线绘制
本试验以逆转录的c DNA作为待测基因的标准品,制作各自的标准曲线。具体方法如下:取逆转录的c DNA样本,进行5倍梯度稀释,每个稀释度设3组重复,进行实时荧光定量检测,采用2-△△Ct法分析待测空肠组织中相关细胞因子白细胞介素-6(IL-6)、干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)的基因mRNA相对表达水平。
1.5 数据统计和处理
所有试验数据均用Excel进行初步处理,应用SPSS 17.0软件进行统计分析,用one-way ANOVA比较各组间相关指标的差异,采用最小显著级差法对差异显著的数据进行多重比较。试验数据均以平均值±标准误表示。
2 结 果
2.1 饲粮中丁酸梭菌水平对蛋用仔公鸡生长性能的影响
由表3可知,蛋用仔公鸡在1 4日龄时500 mg/kg 添 加 组、750 mg/kg 添 加 组、1 000 mg/kg添加组的平均体重显著高于对照组(P<0.05),750 mg/kg添加组为最大值,但与其他试验组间差异不显著(P>0.05),各试验组与抗生素组相比也差异不显著(P>0.05)。28日龄时,1 000 mg/kg添加组的平均体重显著高于对照组和抗生素组(P<0.05),42日龄时,显著高于对照组(P<0.05)。
试验期间,平均日增重最高的是1 000 mg/kg添加组,比对照组高出10.26%(P<0.05),其他各组间差异不显著(P>0.05)。
各组的平均日采食量、料重比均差异不显著(P>0.05),但各试验组平均日采食量随着饲粮中丁酸梭菌添加量的增加有增加的趋势,料重比则有下降的趋势。
2.2 饲粮中丁酸梭菌水平对蛋用仔公鸡免疫器官指数的影响
所有屠宰的蛋用仔公鸡免疫器官外观均未见异常。由表4可知,42日龄时,各试验组胸腺指数均在一定程度上高于对照组,但差异不显著(P>0.05),各试验组之间也差异不显著(P>0.05),但胸腺指数随着饲粮中丁酸梭菌添加量的增加而呈现出递增趋势。
1 000 mg/kg添加组的脾脏指数最高,比对照组提高了24.87%(P<0.05),比抗生素组提高了10.55%(P>0.05),其他各试验组也比对照组略有升高,但与对照组和抗生素组均差异不显著(P>0.05)。
各组之间的法氏囊指数均差异不显著(P>0.05)。
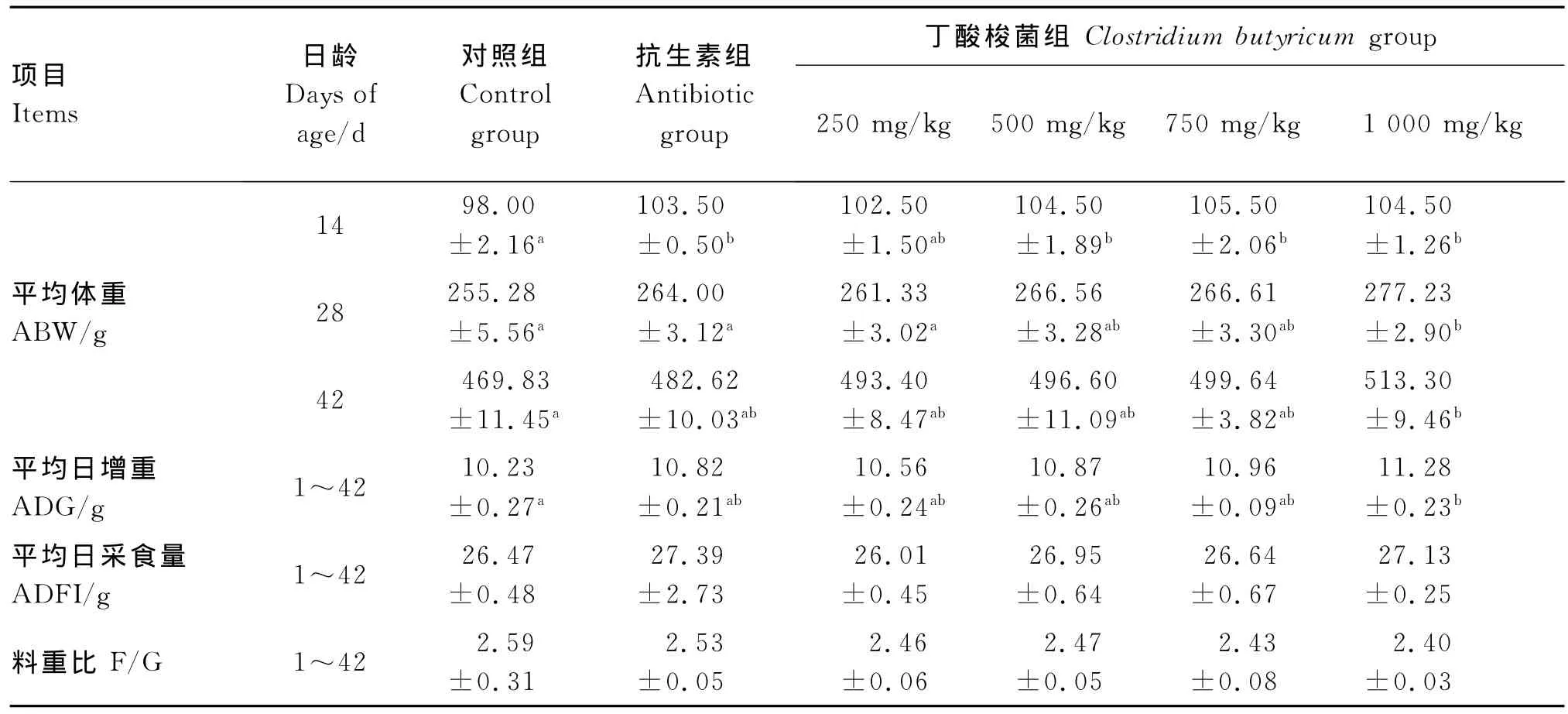
表3 饲粮中丁酸梭菌水平对蛋用仔公鸡生长性能的影响Table 3 Effects of dietar y Clostridiu m butyricu m level on gr owth perf or mance of egg-laying male chicks
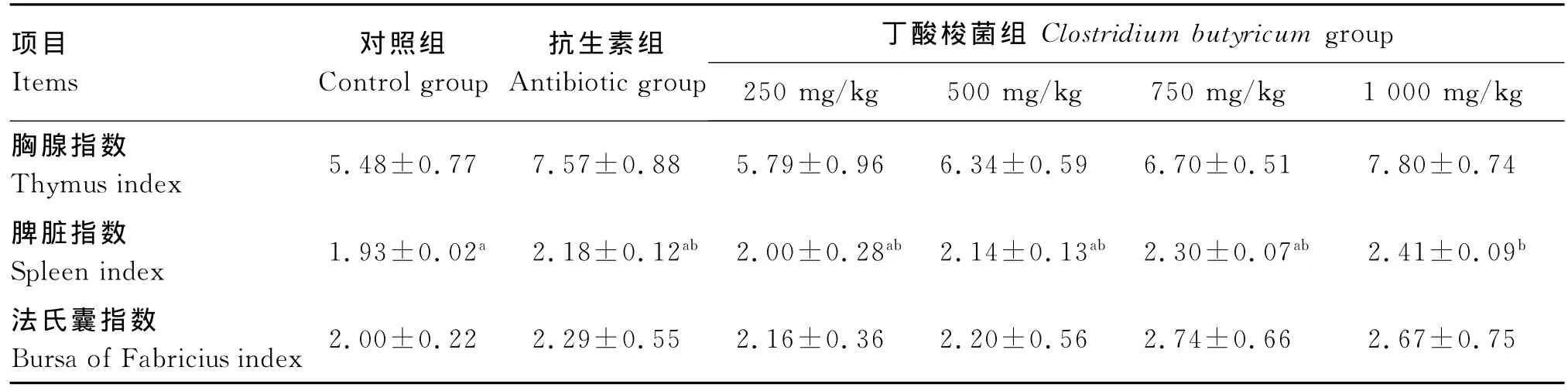
表4 饲粮中丁酸梭菌水平对42日龄蛋用仔公鸡胸腺、脾脏、法氏囊指数的影响Table 4 Effects of dietary Clostridiu m butyricu m level on the indices of thy mus,spleen and bursa of Fabricius of egg-laying male chicks aged 42 days
2.3 饲粮中丁酸梭菌水平对蛋用仔公鸡血清免疫指标的影响
由表5可知,随着饲粮中丁酸梭菌添加量的增加,检测的蛋用仔公鸡各项血清免疫指标均有增加的趋势。1 000 mg/kg添加组对试验期各免疫指标的影响最大。
42日龄时,各添加组血清Ig G的含量与对照组相比均显著提高(P<0.05),750 mg/kg添加组、1 000 mg/kg添加组血清Ig G的含量与抗生素组相比均有提高,差异显著(P<0.05),试验组中血清Ig G含量最高的是1 000 mg/kg添加组,与250 mg/kg添加组、500 mg/kg添加组相比差异显著(P<0.05)。
1 000 mg/kg添加组血清Ig A的含量最高,显著高 于 对 照 组 和 抗 生 素 组 (P<0.05),与250 mg/kg添加组、500 mg/kg添加组相比也均差异显著(P<0.05),但与750 mg/kg添加组相比差异不显著(P>0.05)。
各试验组血清Ig M含量与对照组和抗生素组相比差异不显著(P>0.05)。
血清C3含量的检测结果显示,各试验组血清C3含量与对照组相比显著提高(P<0.05),除250 mg/kg添加组外,其余各试验组血清C3含量与抗生素组相比也显著提高(P<0.05),其中1 000 mg/kg添加组血清C3含量最高,比对照组提高62.82%,比抗生素组提高51.18%,各试验组之间差异不显著(P>0.05)。
血清C4的含量随着丁酸梭菌添加量的增加有增加趋势,但组间差异不显著(P>0.05),与对照组相比也均差异不显著(P>0.05)。
各试验组血清溶菌酶活性与对照组相比均略有提高,但差异不显著(P>0.05)。
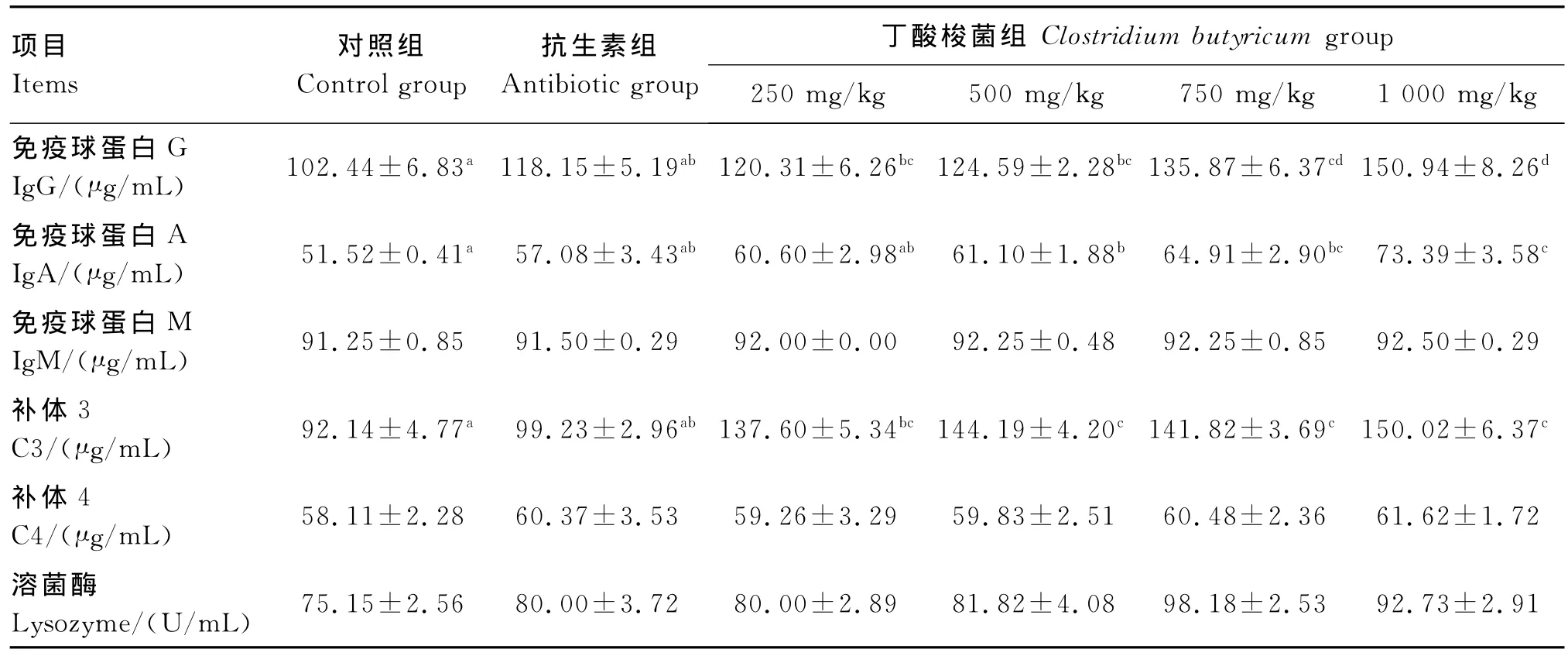
表5 饲粮中丁酸梭菌水平对42日龄蛋用仔公鸡血清Ig G、IgA、Ig M、C3、C4含量和溶菌酶活性的影响Table 5 Effects of dietary Clostridiu m butyricu m level on the contents of Ig G,Ig A,Ig M,C3 and C4 and the activity of lysozy me in ser u m of egg-laying male chicks aged 42 days
2.4 饲粮中丁酸梭菌水平对蛋用仔公鸡空肠组织中IL-6、IFN-γ 及 TNF-α mRNA 相 对 表 达水平的影响
由表6可知,关于42日龄时蛋用仔公鸡空肠组织中IL-6 mRNA相对表达水平,750 mg/kg添加组、1 000 mg/kg添加组与对照组相比显著降低(P<0.05),与 抗 生 素 组 均 差 异 不 显 著 (P>0.05),250 mg/kg添加组、500 mg/kg添加组与对照组和抗生素组均差异不显著(P>0.05),各试验组之间差异也不显著(P>0.05)。
关于IFN-γmRNA相对表达水平,各试验组与对照组和抗生素组相比均差异不显著(P>0.05),各试验组之间也差异不显著(P>0.05),但随着饲粮中丁酸梭菌添加量的增加,蛋用仔公鸡空肠组织中IFN-γmRNA相对表达水平呈现下降的趋势。
关于TNF-αmRNA相对表达水平,1 000 mg/kg添加组最低,与对照组相比差异显著(P<0.05),比对照组降低了45.91%,与抗生素组差异不显著(P>0.05),其余各试验组与对照组和抗生素组均差异不显著(P>0.05),各试验组之间也差异不显著(P>0.05)。
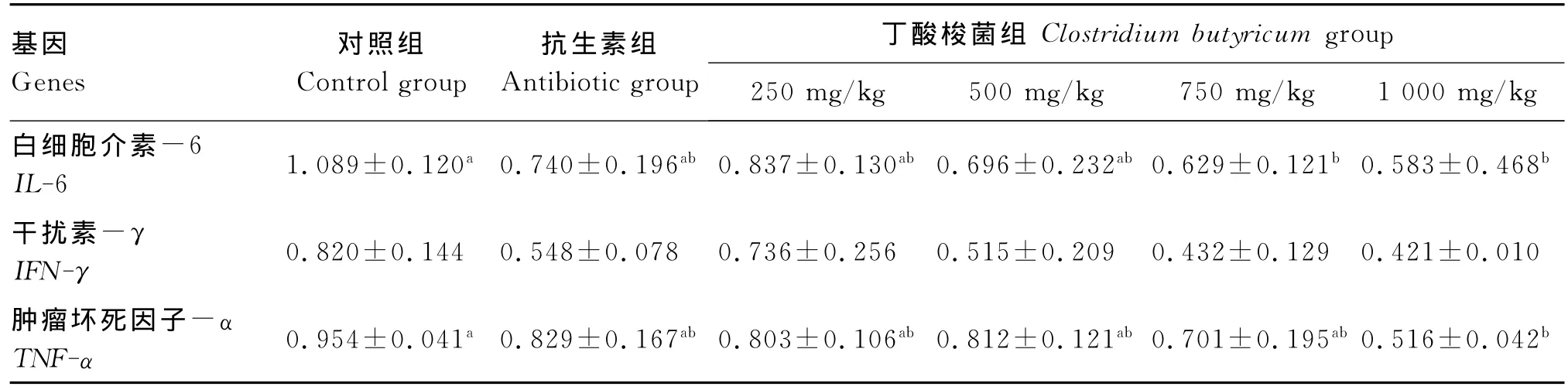
表6 饲粮中丁酸梭菌水平对42日龄蛋用仔公鸡空肠组织中IL-6、IFN-γ及TNF-αmRNA相对表达水平的影响Table 6 Eff ects of dietary Clostridiu m butyricu m level on IL-6,IFN-γand TNF-α mRNA relative expression levels in jejunu m tissue of egg-laying male chicks aged 42 days
3 讨 论
3.1 饲粮中丁酸梭菌水平对蛋用仔公鸡生长性能的影响
畜禽平均日增重和料重比是反映丁酸梭菌饲喂效果的重要指标。丁酸梭菌的促生长作用已经被很多试验证实。杜云平等[2]研究表明,基础饲粮中添加0.3%的丁酸梭菌制剂能够改善肉鸡的生产性能,有提高日增重、降低料重比的趋势,还有效预防了肠炎的发生,提高了肉鸡的抗病力和免疫力。杨欣[3]在不同油脂类型饲粮中添加丁酸梭菌饲喂肉仔鸡,显著降低了肉仔鸡盲肠食糜p H,显著增加了盲肠乳酸杆菌数,同时还显著增加了盲肠中丁酸、乙酸、戊酸及总短链脂肪酸含量和空肠黏膜碱性磷酸酶活性,这表明丁酸梭菌可以提高肠道食糜中主要代谢产物丁酸的含量,降低p H,进而抑制大肠杆菌等有害菌生长,促进乳酸菌等有益菌的繁殖,并进一步增加其他短链脂肪酸的含量,从而改善肠道环境,起到促生长的作用。Araki等[4-6]报道,丁酸梭菌在肠道内能产生丁酸、B族维生素、维生素K、叶酸等物质,对机体具有保健作用,还能产生淀粉酶、蛋白酶、纤维素酶等,这些酶系有重要的生理功能,这可能也是丁酸梭菌改善动物生长性能的机理之一。本试验结果表明,丁酸梭菌添加水平为1 000 mg/kg时,平均日增重最高,料重比最小,说明适宜的丁酸梭菌添加水平对蛋用仔公鸡的生长性能有一定的促进作用。但蛋用仔公鸡42日龄时体重总体上偏低,推测可能在试验后期饲养环境温度较高,超过了生长适宜温度范围,仔公鸡采食量下降,导致42日龄时平均体重偏低。
3.2 饲粮中丁酸梭菌水平对蛋用仔公鸡免疫器官指数的影响
胸腺、脾脏和法氏囊是禽类的重要免疫器官。胸腺和法氏囊是鸡的中枢免疫器官,胸腺参与机体非特异性免疫,对细胞免疫以及体液免疫都有重要的调节作用。法氏囊是禽类特有的,是B细胞分化成熟的场所。脾脏是禽类最大的外周免疫器官,是机体细胞免疫和体液免疫的中心,是产生致敏淋巴细胞和抗体的重要场所。上述3个器官的发育状态和机能强弱直接影响家禽全身的免疫水平。一般认为免疫器官质量增加是由于其自身细胞生长发育和分裂增殖所致,是免疫增强的表现,免疫指数的提高表明该器官成熟快。本试验的结果表明,42日龄时,蛋用仔公鸡的胸腺指数和法氏囊指数与对照组均差异不显著,但随着饲粮中丁酸梭菌添加量的增加均有升高的趋势,1 000 mg/kg丁酸梭菌添加组的脾脏指数,虽与抗生素组相比差异不显著,但显著高于对照组,这表明丁酸梭菌对蛋用仔公鸡生长发育前期的免疫器官发育有积极作用,能够促进仔公鸡免疫系统发育,增强机体对外界刺激的抵抗能力,达到健康生长的目的。
3.3 饲粮中丁酸梭菌水平对蛋用仔公鸡血清免疫指标的影响
免疫是机体识别和排除抗原性异物、保持体内外平衡的生理反应。动物机体的免疫功能主要是通过免疫分子(免疫球蛋白、细胞因子和补体)来发挥作用,提高抗体免疫应答能力。免疫球蛋白(Ig G、Ig A、Ig M等)是主要的免疫分子。Ig G是单体免疫球蛋白,其血清含量远高于其他免疫球蛋白,且维持时间长,是机体抗感染的主要力量。Ig M产生时间最早,其调理、杀菌和凝集作用均强于Ig G,但半衰期短,作用范围窄,在感染早期起先锋免疫作用。Ig A是外分泌液中的主要免疫球蛋白,在保护肠道、呼吸道等抵抗微生物入侵方面起关键作用,能凝集颗粒性抗原和中和病毒。C3、C4是补体系统中含量最多、最重要的组成部分,对免疫功能起着重要的作用,它们在机体防御过程中可以通过调理吞噬、裂解细胞、清除免疫复合物等机理对病原微生物进行清除及活化炎性细胞对靶细胞的杀伤作用。溶菌酶主要由巨噬细胞分泌,是非特异性免疫的效应物,通过降解细菌多糖细胞壁杀灭细菌,保护机体免受感染[7]。
张彩云等[8]选用160头21日龄杜×长×大断奶仔猪作研究,结果表明,与对照组相比,饲粮中添加丁酸梭菌组血清中Ig G和C3含量显著提高,还具有提高血清Ig A含量的趋势。宋增福[9]的研究表明了丁酸梭菌对鮸鱼消化酶、体液免疫等方面的影响,该菌可以提高鮸鱼肠道消化酶、血清和体表黏液溶菌酶等的活性,增加血浆中的Ig M含量。上述报道与本研究相一致,本试验的结果表明,丁酸梭菌可以提高血清中Ig G、Ig A、C3的含量,1 000 mg/kg添加组显著高于对照组和抗生素组,说明一定剂量的丁酸梭菌可提高机体的体液免疫水平,改善蛋用仔公鸡免疫功能,增强疾病抵抗力。
3.4 饲粮中丁酸梭菌水平对蛋用仔公鸡空肠组织中IL-6、IFN-γ 及 TNF-α mRNA 相 对 表 达水平的影响
细胞因子包括淋巴因子、干扰素、白细胞介素、肿瘤坏死因子、趋势化因子等,主要是由免疫细胞分泌的能调节细胞功能的参与炎症反应、免疫反应、创伤愈合等过程的蛋白质和小分子多肽组成[10]。IL-6、TNF-α是黏膜免疫中介导炎症的细胞因子,在急慢性炎症反应中起重要作用,IFN-γ是获得性免疫的细胞因子,可介导获得性免疫的3个时相,使机体获得性免疫得到加强[11]。IL-6等前炎症细胞因子可促进免疫细胞增殖和分化,从而提高动物机体的抵抗力。有试验证明,丁酸梭菌对于葡聚糖硫酸钠(DSS)诱导的急性溃疡性结肠炎(UC)小鼠有治疗作用,可以抑制TNF-α的基因表达[12]。其实,在正常情况下,这些细胞因子的过度分泌会对机体产生负面影响,即导致营养物质的重新分配,将用于维持生长和骨骼肌沉积的营养物质转向于维持免疫反应,从而降低营养物质的利用效率,最终影响机体生长[13]。这说明正常的生理情况下,没有病毒或其他诱生剂的作用,机体的免疫功能处于平稳状态,细胞因子的分泌受到一定程度的抑制,对于机体是有利的。本试验的结果表明,1 000 mg/kg丁酸梭菌添加组与对照组相比显著降低了IL-6和TNF-αmRNA相对表达水平,IFN-γmRNA相对表达水平与对照组差异不显著,但随着丁酸梭菌添加量的增加也呈现下降的趋势。分析其作用机理可能与丁酸的作用密不可分,丁酸梭菌的主要代谢产物是丁酸,丁酸能够促进动物肠道的上皮细胞繁殖,尤其对于炎症性肠疾病,具有肠道黏膜修复和逆转黏膜通透性增加的功能,并且丁酸能够刺激肠道黏膜免疫活性,影响参与免疫调节的某些细胞因子等[14-16]。另外一个原因可能是与其对肠道微生物群平衡的调整有关,益生菌的增加,导致致病菌和潜在致病菌无法或较少与肠黏膜接触,其启动下游事件的能力被降低,结果表现为各种促炎细胞因子、组织因子表达的下调,从而免疫功能增强,抑制炎症[17]。也有一些试验结果与本试验不一致,可能是由于各试验所使用的菌株、试验地点、试验时间(季节)、饲养条件、动物生理状态的不同而导致的。
4 结 论
① 本试验条件下,饲粮中添加适量丁酸梭菌可以促进蛋用仔公鸡的生长,提高平均体重和日增重,降低料重比。
② 饲粮中添加适量丁酸梭菌可以提高免疫器官指数,促进免疫器官发育;能够增加血清中Ig G、Ig A等免疫指标的含量,增强免疫功能。
③ 饲粮中添加适量丁酸梭菌可以降低空肠组织中IL-6、IFN-γ 及 TNF-α mRNA 相 对 表 达 水平,从而增强机体的免疫力,减轻肠道炎症的发生。
④ 本试验条件下,1 000 mg/kg的添加量效果最好。
[1] 李研东,韩雪,王颖,等.动物微生态制剂的研究进展[J].饲料研究,2008(2):22-24.
[2] 杜云平,周庆丰,郑泽铭,等.丁酸梭菌对肉鸡生产性能的影响[J].饲料广角,2009(22):22-34.
[3] 杨欣.丁酸梭菌与日粮油脂调控肉仔鸡肌肉品质的研究[D].博士学位论文.北京:中国农业大学,2010:43-50.
[4] ARAKI Y,ANDOH A,TAKIZA WA J,et al.Clostridiu m butyricu m,a pr obiotic derivative,suppresses dextran sulf ate sodium-induced experimental colitis in r ats[J].Inter national Jour nal of Molecular Medicine,2004,13:577-580.
[5] ARAKI Y,ANDOH A,FUJIYAMA Y,et al.Oral ad ministration of a pr oduct derived fr o m Clostridiu m butyricu m in rats[J].Inter national Jour nal of Molecular Medicine,2002,9:53-57.
[6] ARAKI Y,ANDOH A,FUJIYA MA Y,et al.Shortter m oral ad ministration of a product derived from a pr obiotic,Clostridiu m butyricu m induced no pathological effects in rats[J].Inter national Jour nal of Molecular Medicine,2002,9:173-177.
[7] 高俊.酵母培养物对肉仔鸡的作用及其机理[D].博士学位论文.北京:中国农业科学院,2008.
[8] 张彩云,刘来亭,杜灵广,等.酪酸芽孢杆菌对断奶仔猪生产性能和血清生化指标的影响[J].中国畜牧杂志,2009,45(13):43-45.
[9] 宋增福.丁酸梭菌C2菌株对鮸鱼肠道微生态调控作用与机理研究[D].博士学位论文.杭州:浙江大学,2006.
[10] 马双余,李爱民,李宗芳,等.门静脉高压症脾功能亢进与正常脾组织细胞因子表达差异的研究[J].中华普通外科学文献,2008,2(6):24-27.
[11] 宫德正,邹原,梅华.肠黏膜免疫系统与细胞因子[J].大连医科大学学报,2002,24(1):56-60.
[12] 刘凌云,左和宁,杨伟峰.联用乳酸杆菌和丁酸梭菌治疗小鼠溃疡性结肠炎的实验研究[J].实用预防医学,2009,16(4):1255-1258.
[13] 刘军,周安国,王之盛.日粮锌与蛋白质水平对断奶仔猪前炎症细胞因子和肠道黏膜免疫分子的影响[J].中国畜牧杂志,2010,46(5):24-28.
[14] VENKATRAMAN A,RAMAKRISHNA B S,PULIMOOD A B,et al.Increased per meability in dextr an sulphate colitis in rats:time course of develop ment and eff ect of butyrate[J].Scandinavian Jour nal of Gastr oenter ology,2000,35:1053-1059.
[15] SAKATA T.Sti mulatory eff ect of short-chain f atty acids on epithelial cell proliferation in the rat intestine:a possible explanation f or tr ophic eff ects of f ermentable fibre,gut microbes and luminal trophic f actors[J].British Jour nal of Nutrition,1987,58:95-103.
[16] SAKATA T.Sti mulatory eff ect of short-chain f atty acids on epithelial cell pr olif er ation of isolated and denervated jejunal seg ment of the rat[J].Scandinavian Jour nal of Gastr oenter ology,1989,24:886-890.
[17] 刘凌云,杨伟峰.联用乳酸杆菌和丁酸梭菌治疗小鼠急性溃疡性结肠炎的实验研究[J].实用医学杂志,2009,25(18):3019-3021.

