白介素-1β和肿瘤坏死因子-α在糖尿病视网膜病变患者血清中的表达及意义
苏宪 刘俊茹 张志红 耿韶辉 臧旭峰
糖尿病视网膜病变为微血管病变,其发病机制复杂,尚未完全明确,近年有观点认为其与炎性反应相关。将2010至2012年就诊于我院的30例糖尿病视网膜病变(DR)患者和30例无DR的2型糖尿病患者血浆中白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)的表达水平作对照,分析DR与炎性免疫反应的相关性,报告如下。
1 资料与方法
1.1 一般资料 选取患者2型糖尿病15年以上病史患者60例,诊断均以WHO标准(1999年),均行眼底荧光血管造影和彩色照片对照。依据“国际临床DR的严重程度分级标准”(2001)诊断DR 30例为DR组,男15例,女15例;年龄38~72岁,平均年龄56.6岁;其中非增殖性糖尿病视网膜病变(NPDR)患者12例,增殖性糖尿病视网膜病变(PDR)患者18例。未达到DR诊断标准30例为对照组,男15例,女15例;年龄44~70岁,平均年龄54.2岁。我院健康体检参与者30例为正常组,男15例,女15例;年龄40~65岁,平均年龄50.2岁。3组性别比、年龄等基本条件差异无统计学意义(P>0.05)。DR组与对照组病程差异无统计学意义(P>0.05)。所有参与试验者均排除高血压、冠心病、高脂血症、关节炎等慢性病。
1.2 血清IL-1β、TNF-α检测 采用ELIASA法检测3组患者血清中IL-1β、TNF-α的表达。操作按试剂盒说明书。
1.3 统计学分析计量资料以表示,组间比较用单因素方差分析和t检验,P<0.05为差异有统计学意义。
2 结果
对照组血清中IL-1β含量高于正常组,DR组血清中IL-1β含量高于对照组(P<0.05);对照组血清中TNF-α含量高于正常组,DR组血清中TNF-α含量高于对照组(P<0.05)。见表1。
表1 3组血清IL-1β、TNF-α含量比较n=30,μg/L,±s
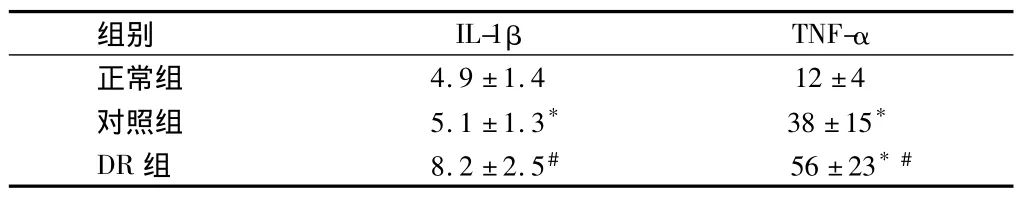
表1 3组血清IL-1β、TNF-α含量比较n=30,μg/L,±s
注:与正常组比较,*P <0.05;与对照组比较,#P <0.05
?
3 讨论
DR属于糖尿病性微血管病变,是糖尿病的严重并发症之一,双眼发病,如发现、治疗不及时,最终可治盲。近年随着我国经济发展,人民生活水平日益提高,2型糖尿病的患病率逐年增多,造成其并发症尤其DR的发病率上升。所以对DR的防治尤为重要。目前学者对于其复杂的发病机制正在进行研究,但目前尚无确切有效疗法。研究证明,DR过程具有特异性改变[1],现有观点认为:炎症及免疫反应作用于DR病变的始终[2]。故有人提出DR属于炎症性疾病[3]。糖尿病患者白细胞可黏附于视网膜微血管,使炎性介质活跃,发挥介导作用,引起一系列病理过程[3]。炎性介质一般分为细胞源性、血浆源性。细胞源性指与炎性反应相关的细胞因子,据其于炎性反应中作用不同,多分为5类,白介素-1β和TNF-α就是其中较重要的两种。IL-1β对细胞免疫的激活起调节作用,参与机体多系统,例如:炎性反应、造血系统、神经内分泌系统以及某些抗肿瘤生理过程。另外,IL-1β作用于视网膜色素上皮细胞,促使其合成胶原,形成胶原沉积,参与增生性糖尿病视网膜病变(PDR)的病理过程[4]。IL-1β能促使粒细胞透过血-视网膜屏障,进入视网膜,引起炎性反应[5]。有研究证实:IL-1β上调NF-kB,使视网膜毛细血管细胞凋亡加速,机体高糖环境加剧,试验将IL-1β受体拮抗剂应用于动物模型,可抑制DR进展[6]。但具体机制仍不明确。有研究证实:TNF-α激活单核巨噬细胞、成纤维细胞趋化作用。诱导使视网膜的间充质细胞形成胞外基质蛋白,为内皮细胞的移行提供支撑。增强内皮细胞黏附分子的表达。TNF-α可与血小板表面相应受体结合,促血管活性物质高表达,致白细胞大量聚集,从而使毛细血管发生闭塞和其他微血管并发症。TNF-α拮抗剂可竞争性与其受体结合,阻断TNF-α效应,降低糖尿病大鼠的视网膜血管中白细胞黏附作用[7]。抑制TNF-α表达可使视网膜毛细血管周细胞、内皮细胞凋亡减少76% ~80%[8]。有研究认为:TNF-α使神经鞘磷脂酶水解为胆碱和神经酰胺,胆碱和神经酰胺使胰岛素受体底物(IRS)-1丝氨酸磷酸化,抑制其酪氨酸磷酸化,降低胰岛素生物功能。并且,TNF-α可抑制和IRS-1相关磷脂酰肌醇-3(PI-3K)的活性,下调细胞中葡萄糖转运体-4的表达,抑制蛋白合成和转位[9]。TNF-α还可使脂肪细胞游离脂肪酸及瘦素等减少,降低胰岛素的敏感性。Gema等[10]在增殖性糖尿病视网膜病变患者的纤维血管组织血管壁、玻璃体和视网膜血管内皮细胞基质及胞外基质中均可发现TNF-α的作用,研究认为TNF-α抑制过氧化物酶增殖物的激活受体(PPAR)-γ的活性,PPAR-γ可增加肝脏脂肪酶活性,促进脂肪酸的氧化,使其进入血液降解,PPAR-γ在不同免疫细胞、血管壁细胞中表达,有抗炎和加速细胞凋亡作用。
本试验证实:IL-1β、TNF-α在DR患者血清中的含量高于无DR的2型糖尿病患者,2型糖尿病患者高于健康体检者。当前认为:炎性因素与糖尿病视网膜病变的全过程密切相关。因此,对于相关炎性细胞因子和其抑制剂、受体及炎性因子的信号转导通路等的深入研究,可进一步明确糖尿病视网膜病变的发病机制,为临床工作提供新的指导。
1 张承芬主编.眼底病学.第1版.北京:人民卫生出版社,1997.117.
2 Abu El-Asrar Am,Desmet S,Meersschaert A,et al.Expression of the inducible isoform of nitric oxide synthase in the retinas of human subjects with diabetes mellitus.Am J Ophthalmol,2001,132:551-556.
3 Adamis AP.Is diabetic retinopathy an inflammatory disease?Br J Ophthalmol,2002,86:363-365.
4 冯学峰,惠延年,王雨生.IL21β对人视网膜色素上皮细胞胶原合成的作用.第四军医大学学报,1999,20:656-658.
5 Jung YD,Liu W,Reinmuth N,et al.Vascular endothelial growth factor is up regulated by interleukin21β in human vascular smooth muscle cells via the P38 mitogen-activated p rotein kinase pathway.Angiogenesis,2001,4:155-162.
6 Kowluru RA,Odenbach S.Role of interleukin21β in the pathogenesis of diabetic retinopathy.Br J Ophthalmol,2004,88:1343-1347.
7 Joussen AM,Poulaki V,Mitsiades N,et al.Nonsteroidal anti inflammatory drugs prevent early diabetic retinopathy via TNF-α supp ression.The FASEB Journal,2002,16:438-440.
8 Behl Y,Krothapalli P,Desta T,et al.Diabetes enhanced tumor necrosis factor-α production promotes apop tosis and the loss of retinal microvascular cells in type 1 and type 2 models of diabetic retinopathy.Am J Pathol,2008,172:1411-1418.
9 Grigsby RJ,Dobrowsky RT.Inhibition of ceramide production reverses TNF-i nduced insulin resistance.Biochem Biophys Res Commun,2001,287:1121-1124.
10 Gema F,Javier GA,Fracisco JM,et al.To adiposite:a model for integration of endocrine and metabolic signaling in energy metabolism regulation.Am J Physiol Endocrinol Metab,2001,280:E827-E847.

