啤酒酿造废酵母H2O2氧化胁迫下细胞衍生物的研究
朱益波,朱明,朱雪
(1.常熟理工学院生物与食品工程学院,江苏常熟 215500;2.大富豪(常熟)啤酒有限公司,江苏常熟 215500)
啤酒酿造废酵母H2O2氧化胁迫下细胞衍生物的研究
朱益波1,朱明2,朱雪1
(1.常熟理工学院生物与食品工程学院,江苏常熟 215500;2.大富豪(常熟)啤酒有限公司,江苏常熟 215500)
为更好地利用大量的废啤酒酵母资源,研究了废酵母在H2O2氧化胁迫下形成的活酵母细胞衍生物(LYCD)的活性,优化了胁迫条件.研究结果表明:废酵母细胞经终浓度0.2 mmol/L H2O2胁迫15 min形成的促细胞生长活性最高,超氧化物歧化酶(SOD)活力是对照的18倍,丙二醛(MDA)含量约为对照的40%;SOD的活力与MDA含量呈现大致的反比关系;胁迫30 min,LYCD中还原型谷胱甘肽(GSH)是对照的2.7倍;活性物质的最高值并未在相同的胁迫条件下出现.
啤酒废酵母;活酵母细胞衍生物;氧化胁迫
酵母细胞在受到应激胁迫,比如紫外照射、高低温、氧化压力等刺激时,会启动多种应激机制产生多种活性物质以抵御不良环境的刺激[1].有学者将这些物质称为活细胞酵母衍生物(LYCD)[2],对于LYCD的研究表明,它主要由氨基酸、单糖、双糖、维生素和矿物质等活性物质组成.LYCD的应用研究表明其具备促进胶原和弹性蛋白的产生、加速伤口愈合的功能[3],以及能增加皮肤细胞中的新生蛋白质对水分吸收和促进细胞线粒体对氧的利用,使细胞的呼吸和能量代谢过程更为有效,因此LYCD在化妆品领域具有广阔的应用前景[4].目前国内关于LYCD的应用和机理研究主要侧重于应激培养条件对酵母细胞衍生物中相关活性成分的影响[4-8],以及活性物质中多糖的纯化和结构测定[9].我国现在已经是啤酒生产和消费大国,每年大量的啤酒废酵母没有得到综合利用而造成严重资源浪费和环境污染.目前关于利用啤酒废酵母细胞生产LYCD的研究还较少,主要是张健等人研究了废啤酒酵母在含重金属废液中培养啤酒酵母生产LYCD的工艺[10].本文旨在研究新鲜啤酒废酵母在H2O2的氧化胁迫下,活细胞衍生物的活性物质变化规律,摸索最适作用条件,为利用氧化压力胁迫啤酒废酵母生产LYCD提供参考依据.
1 材料与方法
1.1 主要材料与试剂
酿酒酵母:实验室保存,用于LYCD活性测定.
废啤酒酵母:大富豪(常熟)啤酒有限公司提供发酵后期沉降酵母,收集分装于无菌三角瓶后待用;
培养基:马铃薯培养基(PDA);
试剂:30%H2O2;无水乙醇;冰醋酸;邻苯二甲醛;连苯三酚;还原型谷胱甘肽;三氯乙酸;MDA测定试剂盒(南京建成生物工程研究所).
1.2 主要仪器与设备
JY-98-Ⅲ超声波细胞粉碎仪,宁波新芝生物科技股份有限公司;岛津RF-5301PC型荧光分光光度计;岛津UV-2550型紫外-可见光分光光度计;培养箱;水浴摇床;冷冻离心机.
1.3 方法
1.3.1 啤酒废酵母预处理
新收集的啤酒废酵母悬浮于预冷的无菌生理盐水,洗涤三次除去吸附于酵母表面的杂质.取清洗后的酵母细胞悬液25 ml分装于50 ml无菌离心管中,4℃、5000 r/min离心10 min,去上清液后冷藏保存待用.
1.3.2 H2O2半数致死浓度的测定
取一定量废啤酒酵母细胞悬液,加入一定量的H2O2,使其作用终浓度分别为0、0.2、0.4、0.6、0.8、1.0、1.2、1.6、2.0、2.5 mmol/L,28℃,150 r/min培养30 min后,样液用无菌生理盐水(0.9%)稀释相应倍数后,倾注培养计数法测定H2O2作用前后的活菌数量,计算存活率.以酵母细胞约50%致死时的H2O2浓度作为H2O2对酵母细胞的半数致死浓度.
1.3.3 LYCD的制备和活性测定
LYCD制备:取一定量废啤酒酵母细胞悬液,加入H2O2至相应浓度,28℃,150 r/min胁迫一定时间,离心(3500 r/min,10 min)收集菌体,并用无菌水洗涤一次,然后加入适量的马铃薯葡萄糖液体培养基,同上条件培养3 h,离心(3500 r/min,10 min)收集菌体,冰浴超声波破壁(工作时间3 s,间隙时间5 s,400 W,工作次数60)并用4℃的无菌水转移破碎物,经10000 r/min离心5 min后,取上清液,即为该H2O2胁迫作用条件下的LYCD.对照酵母细胞提取物(YE)除不进行氧化胁迫外其余操作同上.
LYCD活性测定:取一定体积培养到对数期的酿酒酵母细胞悬液,加入等体积的LYCD和马铃薯葡萄糖液体培养基,28℃,150 r/min培养1 h,测定培养前后OD256的变化,以此间接反映LYCD活性的大小.
1.3.4 LYCD中谷胱甘肽(GSH)含量测定
取新鲜制备的LYCD或YE,然后按照体积比1:10加入三氯乙酸(TCA),混匀,在冷藏箱内放置60 min,10000 r/min离心5 min,上清液即为所需的样品.然后按照文献[11]描述的方法测定GSH的含量.
1.3.5 LYCD中SOD酶活力测定:邻苯三酚自氧化法[12]
酶活性单位的定义为:每分钟抑制连苯三酚自氧化速率达50%时的酶量定义为一个活性单位.
1.3.6 LYCD中MDA的测定
参照MDA测定试剂盒中说明书进行.
2 结果与分析
2.1 H2O2胁迫最适条件分析
2.1.1 H2O2对废啤酒酵母半数致死浓度
为考察H2O2对于废啤酒酵母细胞的毒性,进而确定大致的处理浓度范围,故首先考察了在胁迫30 min下,处理浓度与酵母细胞存活率的关系.废啤酒酵母细胞存活率与H2O2处理浓度的关系如图1所示.由图可见随着加入H2O2浓度由0增加到0.8 mmol/L时,菌体的存活率迅速下降.当H2O2的作用浓度为0.6 mmol/L时细胞的存活率仅为44%,说明该处理浓度接近H2O2对酵母细胞的半数致死浓度.此实验结果表明相关处理浓度应该低于该半数致死浓度.
2.1.2 H2O2作用浓度及时间的优化
选用不同浓度(0、0.1、0.2、0.3、0.4、0.5 mmol/L)的H2O2作用于废酵母悬液,作用时间为30 min,离心终止作用后制备LYCD.然后测定其活性,实验结果见图2a.当作用浓度为0.2 mmol/L时所引起的酵母培养液的△OD256的值为0.375,达到最大值,即此时产生的LYCD的活性最强,所以,实验确定H2O2的最佳作用浓度为0.2 mmol/L.
然后以0.2 mmol/L的H2O2作用于废酵母悬液,作用时间分别为0、15、30、45、60 min,离心终止作用后制备LYCD.测定其活性,实验结果见图2b.处理时间为15 min提取的LYCD显著促进了酵母细胞培养液OD256的增加,达到了0.4,是对照样品的1.55倍.处理时间增加,促进效果开始下降,当时间延长到45 min时,获得的LYCD的相对活性和对照相当,说明过长时间处理对于LYCD的活性有显著影响,这可能与过长时间处理使得废啤酒酵母细胞大量死亡,无法产生抗逆性活性物质有关.另有研究表明当酵母细胞暴露于亚致死量外源H2O2中时,细胞膜会随着H2O2的适应性反应迅速发生变化,改变膜的成分,使膜的通透性发生改变,从而形成跨膜梯度,提高细胞对H2O2的耐受性[13].故也有可能是由于细胞膜成分改变导致跨膜梯度形成减少了H2O2对细胞的损害.综合图2的结果可认为H2O2处理浓度为0.2 mmol/L,处理时间15 min到30 min获得的LYCD活性较高.

图1 H2O2处理浓度对酵母细胞存活率影响
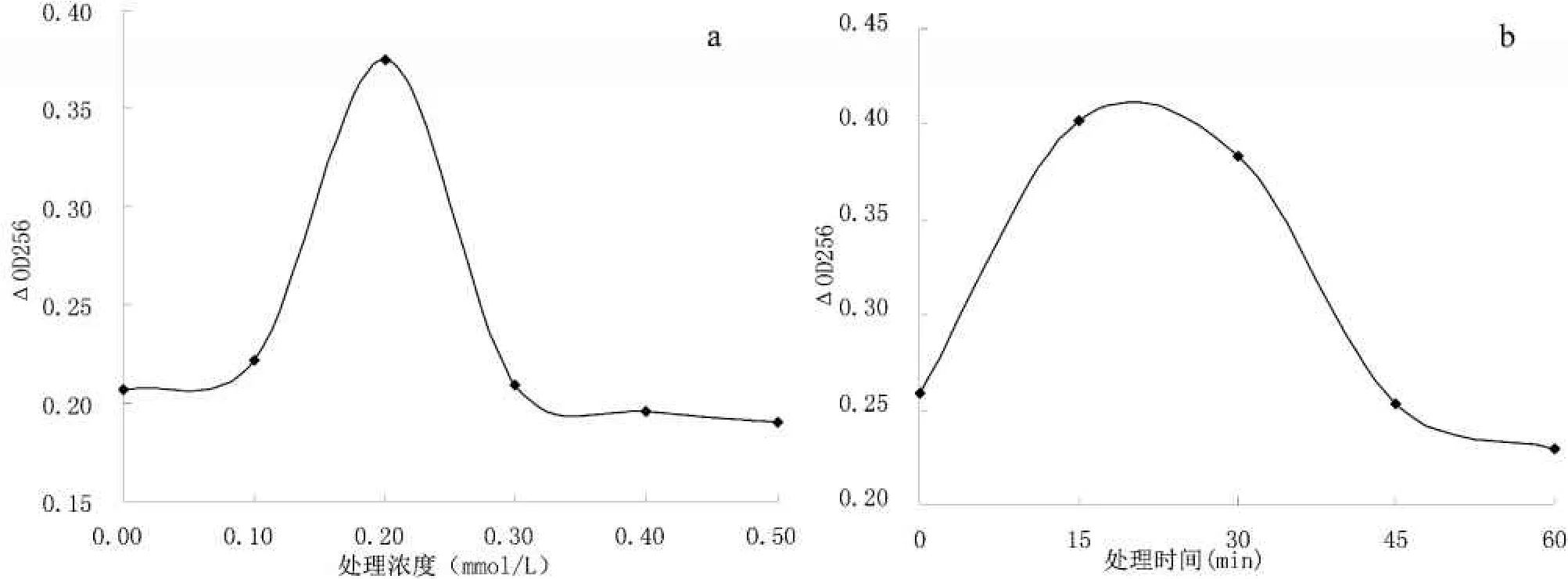
图2 处理浓度与时间对LYCD的影响
2.2 LYCD中活性物质的测定
2.2.1 GSH含量测定标准曲线及LYCD中GSH含量分析
配制好的标准溶液,室温放置40 min后,进行荧光强度的测定(40 min到70 min内进行测定,数据标准偏差最小,数据未列出).以标准溶液的浓度为横坐标,荧光强度值为纵坐标,绘制标准曲线如图3所示.得线性回归方程为:Y=52.702X-0.2832,R2=0.999.标准曲线表明GSH的浓度在0.08 ug/mL到0.72 ug/mL之间时,其浓度与荧光强度值有很好的线性关系,可以作为计算样品中GSH含量的依据.
将0.2 mmol/L H2O2处理相应时间后新鲜制备的LYCD和YE经适当稀释,按照标准曲线的测定方法测定样品中GSH含量,所得结果如图4所示.由图可以看出0.2 mmol/L H2O2刺激30 min时,LYCD中的GSH含量高达15.2 ug/mL,而对照YE中的GSH含量仅为5.7 ug/mL(图中未列出),胁迫后细胞提取物中的GSH含量均高于对照YE中的GSH含量(即使作用时间60 min对应的GSH含量降低到7.1 ug/mL也明显高于对照的5.7 ug/mL).即经过H2O2刺激产生的酵母衍生物LYCD中的GSH含量要显著高于未经H2O2刺激处理的细胞提取物YE.众多研究表明,GSH具有抗氧化和清除体内自由基的功能.细胞在氧化及其他环境压力下会启动相应保护机制维持胞内稳定的氧化还原环境,而GSH就是其中一种非常重要的物质[14].本研究的结果表明废啤酒酵母细胞经过H2O2的胁迫,也可以通过激活体内的抗性机制产生GSH来抵御外界氧化压力.另外,在刺激时间为30 min时,GSH的含量要显著高于其他作用时间所产生的量,这可能是基于以下两个原因:一是该测定方法是测定还原型谷胱甘肽的含量,而在胁迫下可能一部分还原型谷胱甘肽已经变成氧化态,从而不能检测出;二是胁迫时间过短可能在细胞做出响应时,环境压力突然消失,而胁迫时间过长,细胞存活率低而导致GSH含量下降.具体是什么原因还需要进一步的实验加以验证.
2.2.2 LYCD中SOD活性分析
测定上述制备的LYCD中SOD总酶活,结果见图5.在H2O2胁迫不同时间后,细胞衍生物中SOD酶活性发生显著变化:胁迫10 min和15 min,SOD总活力分别迅速增加为对照的约14和18倍,刺激15 min制备的LYCD中SOD活力达到了最大值;胁迫时间超过15 min,细胞内的SOD活力又逐渐下降,刺激60 min,SOD总活性下降至仅有30 U左右.
有研究表明外源添加H2O2可以直接作用于细胞蛋白质或者跨过细胞膜后进一步与亚铁离子反应产生自由基,进而对胞内的蛋白质甚至DNA产生伤害[15].LYCD中SOD酶活性的显著变化表明细胞经H2O2的胁迫后,在细胞内产生大量自由基,并诱导了细胞内编码SOD基因的表达以消除胁迫产生的超氧阴离子自由基.而对于不同胁迫时间下SOD酶活性的变化原因可能与前面的分析类似.从图2,图4和图5的结果来看,SOD最高值出现在胁迫15 min后,GSH最高值为胁迫30 min后,而LYCD活力在胁迫15 min~30 min都维持在比较高的范围内.这一结果表明在不同的胁迫时间,细胞内抗氧化胁迫物质呈动态变化,GSH的含量和SOD的活力都是LYCD活力的组成部分.
2.2.3 LYCD中MDA含量分析
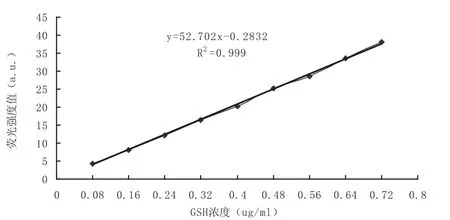
图3 荧光法测定GSH含量标准曲线

图4 处理时间对LYCD中GSH含量的影响

图5 处理时间对LYCD中SOD活性的影响
对于LYCD中MDA含量的测定结果见图6.从图可以看出,经0.2 mmol/L H2O2胁迫后的LYCD中的MDA含量明显要少于未经胁迫细胞提取物中的MDA含量.MDA是自由基作用于脂质发生过氧化反应的产物,通过MDA含量可以间接地反映机体受自由基损伤的程度,而SOD的活性则可间接地反映机体清除自由基的能力,结合图5可以看出,LYCD中的MDA含量与SOD的活性呈大致的反比关系,即在SOD的活性较高时MDA的含量较低,这也间接表明在H2O2胁迫下酵母细胞氧化应激反应主动地产生了抗氧化成分如SOD等来清除氧自由基以保护细胞免受氧化伤害.胁迫15 min时这种应激反应清除氧自由基的程度最大,此时MDA含量最少,约只有对照MDA含量的40%,这一点与此处理产生的SOD活性最强的结论是吻合的.

图6 处理时间对LYCD中MDA浓度的影响
3 结论
通过对LYCD中MDA、GSH和SOD这两种抗氧化成分结合LYCD活性的研究分析结果可得出以下结论:
(1)废啤酒酵母细胞在终浓度0.2 mmol/L H2O2环境中胁迫15 min,细胞产生的LYCD的活性最高;
(2)采用0.2 mmol/L H2O2胁迫废啤酒酵母细胞30 min,细胞在氧化应激反应中形成的GSH含量最高,约为对照的2.7倍;胁迫15 min,细胞内SOD活力最高,约是对照的18倍,对应的MDA含量只有约对照的40%;
(3)MDA含量与LYCD中SOD总活性大致呈反比关系,这表明SOD消除了氧自由基,进而减少了MDA的产生;
(4)LYCD的活性是各种应激活性成分(如GSH、SOD、多种活性蛋白和多糖等)所产生的综合效果,在氧化应激反应中,各活性成分并非同时达到活性最高值.
[1]赵华.UVB照射对酵母菌生理性能的影响与应用研究[D].天津:天津科技大学,2005.
[2]Bigbie RB SJ,Swaim SF,Purohit RC,et al.Effects of amnion and live yeast cell derivative on second-intention healing in horses[J]. Am J Vet Res,1991,52(8):1376-1382.
[3]Peter Bentley PTKH J,Jacqueline B Weiss,Christopher M Taylor,et al.Peptides From Live Yeast Cell Derivative Stimulate Wound Healing[J].Arch Surg,1990,125(5):641-646.
[4]代彦.UV照射对酵母生长的影响及酵母衍生物的制备[D].天津:天津科技大学,2004.
[5]白东清,王玉,路福平,等.低温和氧化应激产生活酵母细胞衍生物的研究[J].生物技术,2005(6):30-32.
[6]郭建辉.UVB照射对酵母生长的影响及活酵母细胞衍生物应用[D].天津:天津科技大学,2005.
[7]王玉.高渗、低温和氧化条件下酵母细胞应激产生活性物质的研究[D].天津:天津科技大学,2005.
[8]杨华.高温和氧化条件下酵母细胞应激产生活性物质的研究[D].天津:天津科技大学,2004.
[9]高艳玲,杨迪,张楠,等.LYCD中多糖的提纯、含量测定、组分分析和结构鉴定[J].食品研究与开发,2008(6):113-116.
[10]张健,冯学愚,刘小彬,等.抑制浓度下铅铜对啤酒废酵母产LYCD活力影响[J].食品研究与开发,2010(2):53-56.
[11]郭志英,任启伟,林琳.谷胱甘肽GSH/GSSG氧化还原态各指标的测定[J].济宁医学院学报,2007(1):36-38.
[12]崔喜艳.基础生物化学实验方法和技术[M].北京:中国林业出版社,1999.
[13]Zastawny TH,Altman SA,Randers-Eichhorn L,et al.DNA base modifications and membrane damage in cultured ma mmalian cells treated with iron ions[J].Free Radical Biology and Medicine,1995,18(6):1013-1022.
[14]Riccillo PM,Muglia CI,de Bruijn FJ,et al.Glutathione is involved in environmental stress responses in Rhizobium tropici,including acid tolerance[J].J Bacteriol,2000;182:1748-1753.
[15]孙廷丽,施庆珊,欧阳友生,等.过氧化氢诱导酿酒酵母细胞膜透性和组成的变化[J].生物工程学报,2009(12):1887-1891.
A Study on Cell Derivative of Waste Beer Yeast under H2O2Oxidative Stress
ZHU Yi-bo1,ZHU Ming2,ZHU Xue1
(1.School of Biotechnology and Food Engineering,Changshu Institute of Technology,Changshu 215500,China; 2.Dafuhao Brewery(Changshu)Ltd.,Changshu 215500,China)
For the purpose of utilizing abundant waste yeast resource,the activity of living yeast cell derivative (LYCD)from yeast cell under H2O2oxidative stress was studied.Results showed that:the activity of LYCD reached peak level after 15-minute stress with final concentration 0.2 mmol/L H2O2;Superoxide dismutase (SOD)activity was 18 times as high as that of the control,whereas malonaldehyde(MDA)concentration was about 40%of that in control;SOD activity and MDA concentration presented inverse ratio relationship;Reduced glutathione concentration was 2.7 times as high as that of control after 30-minute stress with final concentration 0.2mmol/L H2O2;The active substances in LYCD did not simultaneously reach the highest level.
waste yeast;living yeast cell derivative;oxidative stress
Q939.97
A
1008-2794(2012)10-0065-05
2012-09-15
江苏省高校自然科学研究计划资助项目“新型非降解技术提取啤酒酵母β-D葡聚糖的工艺研究”(08KJD180006)
朱益波(1980—),男,江苏靖江人,讲师,博士,研究方向:基因工程与发酵工程.

