吡格列酮对糖尿病大鼠肾脏TIMP-1、TGF-β1和PDGF-β表达的影响
熊盛池 谢 燕▲ 熊 利
1.四川省凉山彝族自治州第一人民医院内分泌科,四川西昌 615000;2.四川省喜德县两河口中心卫生院内科,四川喜德 615000
吡格列酮为噻唑烷二酮类降糖药,其作用机制是高选择性地激动过氧化物酶体增殖物激活受体γ(PPARγ),PPAR-γ的活化可调节许多控制葡萄糖及脂类代谢的胰岛素相关基因的转录,具有降糖、抗炎、改善脂质代谢、抑制细胞生长因子、降低尿蛋白排泄、增加胰岛素敏感性等重要作用。本研究以吡格列酮干预糖尿病(diabetic mellitus,DM)大鼠肾脏基质金属蛋白酶组织抑制因子(TIMP1)、转化生长因子(TGF-β1)和血小板衍生生长因子β(PDGF-β)的表达,以观察其对糖尿病大鼠肾脏保护的作用机制,为临床对糖尿病肾病的治疗提出良好的参考资料。
1 材料与方法
1.1 研究材料
1.1.1 动物 6~8周龄、体重180~200 g的健康雄性SD清洁级大鼠70只,全部购自重庆医科大学动物实验中心,许可证号SYXK(渝)2004008。
1.1.2 试剂 厄贝沙坦(杭州赛诺菲安万特民生制药有限公司,J20030113);吡格列酮(北京太阳药业有限公司,H20040267) ;PDGF-β兔多克隆抗体,购自武汉博士德生物工程有限公司;TIMP-1试剂盒,购自北京中杉生物技术有限公司;TGF-β1试剂盒,购自北京中杉生物技术有限公司。
1.2 方法
1.2.1 动物模型的制备 按参考文献[1]稍加修改建立模型。取SD大鼠60只禁食12 h后,按60 mg/kg左下腹腔注射链脲佐菌素(STZ),制造DM大鼠模型。实验期间给予足够的饮水,造模4 h后腹腔注射20%的葡萄糖3~5 mL,避免低血糖死亡,72 h后大鼠尾尖取血测空腹血糖,血糖≥16.0 mmol/L确定为DM成模大鼠。将成模大鼠随机抽样分成4组:吡格列酮组、模型组、吡格列酮+厄贝沙坦组、厄贝沙坦组各14只。同时取10只正常大鼠作为正常对照,腹腔注射等剂量无菌柠檬酸钠缓冲液,后在尾尖取血测血糖,血糖均在4.0~8.0 mmol/L。上述方法造模7 d后,吡格列酮组按15 mg/(kg·d)配以3~5 mL蒸馏水灌胃;厄贝沙坦组按50 mg/(kg·d)配以同等量蒸馏水灌胃;吡格列酮+厄贝沙坦组分别给予吡格列酮 15 mg/(kg·d)和厄贝沙坦50 mg/(kg·d)配以同等量蒸馏水灌胃,每日早晨8点~9点灌胃1次,模型组和正常对照组大鼠每日同一时间给予等量蒸馏水灌胃。对血糖≥20.0 mmol/L可能危及生存的大鼠皮下注射诺和灵N 2~3 U以防糖尿病酮症酸中毒死亡。大鼠自由饮水、进食,室温18~20℃,湿度60% ~70%,上述方法喂养12 周。
1.2.2 取材与固定 所有大鼠在喂养12周后空腹称重量,以3%水合氯醛10 mL/kg腹腔注射进行麻醉,腹主动脉取血以备行肾功能等生化检查,后剖腹分离双侧肾脏,每侧肾脏各取1/2肾组织放入4%多聚甲醛液固定保存24 h后脱水,石蜡包埋,切片,每片厚5 μm,行苏木精-伊红染色法(hematoxylin-eosin staining,HE)和免疫组织化学检测。其余肾脏标本用液氮冷冻保存,准备免疫蛋白印迹(Western blotting)等检测。
1.3 主要观察指标
(1)一般情况观察;(2)肾脏病理检查:处死大鼠时,肉眼观察肾脏外观情况,肾组织行HE染色;(3)肾组织TIMP-1,TGF-β1免疫组化染色(三步法);(4)Western blotting检测糖尿病大鼠肾组织PDGF-β蛋白。
1.4 统计学方法
2 结果
2.1 一般情况观察
DM大鼠均出现多尿、烦渴、多饮、体重减轻等糖尿病表现,部分大鼠有视力下降、皮肤溃烂和感染并发症。模型组症状及并发症最明显,实验期间有4只死亡;正常组无死亡大鼠,其余各组症状轻微,实验期间仅有2 只死亡,厄贝沙坦组和吡格列酮组各死亡1只。
2.2 各组大鼠肾脏组织病理学的特点
HE染色见模型组大鼠肾小球毛细血管基底膜增厚,系膜区有基底膜基质沉积,出现毛细血管袢折叠和融合,毛细血管阻塞。吡格列酮组、厄贝沙坦组和吡格列酮+厄贝沙坦组仅有毛细管基底膜增厚,系膜区有基底膜基质沉积,且明显轻于模型组。正常对照组大鼠肾组织结构无明显异常。见图1。
2.3 各组大鼠TIMP-1的表达
TIMP-1阳性染色主要位于肾小球毛细血管基底膜、系膜区、肾小管基底膜及毛细血管袢处。正常对照组大鼠肾小球毛细血管基底膜、系膜区、肾小管基底膜上皮细胞及毛细血管袢处仅有微弱表达,见图2。定量分析显示,模型组TIMP-1上述部位表达显著多于正常对照组,吡格列酮组、厄贝沙坦组和吡格列酮+厄贝沙坦组TIMP-1表达显著少于模型组,吡格列酮组+厄贝沙坦组表达减少较吡格列酮组和厄贝沙坦组更为明显,差异均有统计学意义(P<0.05),不过上述部位表达均多于正常对照组;吡格列酮组与厄贝沙坦组之间差异无统计学意义(P>0.05) 。
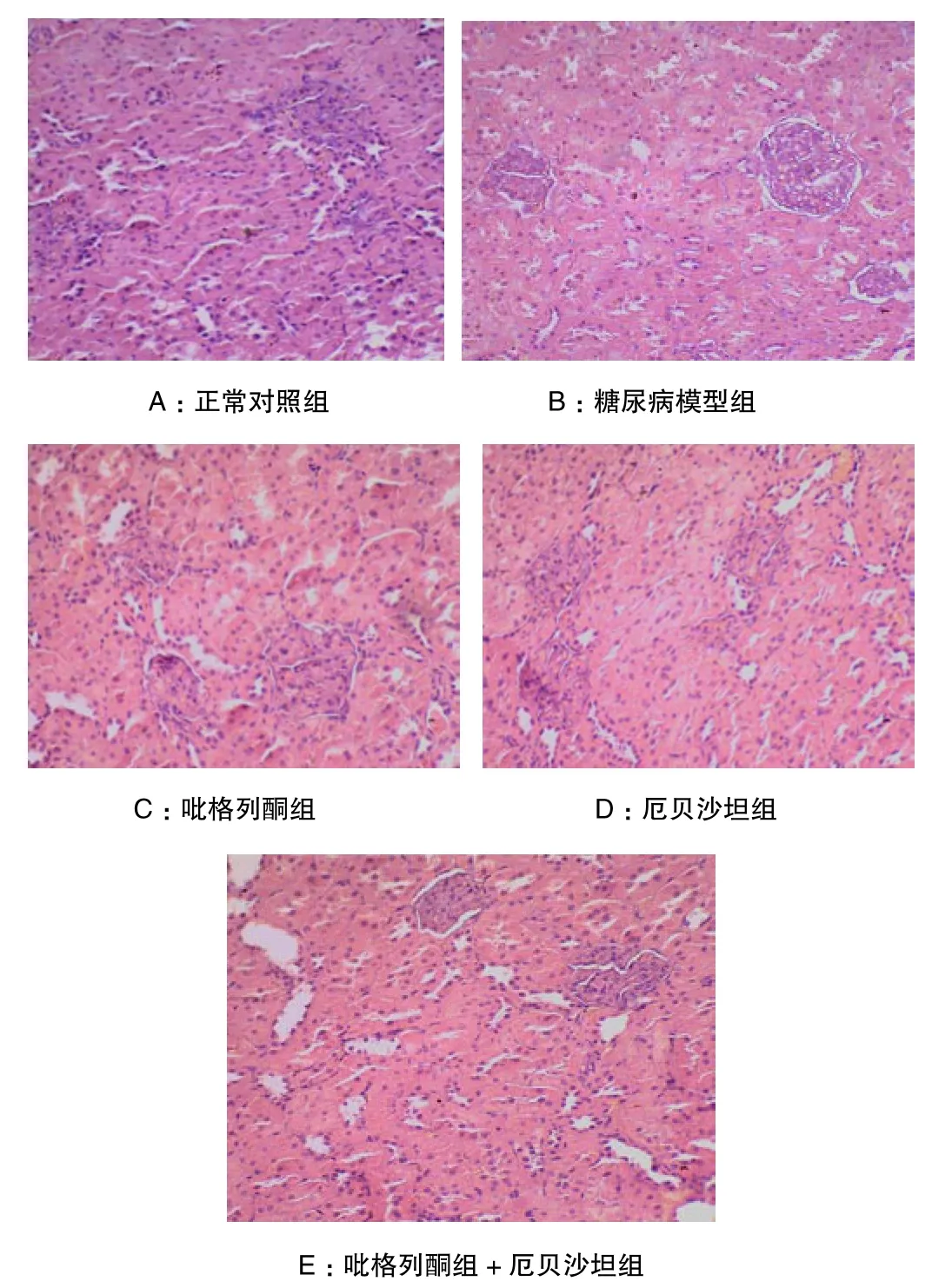
图1 A-E 各组大鼠肾脏HE染色(×200)

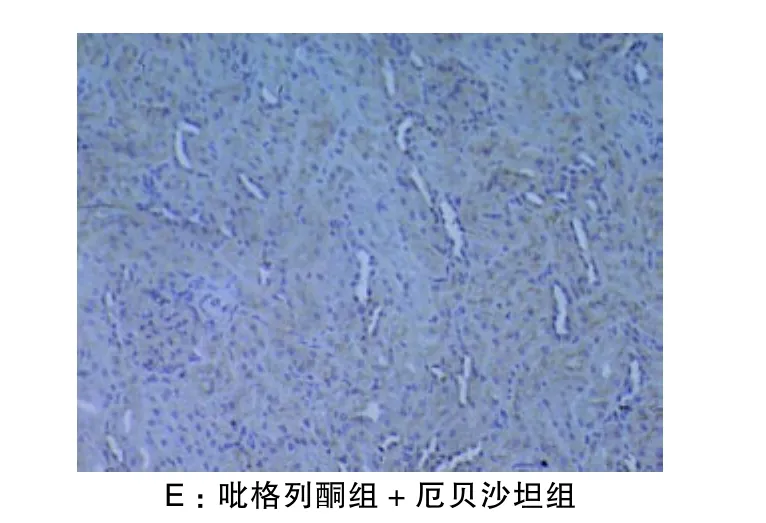
图2 A-E 各组大鼠肾脏免疫组化TIMP-1的表达(×200)
2.4 各组大鼠TGF-β1表达
糖尿病大鼠与正常对照组大鼠比较,前者肾小球脏层上皮细胞、毛细血管基底膜及系膜区肾小球上皮细胞、肾小管基底膜及及毛细血管袢TGF-β1均有明显表达,后者TGF-β1主要在肾小球脏层上皮细胞、毛细血管基底膜及系膜区有微弱表达。见图3。定量分析显示,模型组TGF-β1表达显著多于正常对照组,差异有统计学意义(P<0.05);厄贝沙坦组、吡格列酮组和吡格列酮+厄贝沙坦组TGF-β1表达显著少于模型组,差异有统计学意义(P<0.05);吡格列酮+厄贝沙坦组TGF-β1表达显著少于吡格列酮组和厄贝沙坦,差异有统计学意义(P<0.05),不过上述部位表达仍然多于正常对照组;厄贝沙坦组与吡格列酮组TGF-β1表达比较,差异无统计学意义(P>0.05)。见表1 。

图3 A-E 各组大鼠肾脏免疫组化TGF-β1的表达(×200)
表1 12周后各组大鼠肾脏组织TIMP-1和TGF-β1的表达(±s)
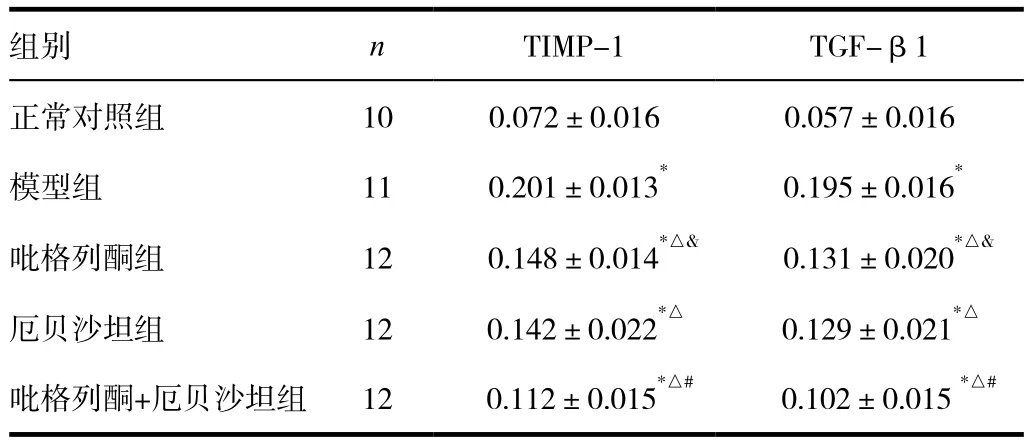
表1 12周后各组大鼠肾脏组织TIMP-1和TGF-β1的表达(±s)
注:与正常对照组比较,*P<0.05;与模型组比较,△P<0.05;与厄贝沙坦组比较,#P<0.01;与吡格列酮+厄贝沙坦组比较,&P<0.05
组别 n TIMP-1 TGF-β1正常对照组 10 0.072±0.016 0.057±0.016模型组 11 0.201±0.013* 0.195±0.016*吡格列酮组 12 0.148±0.014*△& 0.131±0.020*△&厄贝沙坦组 12 0.142±0.022*△ 0.129±0.021*△吡格列酮+厄贝沙坦组 12 0.112±0.015*△# 0.102±0.015 *△#
2.5 各组大鼠PDGF-β表达
Western blotting检测技术显示,模型组大鼠肾组织PDGF-β表达显著多于正常对照组,差异有统计学意义(P<0.05);正常对照组肾组织PDGF-β仅有微弱表达,厄贝沙坦组、吡格列酮组、吡格列酮+厄贝沙坦组PDGF-β表达显著少于模型组,差异有统计学意义(P<0.05);吡格列酮+厄贝沙坦组PDGF-β表达少于厄贝沙坦组、吡格列酮组,而多于正常对照组,差异有统计学意义(P<0.05);吡格列酮组与厄贝沙坦组PDGF-β表达比较,差异无明显统计学意义(P>0.05)。见图4、表2。
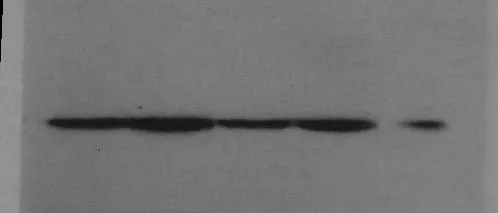
图4 各组大鼠肾脏Western blotting PDGF-β的表达(依次为厄贝沙坦组,糖尿病模型组,吡格列酮组+厄贝沙坦组,吡格列酮组,正常对照组)
表2 12周后各组大鼠肾脏组织PDGF-β的表达(±s)
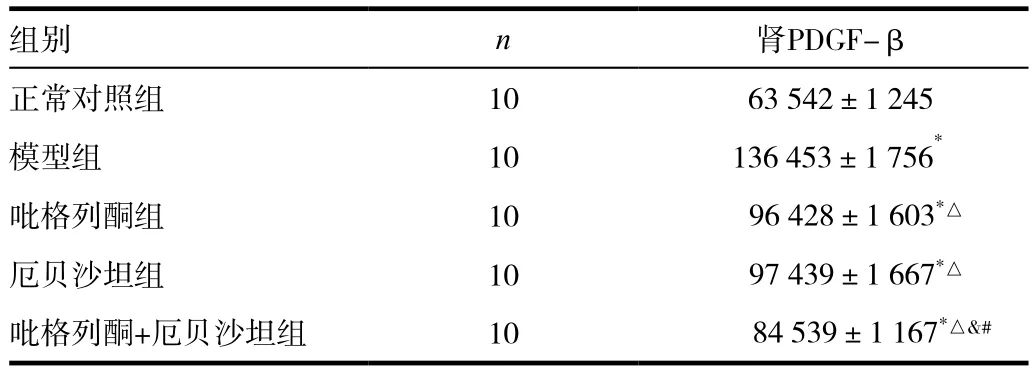
表2 12周后各组大鼠肾脏组织PDGF-β的表达(±s)
注:与正常对照组比较,*P<0.05;与模型组比较,△P<0.05;与厄贝沙坦组比较,#P<0.01;与吡格列酮组比较,&P<0.05
组别 n 肾PDGF-β正常对照组 10 63 542±1 245模型组 10 136 453±1 756*吡格列酮组 10 96 428±1 603*△厄贝沙坦组 10 97 439±1 667*△吡格列酮+厄贝沙坦组 10 84 539±1 167*△&#
3 讨论
TGF-β1是促纤维化最重要的因子之一,通过刺激细胞外基质的产生[2],抑制蛋白酶和胶原酶,减少基质的降解,使细胞外基质在肾脏大量沉积,进一步发展为肾组织纤维化。肾纤维化是细胞外基质过度沉积所致,但胶原的降解减少也是重要原因。细胞外基质由基质金属蛋白酶(MMPs)及其抑制因子TIMPs调节,前者的作用是降解胶原,而后者的作用恰恰是对抗MMPs,导致胶原的降解减少。所以增加MMPs或减少TIMP-1在肾组织的表达,均可使细胞外基质减少。因此TIMP-1对肾纤维化的形成有不容忽视的重要地位[3]。PDGF是一种潜在的促有丝分裂的细胞因子,主要分布于增生的毛细血管内皮细胞、成纤维细胞和增生的肾小球细胞。一旦受到病理刺激,特别是糖尿病的长期刺激,PDGF就在上述部位过度表达,促进系膜细胞增生和细胞基质沉积,进而引起肾纤维化,最终糖尿病肾病一步一步形成,以致终末期肾病,肾衰竭。实验表明糖尿病大鼠肾小球PDGF-β和PDGF-β受体表达均增加[4],PDGF-β链m RNA在糖尿病肾病小鼠肾组织中表达明显上调[5]。本研究中糖尿病大鼠肾组织PDGF-β表达增多,进一步肯定了这一研究。
近年来,随着罗格列酮争议不断,甚至于2010年9月23日已被FDA叫停,为了避免医患纠纷,大部分医务人员已经明显的减少了对该药的使用。吡格列酮为噻唑烷二酮类降糖药,药效肯定,价格低廉,在临床上广泛运用,不失为罗格列酮的绝佳替代品,最近的研究表明低剂量的吡格列酮长期治疗,可以显著改善糖尿病肾病患者的肾小球硬化和肾小管间质纤维化,延缓肾功能的恶化[6],达到治疗的目的。而这些作用均与吡格列酮的抗氧化、抗炎、抑制细胞生长因子、降低尿蛋白排泄率作用密切相关。吡格列酮已经被证实可以降低甘油三酯、增加高密度脂蛋白胆固醇(HDL-C)而调节脂质代谢,从机制上有可能延缓动脉粥样硬化的形成[7]。大量研究表明吡格列酮可以减少TGF-β1在肾小球和肾小管的表达[8]。同时吡格列酮可以减少TIMP-l在糖尿病大鼠心肌组织的表达,通过抑制心肌纤维化的形成来实现[9],就机制来说均是对组织纤维化的抑制,那么对肾组织纤维化的影响是不是一样的呢?本实验进一步肯定了这一论点。研究表明吡格列酮能减少或抑制PDGF-β在DM大鼠的肾小球和肾小管的表达,进而上调MMP-2的表达,抑制肾成纤维细胞IV型胶原的合成[10],改善高糖状态下的肾小球和肾小管间质的纤维化,调节肾组织细胞外基质的合成和降解,延缓糖尿病肾损害的进展,发挥肾脏保护作用。
[1] 李伟,张红,殷松楼,等.不同剂量链脲佐菌素诱导SD大鼠糖尿病肾病模型的研究[J].徐州医学院学报,2006,26(1):52-55.
[2] Nam JS,Cho MH,Lee GT,et al.The activation of NF-kappa B and AP-1 in peripheral blood mononuclear cells isolated from patients with Diabetic nephropathy[J].Diabetes Research Clinical Practice,2008,81(1):25-32.
[3] Suzuki D,Miyazaki M,Jinde K,et al.In situ hybridization studies of matrix metalloproteinase-3, tissue inhibitor of metalloproteinase-1 and type IV collagen in diabetic nephropathy[J].Kidney International,1997,52(1):111-119.
[4] Nakagawa H,Sasahara M,Haneda M,et al.Immunohistochemical characterization of glomerular PDGF-B chain and PDGF-B receptor expression in diabetic rats[J].Diabetes Research and Clinical Practice,2000,48(2):87-98.
[5] Uehara G,Suzuki D,Toyoda M,et a1.Glomerular expression of plateletderived growth factor (PDGF)-A, -B chain and PDGF receptor-alpha,-beta in human diabetic nephropathy[J].Clinical and Experimental Nephrology,2004,8(1):36-42.
[6] Toblli JE,Ferrini MG,Cao G,et al.Antifibrotic effects of pioglitazone on the kidney in a rat model of type 2 diabetes mellitus[J].Nephrology Dialysis Transplantation,2009,24(8):2384–2391.
[7] 赵红梅,吴铿.吡格列酮在抗动脉粥样硬化中的作用[J].中国全科医学,2010,5(2):555-557.
[8] 李红,郑芬萍,阮昱,等.吡格列酮对糖尿病大鼠肾皮质TGF-β1基因表达的抑制作用[J].中华内分泌代谢杂志,2003,19(3):238-239.
[9] 王绵,张力辉,邓永贵,等.2型糖尿病大鼠心肌组织MMP-2、MMP-9、TIMP-1的表达与胶原代谢的关系[J].中国糖尿病杂志,2006,14(2):133-136.
[10] 阮昱,李红,郑红平,等.吡格列酮对糖尿病大鼠肾脏转化生长因子β1及Ⅳ型胶原表达的作用[J].中华糖尿病杂志,2004,12(50):65-68.

