橙色大白菜遗传转化体系的初步建立
范爱丽,张鲁刚
(1.西北农林科技大学园艺学院/旱区作物逆境生物学国家重点实验室,陕西杨陵,712100;2.广西农业科学院蔬菜研究所)
橙色大白菜遗传转化体系的初步建立
范爱丽1,2,张鲁刚1
(1.西北农林科技大学园艺学院/旱区作物逆境生物学国家重点实验室,陕西杨陵,712100;2.广西农业科学院蔬菜研究所)
以06J28橙色大白菜子叶段为外植体,通过根癌农杆菌介导CMS7311-orf224基因,探讨了潮霉素、头孢霉素、预培养时间、农杆菌浓度、感菌时间和共培养时间等因素对橙色大白菜遗传转化的影响。试验结果表明,子叶段预培养2~3 d后,在OD600值为0.3~0.5的农杆菌EHA-105菌液中侵染5min,再共培养2~3 d,在培养基中加入5mg/L Hyg(抗性筛选)和500mg/LCef(脱菌)可得到转化植株。试验初步建立了橙色大白菜遗传转化体系,为大白菜种质资源创新奠定了基础。
橙色大白菜;CMS7311-orf224基因;遗传转化
利用DNA重组技术可使目标基因在不同植物间转移,突破了远缘杂交不亲和障碍,且保持了受体本身主要性状不被改变,然而遗传转化效率与植物基因型等密切相关。橙色大白菜口感好、营养丰富、抗病毒病等病害,商品性好,是适应性较广的彩色大白菜新品种[1]。但由于A基因型限制,大白菜在遗传转化中存在周期长、转化频率低及重复性差等问题,制约了转基因技术在大白菜育种中的应用[2,3]。本文在已建立的大白菜再生体系的基础上[4],通过根癌农杆菌介导CMS7311-orf224基因[5],研究潮霉素(Hygromycin B,Hyg)、头孢霉素(Cefotaxime,Cef)、预培养时间、农杆菌浓度、感菌时间和共培养时间等对橙色大白菜遗传转化的影响,初步建立橙色大白菜离体遗传转化体系,以期为创新大白菜种质资源和品种改良奠定基础。
1 材料与方法
1.1 试验材料
①植物材料、农杆菌菌株和质粒 植物材料为06J28橙色大白菜,取2片绿色子叶展平、第1片真叶未露出(播种5~6 d)的无菌苗;农杆菌菌株为EHA-105;质粒T-DNA区含有CaMV35S启动子所驱动的Hyg、GUS和CMS7311-orf224基因。
②培养基 无菌苗培养基:MS基本培养基中添加蔗糖30 g/L,琼脂7 g/L,pH值5.8;预培养培养基:7.0mg/L 6-BA+0.5mg/LNAA;共培养培养基:5.5mg/L 6-BA+0.5mg/LNAA+5mg/LHyg;筛选培养基:5.5mg/L 6-BA+0.5mg/L NAA+5mg/L Hyg+500mg/LCef;生根培养基:1/2 MS+0.5 mg/L NAA+5mg/L Hyg+500mg/L Cef;继代培养基:MS+500mg/L Cef;LB液体培养基:10 g/LTryptone(胰蛋白胨)+5 g/L Yeast extract(酵母提取物)+10 g/L NaCl,pH值7.0(固体培养基加5%的琼脂);农杆菌液体培养基:LB+60mg/L Rif(利福平)+ 50mg/L Str(链霉素)+50mg/L Kan(卡那霉素),pH值7.2(固体培养基加12.0mg/L的琼脂)。
1.2 试验方法
①外植体子叶段的获得 在无菌条件下,保留大白菜单片子叶,在生长点处(即子叶叶柄基部和下胚轴交接处)先横切,再纵切去除顶芽,同时切除此子叶顶端的1/3。
②农杆菌菌液的制备 从-80℃超低温冰箱中取出携带质粒CMS7311-orf224基因的EHA-105菌液,在冰上缓慢融化,然后在超净工作台上用接种环蘸取少量菌液,在添加Kan 50mg/L、Rif60mg/L和Str50mg/L抗生素的LB固体培养基上划线;28℃倒置培养48~36 h,菌斑出现后,挑取单菌落接种到含Kan 50mg/L、Rif 60mg/L、Str 50mg/L的LB液体培养基中 (pH值7.2),于28℃、200 r/min振荡培养过夜。取对数生长期菌液,在4℃、5 000 r/min条件下离心5 min,弃上清液,取沉淀重新悬浮于10倍MS液体培养基中(pH值5.3),振荡后稀释不同浓度作为侵染液。
③影响大白菜遗传转化主要因素的试验 A.Hyg选择压的确定。a.无菌条件下,将06J28子叶段分别竖直插入Hyg浓度为0,3,5,7,10 mg/L的芽诱导培养基上,观察不定芽分化对Hyg的敏感性,2周换1次培养基,统计芽分化数情况。b.无菌条件下,将06J28幼苗分别竖直插入Hyg浓度为0,3,5,7,10mg/L的生根培养基上,观察根系生长对Hyg的敏感性,2周换1次培养基,观察统计生根情况。
B.Cef抑菌剂浓度对抑菌和芽分化的影响。无菌条件下,06J28子叶段经农杆菌菌液 (OD600值为0.3~0.5)振荡侵染5 min后,将其取出用无菌滤纸吸干表面的菌液,竖直插入含不同浓度Cef(0,300,400,500,600mg/L)的芽诱导培养基上分化。每隔2周换1次培养基,观察抑菌情况和芽分化情况,筛选最适的Cef浓度。
C.预培养时间。无菌条件下,将06J28子叶段分别进行 0,1,2,3,4,5,6,7 d的预培养,后投入OD600值为0.3~0.5的菌液中,振荡侵染5min后,将其取出用无菌滤纸吸干表面的菌液,竖直插入共培养基上培养2 d后,再转接到芽诱导培养基上分化。每隔2周换1次培养基,统计抗性芽数,分析预培养时间对大白菜遗传转化的影响。
D.农杆菌浓度。制备好的菌液分别用MS液稀释至 OD600值分别为 0,0.1,0.3,0.4,0.5,0.6(OD600值为1时,菌液浓度约为8×108个/mL)。无菌条件下,06J28子叶段经预培养2~3 d后投入OD600值分别为0,0.1,0.3,0.4,0.5,0.6的菌液中振荡侵染5 min,然后取出用无菌滤纸吸干表面的菌液,竖直插入共培养培养基上培养2 d,再转接到芽诱导培养基上分化,每隔2周换1次培养基,统计抗性芽数,分析农杆菌浓度对大白菜遗传转化的影响。
E.侵染时间。无菌条件下,06J28子叶段经预培养 2~3 d后投入 OD600值为0.3~0.5的菌液中侵染,时间分别为1,5,10,15,20,25,30min,其间不停摇动。将侵染后的外植体取出,用无菌滤纸吸干表面菌液,竖直插入共培养基上培养2 d后,再转接到芽诱导培养基上分化,每2周换1次培养基,统计抗性芽数,分析侵染时间对大白菜遗传转化的影响。
F.共培养时间。无菌条件下,06J28子叶段经预培养2~3 d后投入OD600值为0.3~0.5的菌液中,振荡侵染5 min后,取出用无菌滤纸吸干表面的菌液,竖直插入培养基,在光下分别共培养0,1,2,3,4,5,6,7 d,然后再转接到芽诱导培养基上分化,每隔2周换1次培养基,统计抗性芽数,分析共培养时间对大白菜遗传转化的影响。
2 结果与分析
2.1 Hyg的敏感浓度筛选
①Hyg浓度对大白菜子叶段不定芽再生的影响 从表1可以看出,Hyg浓度越大,不定芽分化所需时间越长,芽的生长状况越差。当Hyg浓度低于5mg/L时有不定芽的分化,而当浓度高于7mg/L时无不定芽的分化。因此选择5mg/L为Hyg对子叶段不定芽诱导的临界点。
②大白菜幼苗生根的Hyg浓度筛选 从表2可看出,Hyg浓度越大,幼苗生长情况越弱,根系出现的时间越晚。当Hyg浓度为5mg/L时,根系生长受限,植株的生长也受到明显抑制,故选择浓度5mg/L为Hyg抑制大白菜幼苗根系生长的临界浓度。
2.2 Cef抑菌剂对抑菌效果和芽分化的影响
从表 3可以看出,Cef浓度为 300~600 mg/L时,浓度越大抑菌效果越明显,污染率也越低。当Cef浓度为500mg/L时,得到了最多的抗性芽。试验中观察到Cef浓度低于500mg/L时,促进不定芽发生,而Cef浓度超过500mg/L时对不定芽生长有一定抑制。综合考虑抑菌效果、污染率和获得的不定芽数认为,Cef最佳抑菌浓度为500mg/L。
2.3 预培养时间对大白菜遗传转化的影响
从表4可以看出,未进行预培养的大白菜子叶段有明显的农杆菌污染,而经1~7 d预培养的大白菜子叶段,随着预培养时间的延长,子叶段感染农杆菌的污染率显著降低,然而抗性芽并没有随之增加。综合比较得出,预培养子叶段2~3 d有利于大白菜遗传转化。

表1 Hyg浓度对大白菜子叶段不定芽再生的影响

表2 大白菜幼苗生根的Hyg浓度筛选
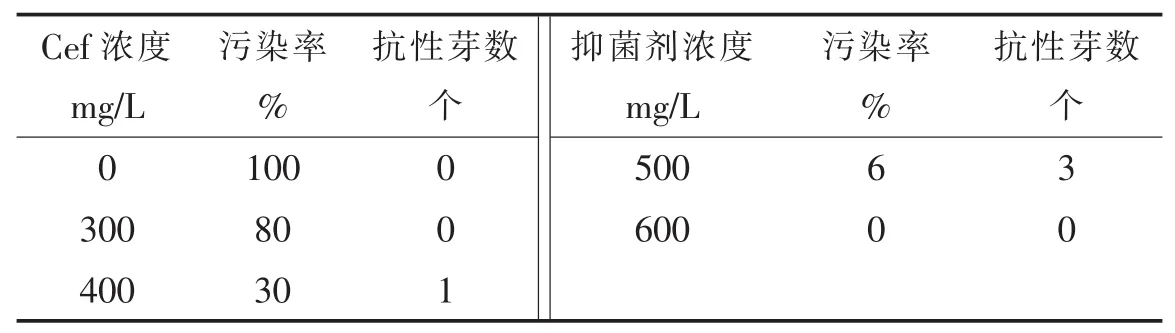
表3 不同Cef浓度的抑菌效果和对芽分化的影响
2.4 农杆菌浓度对大白菜遗传转化的影响
表5结果显示,农杆菌浓度过高或过低都不利于抗性芽再生,当OD600值低于0.1时没有抗性芽产生,OD600值高于0.7时观察到子叶段污染加重,伤口褐化,软腐增多,没有抗性芽生成。OD600值为0.3~0.5时,农杆菌对大白菜子叶段毒害程度最小,外植体无污染且有抗性芽再生,故最适的OD600值为0.3~0.5。
2.5 感菌时间对大白菜遗传转化的影响
从表6可以看出,农杆菌侵染时间短于5min时,子叶段无污染也没有抗性芽产生;侵染时间为5min时,子叶段无污染且有3个抗性芽产生;当侵染时间为10min时,虽有抗性芽产生,但是外植体有70%污染;侵染时间超过20 min,子叶段全部污染导致死亡。故以5min的侵染效果为最优。
2.6 共培养时间对大白菜遗传转化的影响
从表7看出,共培养1~4 d获到1~3个抗性芽,无污染的情况下共培养时间为2~3 d时抗性芽最多。试验中观察到,随着共培养时间的延长,农杆菌过度生长,外植体受感染和褐化严重,再生困难,同时后继培养中抑菌相当困难。故共培养的最佳时间为2~3 d。
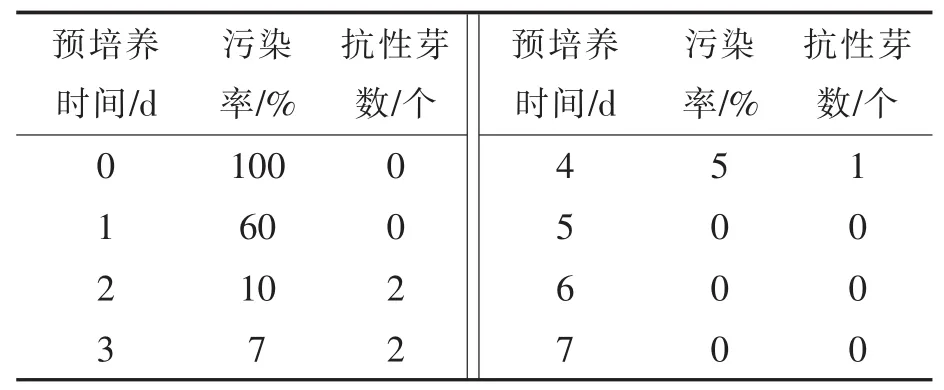
表4 预培养时间对大白菜遗传转化的影响
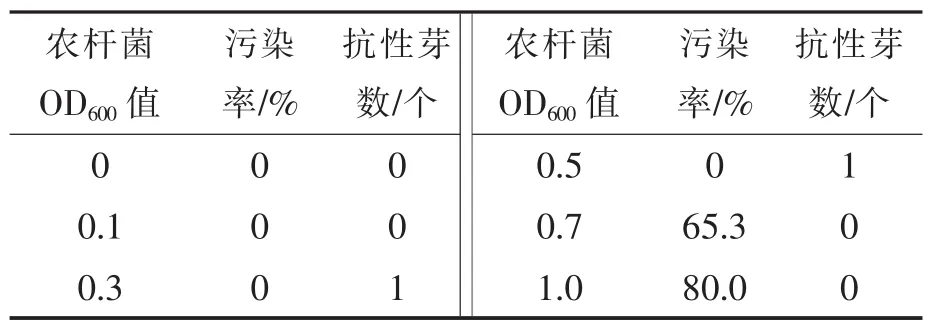
表5 农杆菌浓度对大白菜遗传转化的影响

表6 感菌时间对大白菜遗传转化的影响
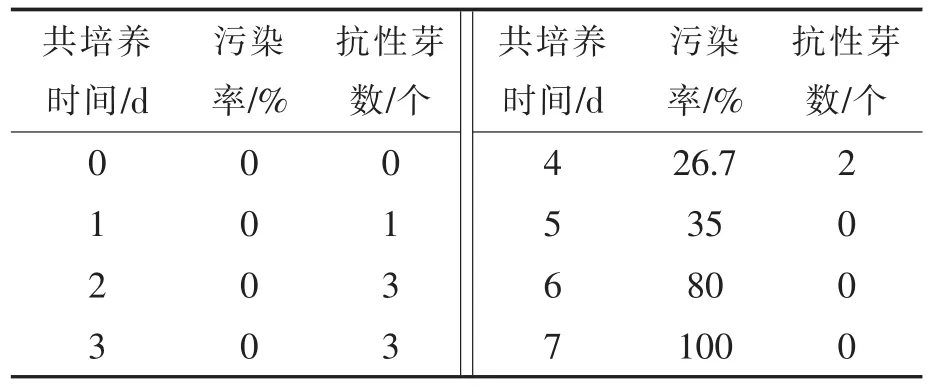
表7 共培养时间对大白菜遗传转化的影响
3 小结与讨论
合适的选择压是植物遗传转化成功的关键之一。当选择压低时,部分未转化的植物细胞由于产生耐受性而分化成假阳性植株;当选择压高时,转化的植物细胞由于不能承受高选择压而同样被抑制,使转化效率降低。白菜类中常用的筛选标记有卡那霉素和潮霉素抗性基因。王峰等[6]认为5mg/L卡那霉素可完全抑制大白菜、小白菜及菜心子叶的再生。而余沛涛等[7]用50mg/L卡那霉素筛选转化后的幼苗,其卡那霉素的选择浓度是王峰等[6]试验结果的 10倍。张艳萍等[8]研究得出,卡那霉素浓度为10mg/L时对大白菜转化体的筛选是有效的,蔺忠龙等[9]和杨广东等[10,11]与张艳萍有相同报道。 杨广东等[12]采用分级分布筛选研究认为,共培养后先在不含卡那霉素的诱导培养基上恢复生长7~ 10 d,再转到含5mg/L卡那霉素的筛选培养基上选择,当抗性芽丛分化后转到含7.5 mg/L卡那霉素的伸长培养基上,将伸长的单芽切下再转到含5mg/L卡那霉素的生根培养基上生根,总共得到GP-11转化苗9株,中白4号转化苗6株。谢建坤等[13]研究白菜抗虫基因转化受体体系时,潮霉素的选择浓度为20mg/L,获得了52株抗性苗,其中20%为GUS阳性植株。田志宏等[14]利用1 mg/L潮霉素筛选出鲁白六号8株潮霉素抗性苗。张蕊等[15]以5mg/L潮霉素作为大白菜津育60转化的抗生素筛选浓度。张晓东等[16]认为在筛选培养基中添加10 mg/L潮霉素对大白菜抗性芽的筛选最有效。本试验筛选的潮霉素浓度为5mg/L,和张蕊等[15]研究结果相同,与其他研究结果有差异[14,16]。从以上研究可以看出,研究者根据植物表达载体上筛选抗性标记基因选择不同的抗生素,主要有卡那霉素和潮霉素2类抗生素,卡那霉素的浓度选择范围为5~50mg/L,潮霉素的浓度选择范围为1~20mg/L,总的说来,卡那霉素选择压一般比潮霉素高,可能因为大白菜基因型不同以及潮霉素对外源基因表达水平低的芽产生了强的抑制作用。
在农杆菌介导的转化过程中,为了抑制农杆菌的生长,需要在培养基中加入抗生素。抗生素抑菌的好坏直接影响转化效率高低,白菜类作物常用的抗生素有氨苄青霉素 (Ampicillin)、 羧苄青霉素(Carbenillin)、头孢霉素和淡紫青霉素(Lilacillin)等。张凤兰[17]认为淡紫青霉素效果较好,她通过研究不同浓度的淡紫青霉素对白菜子叶不定芽的影响,发现白菜不定芽再生几乎不受淡紫青霉素的影响,但淡紫青霉素在国内较难买到,关于它的应用报道较少。谢建坤等[13]选择500mg/L羧苄青霉素抑制农杆菌的生长。蔺忠龙等[9]得出氨苄青霉素浓度为500mg/L时,大白菜抗性芽产生频率最高。张蕊等[15]利用卡那霉素抑菌的研究得出,在培养基中加入400 mg/L卡那霉素既可抑制农杆菌的过度生长,又对白菜外植体的出芽率无致命影响。余小林等[18]观察到,头孢霉素对白菜和菜心的外植体不定芽的再生有明显的抑制作用,在抑菌效果相当的情况下,选择价格便宜、易获得的氨苄青霉素作为抑菌剂,其适宜浓度为300mg/L。杨广东等[10,11]认为头孢霉素浓度为400 mg/L时对抑菌是有效的。本试验得出,头孢霉素浓度低于500mg/L时有促进不定芽再生的作用,而试验得出的头孢霉素最佳浓度500mg/L比杨广东等[10,11]的研究结果稍高。总之,不同的研究者采用不同的抗生素进行抑菌,造成试验结果存在差异的原因可能是不同基因型大白菜对抗生素浓度及类型的敏感性不同。
此外,影响大白菜遗传转化的因素还有农杆菌株种类、菌液培养时间、菌液浓度、菌液感染时间、预培养时间、共培养时间等。王火旭等[19]在以根癌农杆菌介导的大白菜转化研究中得出,子叶预培养2~3 d后,在OD600值为0.3~0.5的工程菌液中侵染2~10min,再共培养2~3 d,大白菜的转化效率较高。邢德峰等[20]得到大白菜遗传转化最佳转化受体和因素组合是:带柄子叶侵染菌液OD600值为0.3,在pH值为5.2的MSC培养基中共培养60 h。各因素对抗性芽分化的影响程度依次为:外植体类型>(菌液浓度×共培养pH值)>(菌液浓度×共培养时间);与EHA 105相比,R1000转化大白菜子叶和下胚轴获得的抗性芽频率差异显著。余小林等[18]试验得出,LBA4404/pBI355-AMF菌株的感染效率远高于EHA105/pBI355-AMF。张凤兰[17]认为用OD600值为0.8的菌液侵染外植体15min,再在pH值为5.2的共培养基中共培养3 d遗传转化效果最佳。田志宏等[14]研究得出,鲁白六号子叶的最佳遗传转化条件为:农杆菌Hn1301菌液OD600值0.3~0.5,侵染时间10min,共培养2 d。朱常香等[21]认为最佳的预培养时间为2~3 d,共培养时间以2 d为宜。杨广东等[10]在大白菜遗传转化系统优化的研究中认为,OD600值为0.3、侵染时间为5min时,抗性芽产生的频率较高。杨广东等[12]将豇豆胰蛋白酶抑制剂基因导入大白菜自交系GP-11和杂交种中白4号中,以预培养1 d的3 d苗龄的大白菜带柄子叶为外植体,在OD600值为0.5的农杆菌菌液中侵染5min,再在pH值为5.2的共培养基中暗培养2~3 d,得到了大白菜抗性植株。张艳萍等[8]以预培养2 d、苗龄4 d的大白菜不带柄半子叶为外植体,在OD600值为0.6的菌液中侵染8min,再在pH值为5.8的共培养基中培养2 d,得到了抗性植株。张蕊等[15]的研究结果得出,在OD600值为0.8的菌液中侵染5 min且共培养2 d转化效果最优。本试验研究得出,06J28橙色大白菜子叶段预培养和共培养时间均为2~3 d,农杆菌菌液OD600值为0.3~0.5,侵染5min。
总结前人研究结果可得出,预培养和共培养的时间一般不超过3 d;农杆菌菌液OD600值为0.3~0.8;侵染2~15min,最高达15min。总之,农杆菌侵染菌液浓度、侵染时间及培养时间差异较大,不能普遍适用,这可能与大白菜的基因型和根癌农杆菌菌株的种类等有关。
本试验以06J28橙色大白菜子叶段为外植体,子叶段预培养2~3 d后,在OD600值为0.3~0.5的菌液中侵染5min,再共培养2~3 d,培养基中加入5 mg/L潮霉素 (抗性筛选),500mg/L头孢霉素 (抑制农杆菌),遗传转化效率较高,经检测初步获得了转CMS7311-orf224基因橙色大白菜植株[5],后将对初步检测的转基因植株进行Southern杂交和Northern杂交检测,进一步判断该目的基因是否整合到橙色大白菜基因组中;同时通过转基因植株花器官的观察,验证细胞质雄性不育系基因在橙色大白菜中的作用,创造新的大白菜不育系种质资源,也为研究细胞质雄性不育机理奠定一定的基础。
[1]张鲁刚,惠麦侠,张明科.彩色大白菜新品种“金冠1号”的选育[J].北方园艺,2005(4):67-68.
[2]尹越,张耀伟,高国栋.根癌农杆菌介导的白菜类作物转化体系研究进展[J].中国瓜菜,2009(2):28-32.
[3]杨龑,徐碧玉,金志强.芸薹属蔬菜作物的遗传转化研究进展[J].华南热带农业大学学报,2003,9(1):13-18.
[4]范爱丽,张鲁刚,武云霞,等.大白菜子叶段高频再生体系的建立[J].核农学报,2009,23(4):581-586.
[5]范爱丽,张鲁刚,惠麦侠,等.大白菜orf224基因植物表达载体的构建及遗传转化[J].西北植物学报,2008,28(7):1 296-1 302.
[6]王峰,卢永恩,李汉霞.几种白菜类蔬菜卡那霉素抗性的研究[J].武汉植物学研究,2006,24(4):377-380.
[7]余沛涛,王炜,何玉科,等.大白菜(Brassica chinensis)的雄性不育基因转化[J].上海农业学报,2000,16(1):17-19.
[8]张艳萍,陈玉梁,张正英,等.农杆菌介导法将硝酸还原酶基因转入大白菜的研究[J].安徽农业科学,2009,37(30):14 597-14 599.
[9]蔺忠龙,李维薇,白现广,等.大白菜遗传转化体系的建立[J].石河子大学学报:自然科学版,2008,26(4):449-452.
[10]杨广东,李艳娥,上官晓霞.大白菜遗传转化系统优化的研究[C]//中国园艺学会.中国园艺学会第四届青年学术讨论会论文集.哈尔滨:哈尔滨工程大学出版社,2000: 300-304.
[11]杨广东,朱祯,李燕娥,等.几种抗生素对大白菜种子发芽及离体子叶再生的影响[J].华北农学报,2002,17(1):55-59.
[12]杨广东,朱祯,李燕娥,等.大白菜转修饰豇豆胰蛋白酶抑制剂基因获得抗虫植株[J].园艺学报,2002,29(3):224-228.
[13]谢建坤,崔海瑞,舒庆尧,等.白菜抗虫基因转化受体体系的建立[J].园艺学报,2001,28(2):175-176.
[14]田志宏,钟燕华,何勇,等.根瘤农杆菌介导aiiA基因对大白菜的遗传转化研究[C]//中国遗传学会.中国遗传学会第八次代表大会暨学术讨论会论文摘要汇编.重庆:西南大学出版社,(2004-2008):73-75.
[15]张蕊,张爱红,常安涛,等.大白菜‘津育60’遗传转化前后组织培养条件的优化[J].中国农学通报,2011,27(4):165-168.
[16]张晓东,李利斌,宋宜现,等.大白菜高效稳定遗传转化体系的建立[J].山东农业科学,2010(2):1-7.
[17]张凤兰.白菜根癌农杆菌介导法基因转化体系的建立[C]//中国园艺学会.蔬菜分子育种研讨会论文集.北京:中国农业出版社,2004:22-29.
[18]余小林,曹家树,许立奎,等.优化白菜类蔬菜遗传转化体系的研究[J].浙江大学学报,2005,31(5):529-534.
[19]王火旭,王关林,王晓岩,等.大白菜AB-81高频再生系统的建立及gusA基因瞬时表达的研究 [J].园艺学报,2001,28(1):74-76.
[20]邢德峰,李新玲,徐香玲,等.农杆菌介导法获得抗病毒病转基因大白菜[J].哈尔滨工业大学学报,2006,38(5):793-796.
[21]朱常香,宋云枝,张松,等.抗芜菁花叶病毒转基因大白菜的培育[J].植物病理学报,2001,3(31):257-263.
Establishment of Genetic Transformation System for Orange Heading Chinese Cabbage
FAN Aili1,2,ZHANG Lugang1
(1.College ofHorticulture,Northwest A&FUniversity/State Key Laboratory ofCrop Stress Biology for Arid Area,Yangling 712100;2.Vegetable Research Institute,Guangxi Academy ofAgricultural Sciences)
In this study,several factors affecting the transformation rate were studied by Agrobacterium-mediated CMS7311-orf224 gene in 06J28 Chinese cabbage,and these factors included sensitivity of cotyledon segments to hygromycin (Hyg)and Cefotaxime (Cef),pre-culture days,concentrations of Agrobacterium tumefaciens,co-culture days and times of being infected on the optimum culturemedium.The results showed that,resistant plants could be obtained with the conditions as follows:the cotyledon segments of 06J28 Chinese cabbage were pre-cultured for 2-3 days,and then infected with EHA-105 (the OD600value ranged from 0.3 to 0.5)for 5minutes and were co-cultured for 2-3 days,lastly were transformed to screening-culture medium (adding 5 mg/L Hyg and 500 mg/L Cef).A higher efficient genetic transformation system was established for orange Chinese cabbage,which set up a basis for germplasm resources innovation of Chinese cabbage.
Orange heading Chinese cabbage;CMS7311-orf224 gene;Genetic transformation
10.3865/j.issn.1001-3547.2012.18.003
国家科技支撑计划(2009BADB8B03),陕西省蔬菜产业体系,广西农业科学院基本科研业务专项项目(2011YZ17),广西农业科学院博士科研启动基金项目
范爱丽(1975-),女,博士,助理研究员,主要从事蔬菜育种与生物技术研究,电话:18778043495,E-mail:fanaili@gxaas.net
张鲁刚(1963-),男,通信作者,教授,博士生导师,主要从事蔬菜育种与生物技术研究,电话:029-87082131,15091199690,E-mail:lugangzh@163.com
2012-06-12

