美味黑粉菌冬孢子萌发条件的研究
徐蝉,张敬泽,王晓清,王志丹,郭得平
(浙江大学农业与生物技术学院,杭州,310058)
美味黑粉菌冬孢子萌发条件的研究
徐蝉,张敬泽,王晓清,王志丹,郭得平
(浙江大学农业与生物技术学院,杭州,310058)
研究了疏亲水界面、温度、pH值和不同物质对美味黑粉菌冬孢子萌发的影响,以探讨美味黑粉菌冬孢子在自然生境条件萌发的适应性。研究结果表明,疏水界面促进美味黑粉菌冬孢子萌发,在疏水的聚苯乙烯塑料培养皿和茭白茎表皮上,萌发率高;冬孢子萌发的最适温度为27~30℃,温度过高或过低均抑制萌发;酸性条件促进冬孢子萌发,最适pH值为3~4;蔗糖促进冬孢子萌发,且以1%浓度最适,但同样浓度的甘露醇、葡萄糖、海藻糖、D-果糖等抑制冬孢子萌发。
美味黑粉菌;冬孢子;萌发率
美味黑粉菌(Ustilago esculenta)是黑粉菌目、黑粉菌科、黑粉菌属真菌,原发生于我国,在我国台湾、越南、日本等东南亚国家和地区有分布。美味黑粉菌能侵染茭白(Zizania latifolia)并诱导其茎膨大,茭白以其膨大茎供食,是我国重要的水生蔬菜。通常,美味黑粉菌在茭白组织中以菌丝体的形式存在,但有时其会产生大量的冬孢子[1]。
大量试验表明,美味黑粉菌在寄主植物茭白体内以菌丝体形式完成整个生活史。冬孢子作为接种源,其作用还未被试验证实[2]。而依据黑粉菌属特性,几乎所有黑粉菌都具有二态型,冬孢子萌发产生单倍体的担孢子,担孢子像腐生的酵母一样生长但对寄主没有侵入性。当2个单倍体细胞融合后,产生的双核丝状体能侵染寄主植物,导致黑粉病的发生[3,4]。研究美味黑粉菌冬孢子萌发特性,是了解其生活史和侵染机制的基础。前人对菰黑粉菌冬孢子的萌发情况进行了观察和研究[5~7],但冬孢子萌发对自然生境的确切需求还不很明了,因此,本文通过模拟影响冬孢子萌发的因素,进一步探讨美味黑粉菌冬孢子萌发对环境条件的要求,为研究冬孢子在真菌生活史中的作用提供依据。
1 材料与方法
1.1 真菌材料
美味黑粉菌成熟冬孢子取自2010年浙江省德清县梭子茭品种的灰茭植株上。灰茭存在室内半年后,取中部的冬孢子制备孢子悬浮液。
1.2 试验方法
①孢子悬浮液的配制 取灰茭横切面中部少量孢子,接于含有灭菌水的1.5 mL Eppendorf离心管中,振荡混匀,配制每1 mL含1×106个孢子的悬浮液。
②疏亲水界面对冬孢子萌发的影响 用移液枪取孢子悬浮液,分别接入聚苯乙烯塑料培养皿(直径6 cm)、灭菌载玻片、含有水琼脂培养基的表面和茭白茎皮条表面,标记接菌点位。每培养皿、载玻片、水琼脂培养基和茭白茎皮条表面都含有3个孢子悬浮液液滴,然后放置到含有2层湿润滤纸的密封容器中,于25℃培养箱中培养。每个试验重复3次。48 h后镜检,观察记录冬孢子萌发情况,统计萌发率。孢子萌发率(%)=[孢子萌发数/(孢子萌发数+未萌发孢子数)]×100%。
③不同温度对冬孢子萌发的影响 用移液枪取孢子悬浮液,接种于聚苯乙烯塑料培养皿(直径6 cm)中,每皿含有3个孢子悬浮液液滴。分别置于15,18,21,24,27,30,33,36℃培养箱中培养。每个试验重复3次。44 h后镜检,观察和统计孢子的萌发率。
④不同pH值对冬孢子萌发的影响 制备pH值为 1,2,3,4,5,6,7,8,9,10,11的冬孢子悬浮液(浓度为1×106个/mL孢子),接种于聚苯乙烯塑料培养皿(直径6 cm)中,每皿含有3个孢子悬浮液液滴。置于28℃培养箱中培养。每个试验重复3次。36 h后镜检,观察和统计萌发率。
⑤不同营养物对冬孢子萌发的影响 制备冬孢子悬浮液(1×106个/mL孢子),其中悬浮液分别含有蔗糖(1%)、甘露醇(1%)、氯化钠(1%)、葡萄糖(1%)、海藻糖(1%)和D-果糖(1%)。将所有冬孢子悬浮液的pH值调为4,接种于聚苯乙烯塑料培养皿(直径6 cm)中,每皿含有3个孢子悬浮液液滴。置于28℃培养箱中培养。每个试验重复3次。18 h后镜检,观察和统计萌发率。
⑥蔗糖浓度对孢子萌发的影响 制备冬孢子悬浮液(1×106个/mL孢子),使其蔗糖浓度分别为0.0%,0.1%,0.5%,1.0%,2.0%,3.0%,4.0%,5.0%。将所有冬孢子悬浮液的pH值调为4,接种于聚苯乙烯塑料培养皿(直径6 cm)中,每皿含有3个孢子悬浮液液滴,置于28℃培养箱中培养。12 h后镜检,观察和统计萌发率。
2 结果与分析
2.1 疏亲水界面对冬孢子萌发的影响
表1结果显示,冬孢子在茭白茎皮条表面萌发率最高,约为32%,其次是在聚苯乙烯塑料培养皿,约为31%,但两者没有显著差异(P<0.05);再次是在载玻片,约为17%,在水琼脂表面最低,仅为4%。结果表明,冬孢子在不同疏亲水界面上萌发率差异是显著的,揭示了冬孢子萌发受接触硬度和疏亲水界面的诱导。
2.2 不同温度对冬孢子萌发的影响
表2结果显示,美味黑粉菌冬孢子萌发温度范围在15~33℃,但低温和高温影响冬孢子萌发率。低于21℃,各处理间冬孢子萌发率没有显著差异(P< 0.05);但高于21℃后,不同温度间差异显著;当温度达到36℃时没有孢子萌发。美味黑粉菌冬孢子最适萌发温度为28℃左右。
2.3 不同pH值对冬孢子萌发的影响
图1结果显示,冬孢子在较大的pH值范围内都能萌发,酸碱都能影响冬孢子萌发率,但酸性条件更显著。但当pH值在7左右时,冬孢子几乎不萌发,因而,冬孢子萌发率呈现双峰。当pH值在1~7范围内,冬孢子萌发率呈正态分布,当pH值在3左右时,冬孢子萌发率达到最高,约为95%。

表1 不同培养界面对冬孢子萌发的影响
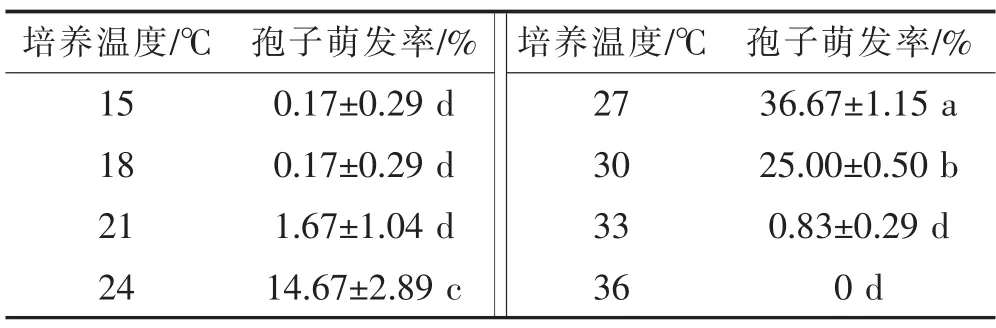
表2 不同培养温度对冬孢子萌发的影响

图1 不同pH值对冬孢子萌发的影响
2.4 不同营养物对冬孢子萌发的影响
表3结果显示,不同物质对黑粉菌冬孢子萌发影响较大,蔗糖能显著的促进冬孢子萌发,而经甘露醇、氯化钠、葡萄糖、海藻糖和D-果糖处理的冬孢子萌发率均显著低于对照,对孢子萌发有显著抑制作用。其中,D-果糖抑制效果最显著,其次是海藻糖和葡萄糖,两者之间没有显著差异;最后是氯化钠和甘露醇,两者之间没有显著差异。
2.5 蔗糖浓度对冬孢子萌发的影响
图2结果显示,冬孢子在蔗糖浓度为0%~5.0%时均可萌发,蔗糖显著地促进冬孢子萌发,且当蔗糖浓度达到1.0%时,冬孢子萌发率最高,显著高于其他处理浓度(P<0.05)。同时,结果也显示,低浓度和高浓度的蔗糖溶液能抑制冬孢子萌发。
3 结论与讨论
孢子萌发标志着真菌从休眠状态到活性发育的转变,其在真菌生活史中是一个关键阶段。真菌已经演化出了确保孢子对专门适合生长条件信号反应的机制。在大多数情况下,糖是真菌孢子萌发所必须的,应保证其需要[8]。除此之外,植物基质或信号也诱导其萌发,如固体疏水表面或表皮蜡质[9],而且孢子依据激活信号演化出不同萌发类型[10,11]。本试验发现,美味黑粉菌冬孢子在疏水和硬的聚苯乙烯塑料和茭白茎表皮表面具有较高的萌发率,在较亲水和硬的载玻片上萌发率较低,而在亲水和软的水琼脂培养基表面上萌发率最低。这些结果证明美味黑粉菌冬孢子萌发受疏水性和硬的表面的诱导,也表明黑粉菌冬孢子倾向于在靠近茭白植株根茎部表皮处萌发生长,这可能利于黑粉菌对茭白植株的侵染。有些真菌孢子萌发需要宿主的存在[12],但美味黑粉菌冬孢子在塑料培养皿和玻璃板上都能直接萌发。
本试验中,美味黑粉菌冬孢子在温度为27~ 30℃时萌发率达到最高,与以前报道相似[6]。本试验结果表明,美味黑粉菌冬孢子萌发温度稍高于一般真菌孢子25℃左右的萌发适温。pH值对美味黑粉菌冬孢子萌发的影响较大,在本试验模仿的自然生境条件下,冬孢子萌发的最适pH值为3~4,但当pH值降低到2时,能明显观察到其芽管呈短缩状,甚至其后产生的担孢子也为短缩状,可见pH值太低不利于孢子生长;而在pH为中性时,冬孢子几乎未萌发,与前人报道的美味黑粉菌冬孢子萌发的最适pH值为6[5,6]、玉米丝黑穂病病原菌冬孢子萌发最适pH值为7的研究结果有很大差异[12],其原因可能是pH值对冬孢子萌发的影响与萌发基质有关,以前研究所用基质为营养培养基[5,6],而本试验所用萌发基质为水。
蔗糖、葡萄糖、甘露醇等碳源有利于冬孢子萌发[13],也有报道认为生理盐水也可促进孢子萌发[14],其中葡萄糖常被用作促进多种真菌孢子萌发的营养液[15]。但我们的试验结果显示,甘露醇、葡萄糖、海藻糖、D-果糖和氯化钠对美味黑粉菌冬孢子萌发有一定的抑制作用,而1.0%的蔗糖溶液对美味黑粉菌冬孢子萌发却有显著促进作用,是冬孢子发育最有效的糖[2,5,6]。这可能与寄主协同进化密切相关,在寄主体内,叶片产生的糖主要以蔗糖的形式从叶片向其他组织运输,寄主体内的真菌菌丝获得的营养可能主要是蔗糖。因此,本研究结果为了解美味黑粉菌冬孢子在田间自然环境条件下的行为和作用提供了重要信息。
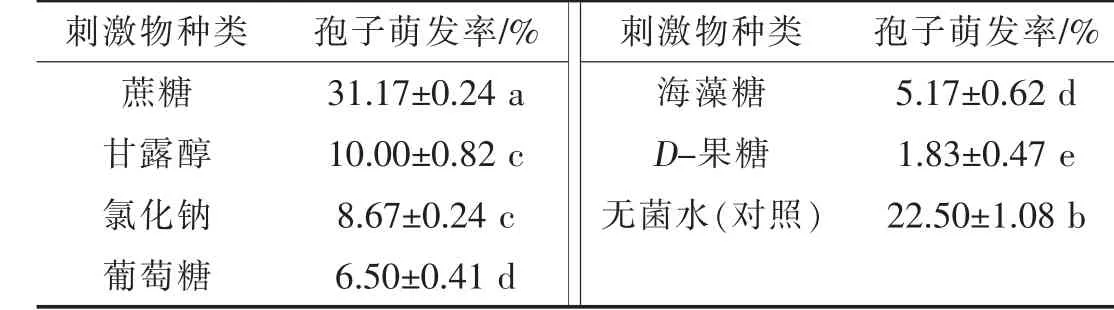
表3 不同刺激物对冬孢子萌发的影响

图2 蔗糖浓度对冬孢子萌发的影响
[1]Zhang J Z,Chu F Q,Guo D P,et al.Cytology and ultrastructure of interactions betweenUstilago esculentaandZizania latifolia[J].Mycol Prog,2012,11(2):499-508.
[2]Chung K R,Tzeng D D.Nutritional requirements of the edible gall-producing fungusUstilago esculenta[J].J Biol Sci,2004,4(2):246-252.
[3]Brefort T,Doehlemann G,Mendoza-Mendoza A,et al.Ustilago maydisas a pathogen [J].Annu Rev Phytopathol, 2009,47:423-425.
[4]Kämper J,Kahmann R,Bölker M,et al.Insights from the genome of the biotrophic fungal plant pathogenUstilago maydis[J].Nature,2006,444:97-101.
[5]程岩,沈崇尧,裘维蕃.关于茭白黑粉菌的正名问题[J].真菌学报,1989,8(1):9-16.
[6]郭得平,李曙轩,曹小芝.茭白黑粉菌(Ustilago esculenta)某些生物学特性[J].浙江农业大学学报,1991,17(1):80-84.
[7]李志兰,尤文雨,邹克琴,等.菰黑粉菌冬孢子萌发过程形态学观察及系统发育研究[J].中国计量学院学报,2010,21(2):140-145.
[8]Osherov N,Gregory S M.The molecular mechanisms of conidial germination [J].FEMS Microbiol Lett,2001,199 (2):153-160.
[9]Chaky J,Anderson K,Moss M,et al. Surface hydrophobicity and surface rigidity induce spore germination inColletotrichumgraminicola[J]. Phytopathology,2001,91:558-564.
[10]Barhoom S,Sharon A.cAMP regulation of"pathogenic" and"saprophytic"fungal spore germination [J].Fungal Genet Biol,2004,41(3):317-326.
[11]Doehlemann G,Berndt P,Hahn M.Different signalling pathways involving a Galpha protein,cAMP and a MAP kinase control germination ofBotrytis cinereaconidia[J]. Mol Microbiol,2006,59(3):821-835.
[12]吴景芝,魏永田,李自萍,等.玉米丝黑穗病菌冬孢子萌发湿度及云南玉米新品种抗性鉴定研究[J].中国农学通报,2009,25(19):186-189.
[13]吴伟怀,谢祖健,贺春萍,等.甘蔗黑穗病菌冬孢子生物学特性及杀菌剂对其萌发的影响 [J].热带作物学报,2009,30(11):1 674-1 678.
[14]农业部.食用菌技术标准汇编[M].北京:中国标准出版社,2006.
[15]俞大绂.植物病理学和真菌技术汇编[M].北京:人民教育出版社,1977.
Research on Factors Influencing Teliospore Germination ofUstilago esculenta
XU Chan,ZHANG Jingze,WANG Xiaoqing,WANG Zhidan,GUO Deping
(College of Agriculture and Biotechnology,Zhejiang University,Hangzhou 310058)
We investigated the factors influencing teliospore germination ofUstilago esculenta,such as surface characters, temperature,pH value and stimulants.The results showed that hydrophobic surfaces promoted the germination of teliospore,and the germination rates were higher on the hydrophobic polyethylene Petri dishes and surfaces of stem epidermis ofZizania latifolia.The highest germination rate occurred at 27 to 30℃,whereas it was inhibited by higher or lower temperature.The acidic condition promoted the germination of teliospore,with the optimum pH value of 3 to 4,and sucrose with the concentration of 1%was best fit for the germination of teliospore,but other carbon sources,such as mannitol,glucose,trehalose,D-fructose,inhibited teliospore germination.
Ustilago esculenta;Teliospore;Germination rate
10.3865/j.issn.1001-3547.2012.16.038
公益性行业(农业)科研专项经费项目“水生蔬菜产业技术体系研究与示范”(编号200903017-03)徐蝉(1986-),女,硕士,主要从事园艺学研究,电话:0571-88982796,E-mail:xchan8808@163.com郭得平,通信作者,E-mail:dpguo@zju.edu.cn
2012-06-28

