荔枝皮中原花青素提取工艺优化及其黄烷-3-醇HPLC分析
刘 新 余小平 游江舟 娄 彬
(成都医学院公共卫生系,四川 成都 610083)
荔枝(litchi chinensis),无患子科(sapindaceae)荔枝属(litchi)。其皮中黄烷-3-醇类活性物质含量较高,原花青素、表儿茶素和没食子酸是其主要成份[1,2]。
黄烷醇类化合物是一类广泛存在于天然植物中的多元酚化合物,其独特的酚羟基结构使其具有清除烷氧自由基和超 氧 离 子 自 由 基 的 能 力,其 中 的 原 花 青 素(proanthocyanidins)成份是由不同数量的儿茶素或表儿茶素结合而成的低聚体和多聚体,具备较强的清除自由基和抗氧化能力,在预防及治疗心血管疾病、抗癌、抗过敏、抗突变、抗衰老等方面作用显著[3,4]。铁盐催化比色法对原花青素多聚体测定专一性较好,为普遍应用的检测方法[5,6]。但是黄烷-3-醇儿茶素类成份,没食子酸(GA)、表没食子儿茶素(EGC)、儿茶素(-C)、表儿茶素(EC)和表儿茶素没食子酸酯(ECG)在铁盐催化比色法中不显色,故不能完全反映荔枝皮中生物活性成份,尤其是表儿茶素物质[2,7,8]。目前对荔枝皮中EGC和ECG 含量的检测还未见相关的文献报道。为此,本试验采用超声破碎机对荔枝皮细胞进行破碎处理,使其中的活性物质直接溶于提取溶液中。采用响应面法来优化荔枝皮中原花青素超声波辅助提取工艺参数,并在最佳工艺参数下对荔枝皮中黄烷-3-醇类成份进行提取,使用铁盐催化比色法和HPLC 法对其黄烷-3-醇类成份及含量进行分析,以期最大程度反映荔枝皮中黄烷-3-醇类抗氧化活性成分并为其有效开发提供参考依据。
1 材料与方法
1.1 材料和试剂
荔枝:品种妃子笑,购于成都超市。
原花青素标准品(PA):纯度≥98%,葡萄籽提取物,天津尖峰天然产物开发公司;
没食子酸(GA)、表没食子儿茶素(EGC)、儿茶素(-C)、表儿茶素(EC)和表儿茶素没食子酸酯(ECG)化学对照品:HPLC≥98%,色谱纯,成都瑞芬思生物科技有限公司;
甲醇:色谱纯,Fisher Scientific,USA;
石油醚(沸程30~60 ℃)、无水甲醇、硫酸铁铵、盐酸、正丁醇和冰乙酸:分析纯,成都市科龙化工试剂厂。
1.2 主要仪器
超声波细胞粉碎机:JY92-IIN,20~25kHz频率自动跟踪,6Φ 变幅杆,宁波新芝生物科技股份有限公司;
冷冻干燥机:ZKES,Virtis USA;
日立 高 效 液 相 色 谱:UV Detector:L-2400,pump:L-2130,日本株式会社日本高新技术那珂事业所;
紫外-可见光分光光度计:UV-1102,天美科技有限公司;
电子天平:BSA124S,北京赛多利斯系统有限公司;
索氏提取器:SZF-06,上海华睿仪器有限公司;
超声波清洗机:SB25-12DTD,宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 荔枝皮预处理 新鲜荔枝去皮,40 ℃干燥、粉碎、过筛、石油醚脱脂、阴干、4 ℃避光,贮存备用。
1.3.2 提取流程 准确称取0.3g荔枝皮粉,以纯水为提取剂,在(78±2)℃、pH 7.0条件下,对荔枝皮中原花青素及黄烷-3-醇儿茶素类活性物质进行超声波破碎提取,提取液在5 000r/min条件下离心、0.45μm 过滤、于-50℃冷冻干燥。冻干提取物加不同体积分数甲醇并超声溶解,再吸取1mL提取物采用铁盐催化比色法和高效液相色谱法,对荔枝皮中黄烷-3-醇类成份及含量进行分析定量。由于原花青素为聚合体,其单元间的连接键易在酸性作用下被打开。下部单元生成黄烷-3-醇儿茶素成份,上部单元生成花色素[6]。故在对荔枝皮中原花青素提取时pH 值定在7.0,以客观的体现荔枝皮中黄烷-3-醇儿茶素成份含量。
1.3.3 荔枝皮中原花青素提取工艺参数的优化 通过Box-Behnken Design试验构建多元回归模型,使用Design-Expert 8.0.6软件优化功能优化得出荔枝皮中原花青素超声波辅助提取工艺参数组合。通过前期预试验得出BBD 试验设计的试验考察因素和水平编码见表1。

表1 试验因素与水平Table 1 The factors and levels
1.3.4 荔枝皮中黄烷-3-醇类成份含量确证 以荔枝皮为原料,在最佳工艺参数组合下,提取1次,用铁盐催化比色法和HPLC法对其黄烷-3-醇类成份及含量进行研究,并确定最佳甲醇体积分数。
1.3.5 原花青素标准曲线方程建立 按铁盐催化比色法制作标准曲线[5],回归方程为y =0.0024x+0.027 2,R2=0.996(y 表示吸光度,x 表示原花青素含量),其浓度在30~250μg/mL呈良好的线性关系[9]。
1.3.6 HPLC 标准曲线方程建立 色谱条件:色谱柱为反相Allsphere ODS-25u柱(4.6 mm×250 mm,5μm)。流动相A 为0.2%的乙酸溶液,流动相B为甲醇。流动相洗脱梯度:0~15min流动相B(甲醇),从10%增加到60%;15~22.5min流动相B保持在60%;22.5~25min流动相B从60%回到10%;25~30min,流动相B 保持在10%。流速为0.5 mL/min,柱温:室温,检测器检测波长280nm,分析周期30 min,进样量10μL[10]。
分别精确称取GA、-C、EC 和ECG 标准品20.00mg,用无水甲醇溶解、定容至10mL,制得浓度为2.00mg/mL的标准使用液。称取EGC标准品20.00mg,用无水甲醇溶解、定容至1mL,制得浓度为20.00mg/mL的标准使用液。稀释配置成5 个不同梯度的混合液。混合液中EGC 浓度梯度为62.5,125,250,500,1 000μg/mL;其余标准品浓度梯度为25,50,100,200,400μg/mL。在上述色谱条件下进样量10μL,得到进样标准品浓度(W)与对应峰面积(A)方程,见表2。

表2 标准曲线方程和相关系数Table 2 The curvilinear equations and R
2 结果与分析
2.1 荔枝皮中原花青素提取工艺的优化
2.1.1 Box-Behnken Design试验组合及结果 用Design-Expert 8.0软件随机产生BBD 试验方案,以吸光度值为评价指标(吸光度值与荔枝皮中原花青素超声提取量呈正比关系)。试验结果见表3。

表3 Box-Behnken Design试验设计及结果Table 3 Box-Behnken Design and response absorbance values for the proanthocyanidins
2.1.2 显著性检验和回归模型建立 BBD 试验方差分析结果见表4。回归模型F 检验极显著(P<0.000 1),仅有0.01%的概率发生偏差。回归模型调整后的回归决定系数R2值为0.899 1,信噪比为17.263,失拟项F =0.7,表示模型失拟不显著,拟和度良好,说明该模型可以用来评估该试验考察因素设计[11,12]。考察因素方差分析结果显示:A、B、C、A2、C2、AB、AC和BC 对荔枝皮中原花青素提取的影响显著性(P <0.05);D、B2、D2、AD、BD 和CD 对其中原花青素提取的影响不显著(P>0.05)。

表4 方差分析及显著性检验Table 4 Variance analysis and significance tests
将所得试验数据进行多元回归建模,得到荔枝皮中原花青素吸光度值与各考察因素的四元二次回归方程为:

由于方程经过标准化处理,可直接由考察因素二次项系数来确定影响荔枝皮中原花青素超声波辅助提取因素大小顺序,即:荔枝皮粉碎度>超声提取时间>超声波功率>料液比。
2.1.3 考察因素等高线图分析 由图1~4可知,在诸因素中,粉碎度目数起最显著影响作用,等高线陡峭,说明控制好该因素是提高超声波辅助提取原花青素的关键因素;超声时间对原花青素提取亦为显著影响作用,提取过程中应严格控制时间。因为长时间的超声波热效应会使溶出的原花青素遇热分解[13],试验显示用超声波细胞破碎机来提取荔枝皮中原花青素时,在超声波为200 W 时,提取液温度在5 min左右到达(78±2)℃,之后随着时间的延长一直保持在(78±2)℃;料液比和超声功率对原花青素吸光度值影响最小,等高线偏向平直。说明超声功率在试验取值范围内对原花青素提取量影响不大,可以把超声波功率值设定在偏低范围。如果使超声波功率继续加强,超声波的空化效应和热效应会对原花青素的分子结构产生破坏作用[14],导致原花青素提取量降低。

图1 粉碎度与超声时间对原花青素吸光度值的交互影响Figure 1 The interactive effects of particle size and ultrasonic duration on the absorbance value of proanthocyanidins

图2 料液比与超声时间对原花青素吸光度值的交互影响Figure 2 The interactive effects of liquid-solid ratio and ultrasonic duration on the absorbance value of proanthocyanidins
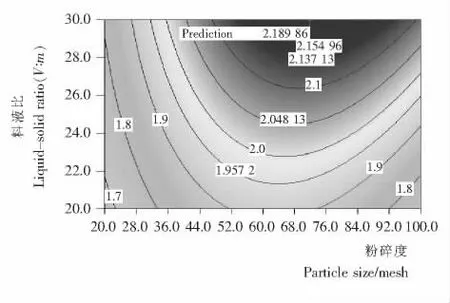
图3 粉碎度与料液比对原花青素吸光度值的交互影响Figure 3 The interactive effects of particle size and liquid-solid ratio on the absorbance value of proanthocyanidins
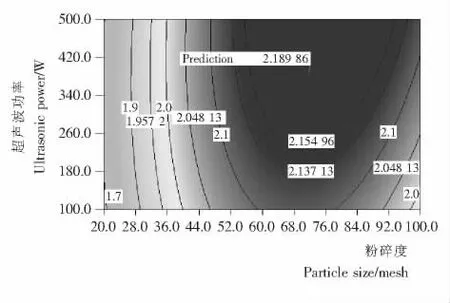
图4 粉碎度与超声波功率对原花青素吸光度值的交互影响Figure 4 The interactive effects of particle size and ultrasonic power on the absorbance value of proanthocyanidins
通过Design-Expert 8.0.6软件优化功能进行优化,以理想最大荔枝皮中超声波辅助提取原花青素提取量(吸光度预测值2.190Abs)为目标,得出最佳提取工艺参数组合,即:荔枝皮粉碎度71.91目、料液比1∶29.97(m∶V)、超声时间21.75min和超声波功率390.48 W(见图5)。

图5 粉碎度、料液比、超声时间和超声波功率最佳工艺参数Figure 5 Optimal conditions of the prediction of the effects of the four factors on the proanthocyanidins absorbance values
2.1.4 确证最佳提取工艺参数 考虑到实际情况,把最佳提取工艺参数做了细微调整。称取0.3g脱脂、过80目标准筛荔枝核粉碎粉末3份。按料液比为1∶30(m∶V)、超声波功率为400 W、超时时间为22min,提取1次,取离心过滤提取液1mL在-50 ℃下冻干,用无水甲醇超声复溶,荔枝皮中原花青素吸光度平均值为2.157Abs,为响应面法得出原花青素吸光度预测值的98.50%,表明了该试验设计方案的合理性和有效性。
2.2 黄烷-3-醇类成份最佳甲醇溶解体积分数及各成份含量分析
在最佳提取工艺参数下对荔枝皮超声破碎提取1次,离心、过滤、取上清液1mL,-50 ℃下冻干。向冻干的提取物中加入1mL 20%,30%,40%,50%,60%,70%,80%,90%,100%甲醇并超声溶解,溶解液过0.45μm 微孔滤膜,取滤液在给定色谱检测条件下进样3次,比较不同体积分数甲醇对荔枝皮中黄烷-3-醇类成份溶出含量的影响程度,确定各成份的最佳甲醇体积分数。结果见表5。

表5 荔枝皮中不同甲醇体积分数黄烷-3-醇类成份含量Table 5 The contents of flavan-3-ol under different methanol fraction from litchi pericarp/(mg·g1)
由表5可知,荔枝皮中黄烷-3-醇类各成份随着甲醇体积分数的增大而增加,尤其是EGC、EC、ECG 和-C呈显著增加趋势。甲醇体积分数为100%时,GA 的含量最高;当甲醇体积分数为90%时,EGC、-C和ECG 的含量最高;而EC和PA在甲醇体积为80%时含量最高。EGC 成份在荔枝皮中含量较高,占HPLC法分离组份成份的15.5%。
3 讨论与结论
在用超声波细胞破碎机对荔枝皮中活性物质进行提取时,使用纯水作为提取溶剂,避免不同极性溶剂对荔枝皮中的黄烷-3-醇类成份提取的影响,客观反映超声波细胞破碎机参数对荔枝皮中活性物质提取的作用。
由于原花青素按聚合度分为很多种类,且原花青素的检测方法在国际上标准不一。目前用高效液相色谱法来确定物质中原花青素的含量用的是原花青素B1、原花青素B2。但正丁醇铁盐比色法用的是葡萄籽原花青素标准品,纯度≥98%(分光光度法检测),此方法在中文文献中采用较为普遍。故在试验中原花青素检测这一部分用的是葡萄籽原花青素标准品。
采用Box-Behnken Design试验设计对超声波辅助水提荔枝皮中原花青素的影响因素进行考察并构建模型,得出考察因素最佳提取工艺参数组合,即:荔枝皮粉碎度71.91目、料液比1∶29.97(m∶V)、超声时间21.75min和超声波功率390.48 W,通过确证实验证明了最佳提取工艺参数组合的有效性。在最佳超声波辅助水提工艺参数下对荔枝皮进行超声破碎提取1次,离心、过滤、取上清液1mL 在-50 ℃温度下冻干,用1mL不同体积分数甲醇进行超声复溶,并通过铁盐催化比色法、HPLC法分析得出最佳的荔枝皮黄烷-3-醇类成份含量:PA 为89.32 mg/g、GA 为1.11 mg/g、EGC为87.09mg/g、-C为3.37mg/g、EC为31.15mg/g和ECG为7.02mg/g。
1 刘洪,李淼,冯静,等.成都地区市售水果中原花青素含量的分析比较[J].陕西农业科学,2011,57(4):35~37.
2 周玮婧,孙智达,谢笔钧,等.荔枝皮原花青素提取工艺优化[J].农业工程学报,2009,25(增刊1):175~179.
3 孙芸,徐宝才,谷文英,等.葡萄籽原花青素聚合度与自由基清除能力关系的研究[J].食品科学,2007,28(12):423~428.
4 Yong Soo Park,Min Hee Jeon,Hyun Jung Hwang,et al.Antioxidant activity and analysis of proanthocyanidins from pine(Pinus densiflora)needles[J].Nutrition Research and Practice(Nutr Res Pract),2011,5(4):281~287.
5 李华,肖付才,袁春龙,等.铁盐催化比色法测定葡萄籽超微粉中原花青素[J].食品研究与开发,2007,28(9):114~117.
6 涂斌,李新莹,姚舜,等.甘蔗中原花青素含量的分析方法[J].食品研究与开发,2009,30(6):130~132.
7 杨宝,赵谋明,刘洋,等.荔枝壳主要黄烷醇类物质分析[J].天然产物研究与开发,2005,17(5):577~579.
8 Rachel L Hanlin,Mark A Kelm,Kerry L Wilkinson,et al.Detailed characterization of proanthocyanidins in skin,seeds,and wine of shiraz and cabernet sauvignon wine grapes(vitis vinifera)[J].Journal of Agricultural and Food Chemistry,2011,59(24):13 265~13 276.
9 刘新,余小平.响应面法优化超声波辅助提取荔枝核中原花青素研究[J].成都医学院学报,2011,6(3):211~215.
10 邓永亮,冯雷,吕才有.一种快速检测茶叶中儿茶素的HPLC 方法[J].西南农业学报,2011,24(3):932~935.
11 Wang Tianxin,Liang Hao,Yuan Qipeng.Optimization of ultrasonic-stimulated solvent extraction of sinigrin from indian mustard seed(brassica junceal.)using response surface methodology[J].Phytochem.Anal.,2011,22(3):205~213.
12 Carina Pinho,Armindo Melo,Catarina Mansilha,et al.Optimization of conditions for anthocyanin hydrolysis from red wine using response surface methodology(RSM)[J].Agric.Food Chem.,2011,59(1):50~55.
13 宋传奎,肖斌,王艳丽,等.超声波辅助提取茶多酚工艺条件的优化[J].西北农林科技大学学报(自然科学版)2011,39(5):133~139.
14 陈磊,王军.山葡萄籽中原花青素的提取[J].中国野生植物资源,2008,27(1):58~60.
——营养
——去皮

