基于数字全息的活体细胞动态相衬显微观察
刘 烁 潘 锋 肖 文
(北京航空航天大学 仪器科学与光电工程学院,北京 100191)
数字全息技术采用CMOS(Complementary Metal-Oxide Semiconductor)等数字相机记录干涉图谱,并通过数值再现来还原物光场分布,近年来其应用领域已得到了广泛拓展[1-3].结合数字全息和光学显微原理而发展出来的数字全息显微术,已经用于还原和分析MEMS(Micro-Electro-Mechanical Systems)、生物细胞等微小物体的三维形态特征[4-6].数字全息显微术可同时获得物光场的振幅和相位信息,且具有非接触、非破坏、无标记、高分辨率的优势,因而非常适用于生物样品特别是活体组织和细胞的显微观察和定量分析,已成为数字全息应用研究中的热点[7-9].
为了研究生命机理和分析某些特殊的生物效应,活体细胞的培养和观察多需在较复杂条件下完成,如在载人空间站的微重力环境下对生物细胞进行观测实验.与原子力显微术、共聚焦荧光显微术等相比,数字全息显微术对实验环境和样品制备的要求相对较低,可在无损条件下进行动态定量分析.为更好地适应生物活体细胞的观测需求,本文搭建了一套预放大离轴数字全息显微实验系统,利用单模光纤和光纤器件优化了光路结构,采用无穷远校正显微物镜提高了成像分辨率,并引入曲率匹配透镜对相位畸变进行了初步补偿.在数值再现过程中,通过构造数字掩模对相位畸变进行了进一步的校正.对在恒温条件下培养的小鼠活体骨细胞样品进行了连续的动态观察,得到了细胞的高分辨率相衬图像,观测到了细胞生长过程中的形态变化,验证了实验系统和方法的有效性.
1 数字全息显微原理
数字全息显微术是在数字全息原理基础上通过提升观测分辨率实现的,主要实现方法包括合成孔径法[6]、显微物镜预放大法[7]、无透镜傅里叶变换法[9]等.其中显微物镜预放大法的分辨率提升效果最为直接.结合离轴全息记录,此方法可利用单幅全息图得到物光场的振幅和相位分布,因而更适用于动态观察.
数字全息显微术的实现过程分为干涉记录和数值再现两步,其记录光路有透射式和反射式两种.生物活体细胞多为半透明状态,其观察一般采用透射式光路.图1是本文采用的透射式预放大离轴数字全息显微的记录光路原理示意图.一束照明光首先经过待测样品S透射,其强度变化反映了样品的透射率分布,其光程变化则反映了样品的形貌和折射率分布.透射光经过无穷远校正显微物镜MO和中继成像透镜TL后完成预放大,形成物光O.物光O经合光棱镜BS与参考光R相干叠加,干涉图谱被CMOS捕获,形成数字全息图.工作中,样品S置于MO的前焦面处,可在TL的后焦面处形成样品的放大实像I,此实像相当于全息记录的实际目标物,观测分辨率由此得以提升.为抑制全息中的零级像和共轭像干扰问题[10],相干叠加时O和R在传播方向上需要存在一个合适的夹角,构成离轴数字全息记录结构.
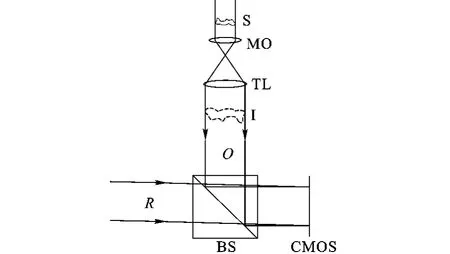
图1 透射式预放大离轴数字全息显微记录原理
干涉记录完成后,待测样品的光学特征信息已经包含在CMOS捕获的数字全息图中.在数值再现过程,通过对全息图进行数值处理和解算,可以得到物光场在放大实像平面的复振幅分布,进而还原样品的细节信息.
2 实验装置搭建
传统的数字全息显微系统多通过分立光学元件直接搭建,系统结构比较松散,灵活性和稳定性也较低.为适应生物活体细胞的动态观测特点,通过引入单模光纤和光纤器件对数字全息显微系统进行了优化,系统的基本结构如图2所示.系统采用马赫-曾德干涉仪结构,利用倍频Nd:YAG固体激光器(532nm,50mW)作为相干光源L,出射的激光经光纤耦合器LFC进入单模光纤OF,而后经3 dB光纤分束器FS分为两路.一路经光纤准直镜FC出射作为照明光,经待测样品S透射后,利用无穷远校正显微物镜MO(20×,NA=0.4)和中继成像透镜TL完成预放大,形成物光O.另一路从光纤头出射后形成球面光,经曲率匹配透镜CL调整后形成参考光R.O和R经合光棱镜BS实现相干叠加,形成数字全息图,并被CMOS捕获记录.通过调节参考光路光纤出射端的角度,可以改变物光和参考光的夹角θ,保证离轴数字全息记录的实现.通过调整CL的位置,可以使R和O的曲率比较接近,对MO和TL导致的相位弯曲进行初步补偿.
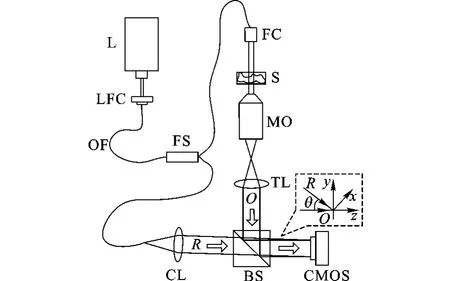
图2 生物活体细胞动态观测的数字全息显微装置
此系统利用单模光纤和光纤器件完成了照明光和参考光的传导和分光,系统结构紧凑,质量和体积较小,器件布局更为灵活,实验调整的难度也得以降低,从而适用于较复杂条件下活体细胞的动态显微观察.
3 数值再现和相位还原
利用实验系统获取的数字全息图,通过数值算法进行解算,可再现还原物光场信息.数字全息图H在CMOS记录面获取,可以表示为
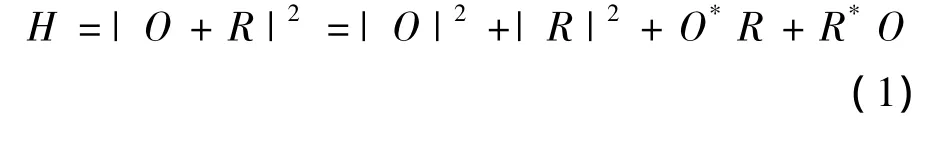
其中,O和R分别表示物光和参考光在CMOS记录平面的复振幅分布;*表示复共轭.在全息理论中,式(1)的最后一项对应于虚像,物光场可通过此项还原.其他3项为干扰项,对应于零级像和共轭像,根据离轴数字全息原理,这3项可以通过傅里叶频域滤波滤除[11].为校正离轴相位倾斜并进一步补偿显微物镜引入的相位弯曲[12],构造了数字相位掩模M,并将其与滤波后的全息图相乘.进而利用卷积再现算法[11],得到放大实像所在平面的物光复振幅分布Ψ:

其中,DFT和DFT-1分别表示离散傅里叶变换和其逆变换;filter表示傅里叶频域滤波;g表示空间脉冲响应函数.最后,由Ψ计算得到振幅图A和相位图φ:

其中,ΨRe和ΨIm分别表示Ψ的实部和虚部.振幅图A和相位图φ分别反映了样品的透射率分布和样品引入的光程变化.对于近似透明的活体细胞来说,振幅图能够反映的信息较少,而相位图则可以用于分析细胞的形态和折射率分布,即相衬显微图.经二维相位解包裹后,相位图φ即可用于定量分析.
4 小鼠活体骨细胞动态观察和分析
为验证实验系统和再现方法的有效性,对小鼠活体骨细胞样品进行了连续的动态相衬显微观察.将预先培养的小鼠骨细胞MLO-Y4活体样品接种在35mm培养皿中,利用图2所示的实验系统进行动态观察.为保证活体细胞样品在37℃的恒温环境下生长,物光光路周围配备了一个半封闭的圆柱形热水循环设备,培养皿、光纤准直镜和显微物镜都放置于此设备中心的空腔里.实验中所用CMOS相机的分辨率为1024×1024,像素大小为6.7μm ×6.7μm,拍摄获取全息图的曝光时间约为10ms.采用定时拍摄功能,每隔1min获取一幅数字全息图,连续观察了8 h,共得到480幅全息图.利用之前所述的数值再现方法进行解算,即可得到反映活体细胞生长变化的显微图像.图3a是获取的第一幅数字全息图,图3b和图3c分别为利用此幅全息图再现得到的振幅图和相位图.由于活体细胞近似透明且没有经过染色处理,振幅图中细胞的轮廓和形态特征并不明显,而相位图则较为清晰地反映了细胞引入的光程变化和形貌特征.视场中存在很多细胞,每个细胞都可以进行独立的动态分析.图4中显示了图3c虚线框内的细胞在观察开始后0,40和80min 3个不同时刻的相衬显微图.从图中可以看出,随着时间的推移,此细胞发生了明显的运动和形态变化.实验中利用20×显微物镜进行预放大,成像分辨率达到了微米量级.

图3 小鼠活体骨细胞样品的数字全息显微观察实验结果
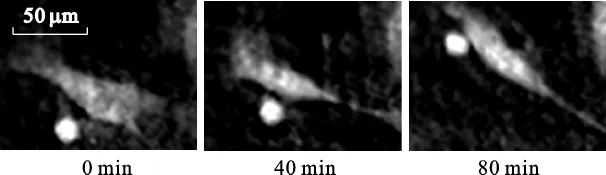
图4 小鼠活体骨细胞样品在不同时刻的相衬显微图像
5 结论
数字全息显微术提供了一种无损、无标记的高分辨率定量相衬显微方法.利用单模光纤和光纤器件可以优化数字全息显微装置的光路结构,增强紧凑性和灵活性.采用曲率匹配透镜和数字相位掩模相结合的方法,可以对相位畸变进行有效校正.小鼠活体骨细胞的实验结果表明,数字全息显微术可以动态获得高分辨率的活体细胞相衬显微图像,从而用于分析细胞的生长变化和运动过程.通过对实验装置和再现算法进行进一步优化,数字全息显微术将可以更为广泛地应用于生物活体组织和细胞的动态观察,从而促进对生物过程的理解,推动生命科学研究的发展.
References)
[1] Schnars U,Jüptner W.Direct recording of holograms by a CCD target and numerical reconstruction [J].Applied Optics,1994,33(2):179-181
[2] Hossain M M,Shakher C.Temperature measurement in laminar free convective flow using digital holography[J].Applied Optics,2009,48(10):1869 -1877
[3] Ferraro P,Grilli S,Alfieri D,et al.Extended focused image in microscopy by digital holography [J].Opt Express,2005,13(18):6738-6749
[4] Cuche E,Marquet P,Depeursinge C.Simultaneous amplitude contrast and quantitative phase contrast microscopy by numerical reconstruction of Fresnel off axis holograms[J].Applied Optics,1999,38(34):6994 -7001
[5] Dubois F,Callens N,Yourassowsky C,et al.Digital holographic microscopy with reduced spatial coherence for three-dimensional particle flow analysis[J].Applied Optics,2006,45(5):864 -871
[6] Pan Feng,Xiao Wen,Rong Lu.Long-working-distance synthetic aperture Fresnel off-axis digital holography [J].Opt Express,2009,17(7):5473 -5480
[7] Rappaz B,Marquet P,Cuche E,et al.Measurement of the integral refractive index and dynamic cell morphometry of living cells with digital holographic microscopy [J].Opt Express,2005,13(23):9361-9373
[8] Kemper B,Carl D,Schnekenburger J,et al.Investigation of living pancreas tumor cells by digital holographic microscopy[J].J Biomed Opt,2006,11(3):034005-1 -6
[9]赵洁,王大勇,李艳,等.数字全息显微术应用于生物样品相衬成像的实验研究[J].中国激光,2010,37(11):2906-2911 Zhao Jie,Wang Dayong,Li Yan,et al.Experimental study on the quantitative phase contrast imaging of the biological samples by digital holographic microscopy [J].Chinese Journal of Lasers,2010,37(11):2906 -2911(in Chinese)
[10] Kreis T.Handbook of holographic interferometry[M].Weinheim:Wiley-VCH,2005
[11] Cuche E,Marquet P,Depeursinge C.Spatial filtering for zero order and twin-image elimination in digital off-axis holography[J].Applied Optics,2000,39(23):4070 - 4075
[12] Colomb T,Cuche E,Charrière F,et al.Automatic procedure for aberration compensation in digital holographic microscopy and applications to specimen shape compensation [J].Applied Optics,2006,45(5):851 -863

