微藻异养化培养的研究进展
周文俊,郑 立,韩笑天
(1.国家海洋局 第一海洋研究所 海洋生态研究中心,山东 青岛,266061;2.中国科学院海洋研究所 海洋生态与环境科学重点实验室,山东 青岛 266071)
微藻因其富含脂类、蛋白质和多糖,且具有光合作用效率高、生长周期短、可再生等突出特点,在食品、医药、保健品及生物能源领域得到了广泛应用[1-2]。但是,如何通过人工大规模培养技术高效率地获得微藻生物量是微藻资源开发利用的关键。现在的微藻培养技术多集中于光自养体系,包括户外开放式养殖和各种光生物反应器。然而,户外的开放式养殖生产效率低、占地面积大且易染菌;光生物反应器虽然具有无污染、培养条件可控、密度高、易收获等优点[3],但其又有建设费用高、培养后期光合效率低[4]、生长速度不够快等不足之处。近年来,针对目标产物,逐渐兴起了利用异养化技术进行微藻的高细胞密度培养技术,该技术可以克服户外开放式养殖和光生物反应器培养的诸多缺陷,具有生长速度更快、能实现纯种培养、单位体积产率高、便于自动化控制等优势。因此,异养化培养技术成为近年来微藻培养研究的热点。然而,微藻异养化也存在诸如目标产物含量低、产出成本高、大规模培养下如何控制杂菌污染等技术瓶颈尚待突破,针对这些问题,作者对微藻异养化过程中的影响因素及关键技术的研究进展进行介绍和总结,并就如何突破瓶颈提出了可能的方法。
1 微藻异养化技术的应用现状
微藻异养化培养一般是指在培养设备中让微藻利用添加在培养基中的有机碳源和(或)有机氮源而不依赖于光照进行生长增殖的过程 ,以达到较高的细胞密度和较大的生物量。当前,微藻异养化培养已经进入了一个从单纯的实验室培养研究到大批量产业化生产应用的过渡阶段。据国内外文献报道[5-6]已有涉及蓝藻门、隐藻门、甲藻门、金藻门、黄藻门、硅藻门、裸藻门和绿藻门等8门60多属的近百种微藻可以进行异养生长, 其中某些微藻经过优化培养后,其生物量或有用生化产物得到了较大的提高,如普通小球藻(Chlorella vulgaris)批量异养发酵后的平均生物量可达 46.8 g/L[7],清华大学的吴庆余等[8]通过葡萄糖的批式流加培养的异养原始小球藻(C.protothecoides),生物量超过了100 g/L。这些异养微藻很多都已用于产业化生产,其应用价值主要表现在两个方面:作为水产饵料和提取生化产物,其中尤以后者备受关注,如用于生产多不饱和脂肪酸(PUFAs)、生物色素以及微藻多糖等。二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)是异养微藻PUFAs中的主要成分,它们具有独特的生理功能,可预防心血管疾病、提高人体免疫机能,利用异养微藻来提取生产EPA和 DHA可以克服传统从深海鱼油中提取在原料来源、生产成本以及季节限制等方面的不足。如美国Martek公司利用大规模的工业化发酵异养培养微藻来生产 DHA成品,成为该行业的佼佼者[9]。微藻生物色素和微藻多糖等在医疗、食品以及保健等方面也已经形成了产业化生产,如具有抗衰老、抗突变能力的 β-胡萝卜素,具有强抗氧化能力的虾青素等[10]。另一方面,异养微藻所富含的脂肪酸也是生产环保型能源生物柴油的重要来源,如何提高藻细胞的产油率以及通过何种工艺更有效地将其转化为廉价的生物柴油成为近年来研究的热点[11-13]。缪晓玲等从异养小球藻中提取大量油脂,经酯交换反应后获得生物柴油,其各项指标特征与传统柴油相当,具有很高的应用价值[14]。
2 微藻异养化的影响因素
2.1 微藻自身因素
微藻能否异养,最主要的因素是该株藻是否具备完善的吸收利用胞外有机碳和有机氮的机制。吴耀庭等[10]根据Gladue的理论以及近年来的研究结果,总结完善了三条假说:(1)通透性障碍。有些微藻因为有机物难以透过细胞膜进入细胞或者缺乏浓缩有机物的能力而不能被异养;(2)相关酶的缺乏。有机物在细胞内进行代谢所需的酶系统不完善,有机物不能被有效利用,造成某些微藻难以异养;(3)限制性的呼吸能力。在异养条件下,某些微藻因呼吸作用所提供的能量不足以维持其生长而不能异养。
目前,关于微藻异养这一相当复杂的过程,其机理尚未得到系统而确切的解析。仅以一株圆心目硅藻(Melosira nummuloides)对有机氮源氨基酸的摄取为例,已经发现细胞中至少有碱性、酸性和中性氨基酸的三种不同转运体系,而其中涉及中性氨基酸吸收的载体也远不止一个[15]。所以,一株可异养微藻,其藻细胞浓缩有机物能力的大小、酶的工作效率以及呼吸作用的强度等这些复杂的因素都对该株藻的异养效率有直接影响。
2.2 生物因素
影响微藻异养的生物因素主要指存在于藻液中的细菌和真菌。在光照自养条件下,由于藻液中缺乏充分的有机营养源,所以真菌和细菌不会大量繁殖和生长,它们只能通过利用微藻代谢或死亡所产生的微量有机物和有机碎屑而与微藻形成一种共生关系。但在异养条件下,与微藻共生的细菌或真菌将利用人为添加的有机营养物质进行大量繁殖,一方面,它们与微藻形成营养竞争关系,另一方面,它们的代谢产物可能对微藻具有抑制或杀伤作用[16],从而影响微藻的异养效率,甚至致使其不能生长繁殖。所以,在对微藻进行异养之前首先要除去微藻中的细菌和真菌,以防止它们对微藻异养化生长的影响。
2.3 营养因素
2.3.1 碳源
微藻的异养生长需要从外界摄取大量有机碳。有机碳的种类繁多,但可以作为微藻异养化的碳源却不多,它们主要是糖类、醋酸盐以及有机酸等,其中以糖类居多。de Swaaf等[17]人用葡萄糖作为碳源成功异养了寇氏隐甲藻(Crypthecodinium cohnii),并使异养生物量的最大值高达83g/L,远远高于其光合自养时的生物量。平滑菱形藻(Nitzschia laevis)、绿球藻(Chlorococcumsp).以及亚心形扁藻(Platymonas subcordiformis)等都可以利用葡萄糖作为碳源进行异养生长,并且均可达到较高的生物量[18-20]。尹建云等[7]利用玉米淀粉经过高温淀粉酶和糖化酶双酶解后所产生的酶解糖来替代葡萄糖作为碳源,实现了普通小球藻Chlorella vulgaris高密度大批量的试验性异养生产。除了使用单一碳源的方式外,研究人员也通过添加复合碳源来异养培养微藻。缪晓玲等[21]在异养培养原始小球藻(C.Protothecoides) 时以葡萄糖、淀粉、有机废水和二氧化碳等作为复合碳源,既实现了微藻的高密度培养,又节省了异养成本,同时,对废物的再利用也减轻了对环境的压力。
选用何种有机碳源进行微藻异养化取决于微藻的种类、异养化生产的终产物以及碳源成本等。例如在异养寇氏隐甲藻时,葡萄糖和醋酸均可作为碳源,但为了提高不饱和脂肪酸 DHA的产率,以醋酸作为碳源则更合适,其DHA的产率可以达到1.152 g/(L·d),高于葡萄糖作为碳源时的产率[22]。
2.3.2 氮源
氮素是微藻生长所必须的基本元素之一,也是藻体内合成蛋白质、核酸以及叶绿素等的主要成分。可作为微藻异养化的氮源较多,包括氨氮、铵态氮、硝态氮等无机氮源和尿素、酵母浸出粉、胰蛋白胨以及氨基酸等有机氮源。不同藻种对不同种类和形态的氮源的吸收利用各异,并直接影响微藻的生长状况、细胞内饱和脂肪酸与不饱和脂肪酸的含量与比例以及胞外代谢产物的形成等[23,24]。在使用单一氮源时,有人比较了硝酸盐、铵盐和尿素对异养原始小球藻Chlorella protothecoides的生物量和叶黄素含量的影响,结果发现,当三者氮质量浓度为0.85~1.7g/L时,它们对微藻生长的影响没有显著差异,氮质量浓度为1.7 g/L时可分别获得最大生物量为18.4、18.9、19.6 g/L细胞干质量[25]。在使用复合氮源异养培养平滑菱形藻时,硝酸盐、胰蛋白胨和酵母浸出粉的混合物可作为最佳氮源,当质量浓度分别为0.62、1.6、0.8 g/L时,微藻的生物量、EPA含量及其产量分别可达到 6.48 g/L、2.74%和 175 mg/L[26]。
一般而言,氮源浓度的增加提高了蛋白质的含量,但降低了脂类和碳水化合物的含量[27]。因此,为了既使微藻能够有充足的碳源来吸收合成生长代谢所需的糖类物质和储存能量的脂类物质,又不至于因为氮源的匮乏或过量而影响蛋白的合成,在高细胞密度、高目标产物产率的异养培养中很有必要考察培养基中初始的C/N比。Chen等[29]研究了C/N比对异养群孢小球藻(Chlorella sorokiniana) 生长和生化产物含量的影响,结果发现C/N比值为20时是其从受碳限制向氮限制转变的一个拐点,此时细胞的脂质含量最低。当 C/N比增大或者减小都会使细胞脂质含量增加,较低的 C/N比有利于提高三烯脂肪酸的含量[28]。张丽君等在对普通小球藻的异养培养条件进行优化时则发现C/N比在4:1~5:1时可以获得最大的生物量。
2.3.3 磷源
磷是细胞中基因结构的基础,并在生命活动中以ATP和ADP的形式对能量的产生、转换和储藏起到关键作用。磷脂是细胞中多不饱和脂肪酸的主要存在形式,因此培养基中磷素的水平将显著影响微藻细胞内多不饱和脂肪酸的含量,如0.3~30 mmol/L的磷有利于紫球藻(Porphyridium purpureum) 的生长及其 EPA的积累[30],但这仅限于自养,微藻异养常用磷酸盐为磷源,但目前国内外尚没有关于不同磷浓度对异养微藻的生长和生化成分的影响的研究报道。
2.4 环境因素
2.4.1 温度
微藻异养过程中,温度过高或过低都将影响与生长、合成以及代谢相关酶的活性,从而降低完成该过程的效率。对于异养普通小球藻,其适宜温度范围较大,在一定范围内升高温度可以提高藻细胞的比生长速率,并获得较高的生物量[31]。而低温则有利于微藻细胞多不饱和脂肪酸(PUFAs)的积累,如Stephen等[32]发现虽然温度对于异养隐匿小环藻(Cyclotella cryptica)的总脂含量没有明显的影响,但随着温度的降低,不饱和脂肪酸和饱和脂肪酸的比值却在增大。同样,异养寇氏隐甲藻在低温时虽然生长较慢,但其DHA含量却比高温时要高[33]。在生产过程中为了获得较高的 PUFAs产量,可以在最适生长温度下培养一定时间以获得较高的生物量,然后在合适的低温下继续培养以积累较高的PUFAs[34]。
2.4.2 pH
pH的变化将影响微藻细胞内外的酸碱环境、离子的平衡以及膜结构的渗透性等,pH过高或过低都将抑制微藻的生长。由于微藻在生长的过程中可能会产生一些代谢产物或者是由于摄取了培养基中的营养成分而使培养基的pH发生改变,所以需要不断补料调整 pH使其处于一个稳定的适宜微藻生长的状态。异养普通小球藻可以通过自身的吸收或代谢,在一段时间内将pH调整到最适值8.5左右,为了消除碱性培养基灭菌后颜色加深对观察带来的影响,初始pH最好选择在6~7之间[29]。此外,pH的变化也会影响微藻细胞的脂肪酸含量及其组成。有人在研究异养寇氏隐甲藻时发现,当培养基的pH为7.2时细胞增长率最高,并可获得最大的脂肪酸不饱和度和最高的DHA含量,当初始pH分别为4和10时细胞增长相当缓慢,脂肪酸不饱和度也随之降低[35]。
2.4.3 溶氧量
微藻在异养培养的过程中需要摄取大量的氧进行呼吸作用产生能量,以维持细胞内正常的生命活动,如果培养基中溶氧不足将会影响微藻的生长和繁殖。通气量大小应与藻密度保持一致,如尹建云等在异养发酵普通小球藻时藻细胞生物量随着通气量的增加而增加,通过阶段性的增大通气量可获得最大生物量[7]。此外,溶氧量还会影响藻细胞中脂类的含量及组成。Chen等[28]研究发现,当通气量加大时会促进异养群孢小球藻的生长,并有利于不饱和脂肪酸的合成,但脂类的总量将会下降。这可能是因为在低溶氧量的条件下细胞内脂类代谢较慢,所以其积累量较多,但由于缺乏氧分子参与脂肪酸脱氢酶的作用,使得脂肪酸的不饱和度较低;而增加溶氧量可使脂类代谢加快、积累量降低,但有利于不饱和脂肪酸的合成,所以脂肪酸的不饱和程度明显增高。
2.4.4 盐度
盐度对微藻的异养生长和细胞生化成分也具有一定的影响,如异养培养平滑菱形藻时,氯化钠质量浓度为14 g/L时最适其EPA的生成,氯化钠质量浓度为8 g/L时则最适其生长[36]。目前,关于盐度对微藻异养的影响,尚没有深入而全面的研究,这主要是因为现已发现的可异养藻株多为淡水种,在以提高生物量和有用生化成分为目的的研究中并未将盐度这一胁迫因素考虑在内,但在以后研究海洋异养藻株时应充分考虑此因素的作用。
3 微藻异养化关键技术
3.1 微藻无菌化处理
在对微藻进行异养培养前必须先获得无菌藻株。传统的物理方法如离心洗涤法、毛细吸管法和稀释涂布法等都难以获得完全无菌的藻株[37]。射线辐照法,即利用微藻和杂菌对紫外等射线抗性的差异而选用合适的辐照对藻液进行处理虽可除去杂菌,但由于辐照对微藻的生理特性具有很明显的影响[38],所以该法只适用于一些抗辐照能力较强的具胶质鞘微藻。
目前,微藻的无菌藻株一般是通过化学方法获得的。化学方法主要是指抗生素法,即利用抗生素的抑菌或杀菌作用将藻液中的杂菌除去。但抗生素也会对微藻的细胞形态、生理特性以及生化成分造成影响,所以用于除菌的抗生素应具备两个特点:较强的抑菌或杀菌能力和对微藻较小的伤害性[39]。不同的微藻种类其杂菌群落不同,所以选择的抗生素种类和给药浓度也不同。常用的抗生素有青霉素、卡那霉素、链霉素、庆大霉素以及氯霉素等。单种抗生素给药往往难以完全除菌,所以通常将若干种抗生素联合使用以达到更好的除菌效果。林伟用青霉素等五种抗生素对若干种微藻进行无菌化处理,抗生素浓度从50 IU/mL到1000 IU/mL,单独或混合给药,最终获得了中肋骨条藻(Skeletonema costatum) 、微小原甲藻(Prorocentrum minimum)、锥状斯克利普藻(Scrippsiella trochoidea)、前沟藻(Amphidiniumsp.)和扁藻(Platymonassp.)的无菌藻株[40]。由于上面这些抗生素都是针对细菌的,而藻液中往往存在一些真菌或其孢子,使用两性霉素 B可有效地除去[41]。作者在无菌化处理球等鞭金藻(Isochrysis galbana)时发现用链霉素、青霉素以及卡那霉素联合处理后虽可除去藻液中的细菌,但仍有真菌存在,在使用两性霉素 B进行后继处理之后最终获得无菌藻株。另外,还可使用某些化学消毒剂(如次氯酸钠等)杀灭细菌,但由于这些化学消毒剂对微藻细胞伤害很大[37],所以一般很少使用。
物理方法对藻细胞伤害小但除菌效果不理想,化学方法除菌较为理想但对藻细胞有影响,所以可以将物理方法和化学方法适当的结合起来以减小对藻株的影响。经过无菌化处理的藻株,可以采用培养检测法和荧光染色镜检法来进行检测[40],确定是否达到除菌目的。
3.2 微藻异养化改造
3.2.1 通过异养培养条件进行微藻的筛选
虽然有文献报道在富营养化废水中筛选到可异养的小球藻[42],但异养型微藻藻株主要是通过对大量藻种于异养条件下进行筛选而获得的。Gladue等[5]用添加了适量葡萄糖的异养培养基在黑暗条件下培养微藻,最终从大量藻株中筛选出57株具有异养能力的微藻。但那些未筛选出来的藻株未必一定不能异养,因为很难确定它们是否能利用除实验中所添加的葡萄糖之外的其他有机碳源进行生长。Gladue给出了3个微藻异养培养基配方(表1),被认为是目前用于异养培养的较好配方。但由于藻种的差异,在具体操作时研究者可以再做优化,如有机碳源的种类和添加量。笔者在培育异养化的海洋小球藻时发现一次添加的有机碳源如果过多(>15g/L)则会抑制微藻的生长,可少量多次(每次 5g/L)添加以提高微藻对有机碳源的利用率。
3.2.2 利用生物工程手段进行异养化改造
除了通过异养化条件筛选异养藻株外,近年来国内外的研究人员都在尝试通过生物工程手段来改造微藻,以期获得更为理想的异养型藻株。
异养化改造的原因是原微藻虽然目标产物含量很高,但不可异养或异养效率不高,难以达到高密度培养。对于这种情况,有报道利用细胞融合技术将光合自养微藻和某种细菌或其他可异养微藻进行细胞融合,以得到一种新的可异养的藻株。沈继红等[43]将富含EPA和 DHA的自养微藻绿色巴夫藻和生长迅速的异养微藻四鞭藻相融合,筛选出了可异养的融合藻株,融合藻株的总脂、EPA和DHA均比异养亲本四鞭藻有较大的提高。此外,还可以根据限制微藻异养的遗传因素来改造微藻基因,如 Zaslavskaia等[44]将编码葡萄糖转运体的基因导入一株原本不能进行异养生长的三角褐指藻(Phaeodactylum tricornutum)的细胞中,便可使其在黑暗条件下利用外源葡萄糖进行异养生长。陈涛等[45]从人胎盘组织中克隆出人红细胞葡萄糖转运基因(Glut1),并分别构建了盐藻诱导型异养表达载体pMDDGN-Bar和组成型异养表达载体 G5Glut1-Bar,通过电击转化法转化盐藻,最终使Glut1得到表达,这为盐藻的进一步异养化培养打下了基础。
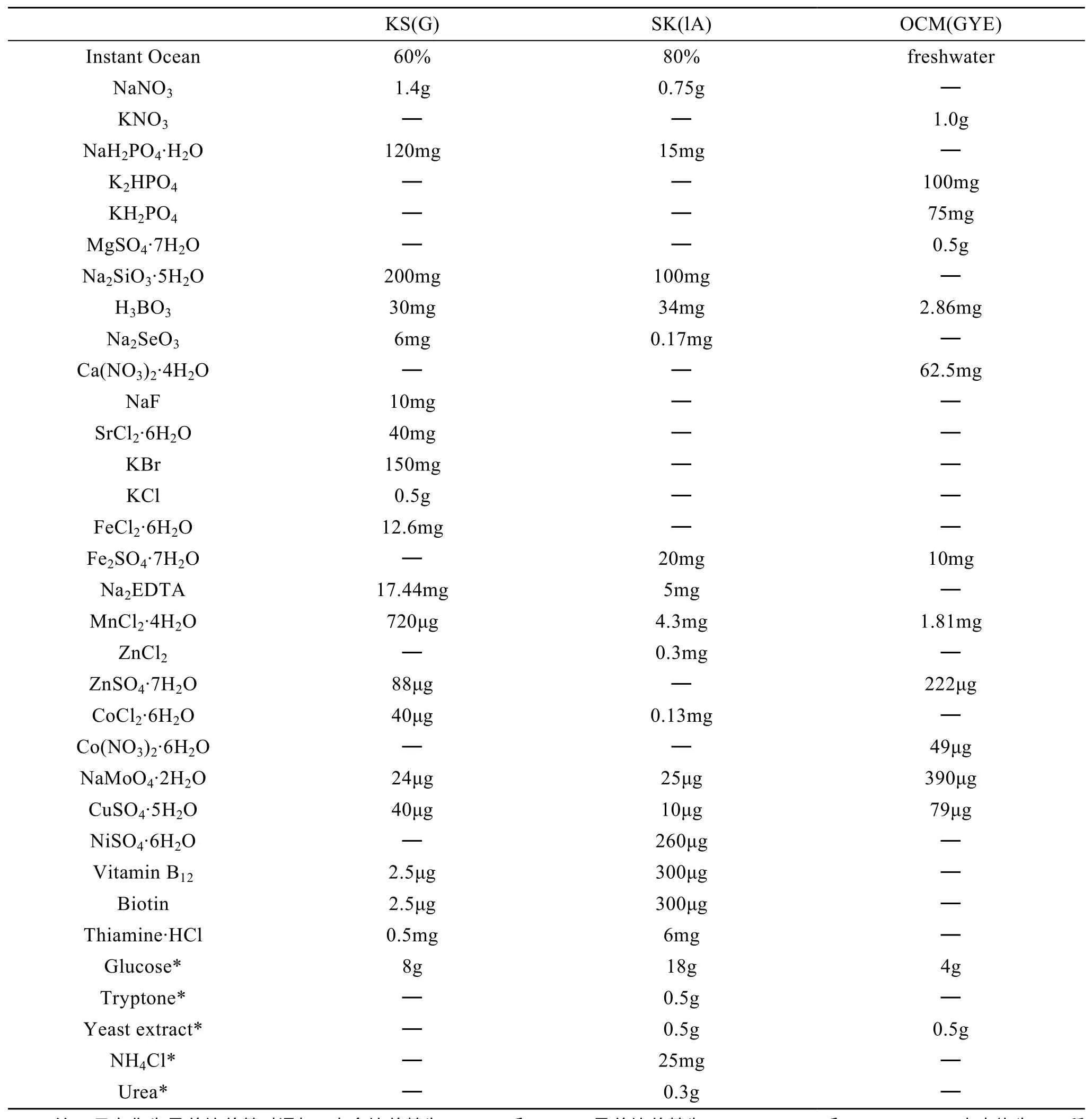
表1 微藻异养培养基[5]
3.3 微藻异养化培养形式
对异养微藻进行高密度培养主要有两种形式,一是利用改进的密闭式光生物反应器进行兼养,二是直接利用微生物发酵罐进行无光异养。所谓兼养是指微藻在有光照的条件下既可以利用培养基中的有机碳源进行异养生长,又可以利用光照进行光合作用,一般而言,可异养微藻都可兼养生长。某些微藻种类在兼养时其生物量远大于自养和无光异养时的生物量,如卡德藻(Tetraselrnissp.)在兼养时的最大细胞密度可以达到自养时的3.2倍,大于自养和无光异养最大细胞密度之和[46]。密闭式光生物反应器主要有管式、平板式以及柱状气升式等几种形式,目前尚处于发展阶段,在材料、设计以及条件控制方面还存在技术上的难题。相对而言,利用微生物发酵罐技术进行无光异养则较为成熟,发酵体积可达数十吨,容易使异养微藻形成产业化大批量生产,如国内的尹建云等[7]、吴庆余等[7]将发酵罐培养技术应用于异养微藻的培养,达到了较高的藻密度,美国的Martek公司也使用发酵罐培养异养微藻实现了DHA成品的生产[9]。
4 微藻异养化发展的限制因素及几点建议
经过科研人员的不懈努力,微藻异养化已从单纯的实验室研究逐步向产业化生产转化,并已在相关领域取得了显著的成果,但要实现微藻异养的产业化,仍然存在以下的瓶颈:(1) 可异养化或异养效果好的藻种依然很有限。已记载的可异养的微藻已达近百种,但真正能高效异养的却仅限于绿藻门的小球藻属、硅藻门的小环藻属以及甲藻门隐甲藻属等少数几种藻类;(2) 异养化培养周期长,耗时耗力。当前异养微藻发酵培养的一个培养周期为 5天左右,仅比自养培养周期缩短了一半,而一般的异养微生物培养周期只有1到2天,所以异养微藻培养周期还有待缩短;(3) 异养化微藻密度不够大。异养发酵时藻生物量的理论最大值为150~200 g/L[10],但目前发表的文献中最大值也只有 108 g/L[8],所以异养微藻的生物量还有待提高;(4) 高密度异养对氧的需求往往成为发酵过程能否成功的关键因素。在高密度下培养基黏度很大,溶氧很困难,能耗很高;(5) 异养化生产成本高,主要是异养碳源价格较高,使得异养化生产的目的只能针对高附加值产品。另外,在目前的研究中只重视碳源的最佳浓度,而对其利用率缺少考察,碳源的过度添加将造成物料的浪费和成本的增加。
针对以上限制因素,作者提出下面几点建议:
(1) 利用当前先进的基因工程和原生质融合手段开发异养型工程微藻;(2) 设计更有效的异养微藻生物反应器,采用合理的培养形式,以提高生产效率;(3) 优化培养条件,探实合适生长的理化因子,深入研究生化产物的积累特点,提高目标产物的含量;(4) 为解决高密度培养时溶氧难的问题,需研究开发低能耗的气液混合强化器,并将其应用于生物反应器中;(5) 使用替代碳源,如玉米淀粉、甘蔗、秸秆以及工业废水等,以降低异养成本。
相信随着现代科技的突飞猛进,微藻异养化的研究也将步上一个新的台阶,并以其强大的应用潜力惠及人类,造福社会。
[1]Kyle D J.Production and use of lipids from microalgae[J].Lipid Technol,1992,4(3):59-64.
[2]Borowitzka M.Microalgae source of pharmaceuticals and other biologically active compounds[J].Journal of Applied Phycology,1995,7:3-15.
[3]夏金兰,万民熙,王润民,等.微藻生物柴油的现状与进展[J].中国生物工程杂质,2009,29(7):118-126.
[4]Eriksen N T.The technology of microalgal culturing[J].Biotechnology Letters,2008,30:1525-1536.
[5]Gladue R M,Maxey J E.Microalgal feeds for aquaculture[J].Journal of Applied Phycology,1994,6:131-141.
[6]马志珍.微藻的异养培养技术及应用[J].国外水产,1995(4):3-9.
[7]尹建云,孟海华,张学松,等.酶解糖异养培养微藻发酵条件的优化及生产试验[J].食品与发酵工业,2006,32(5):55-57.
[8]吴庆余,熊伟.一种从自养到异养两步培养小球藻生产生物柴油的方法[P].中国专利:200810112998,2008-10-8.
[9]Martek Contracts Ltd.Company overview of martek[EB/OL].[2010-04-08].http://www.martek.co.uk/index.php/about/company-overview.html.
[10]吴耀庭,魏东,陈俊辉,等.微藻异养化高细胞密度培养技术及其应用[J].中国食品添加剂,2008,专论综述:65-70.
[11]Cheng Y,Zhou W G,Gao C F,et al.Biodiesel production from Jerusalem artichoke (Helianthus Tuberosus L.) tuber by heterotrophic microalgaeChlorella protothecoides[J].Journal of Chemical Technology &Biotechnology,2009,84(5):777-781.
[12]Xiong W,Li X F,Xiang J Y,et al.High-density fermentation of microalgaChlorella protothecoidesin bioreactor for microbio-diesel production[J].Applied Microbiology and Biotechnology,2008,78(1):29-36.
[13]Li X F,Xu H,Wu Q Y.Large-scale biodiesel production from microalgaChlorella protothecoidesthrough heterotrophic cultivation in bioreactors[J].Biotechnology and Bioengineering,2007,98(4):764-771.
[14]缪晓玲,吴庆余.微藻油脂制备生物柴油的研究[J].太阳能学报,2007,28(2):219-222.
[15]Hellbust J A,Lewin J.Heterotrophic nutrition[M].In:Werner D.The Biology of the Diatoms.University of California Press,Berkeley.1977:169-197.
[16]Mayali X,Doucette G J.Microbial community interactions and population dynamics of an algicidal bacterium active againstKarenia brevis(Dinophyceae)[J].Harmful Algae,2002,1(3):277-293.
[17]de Swaaf M E,Pronk J T,Sijtsma L.Fed-batch cultivation of the docosahexaenoic-acid-producing marine algaCrypthecodinium cohniion ethanol[J].Applied Microbiology and Biotechnology,2003,61:40-43.
[18]Wen Z Y,Chen F.Perfusion culture of the diatomNitzschia laevisfor ultra-high yield of eicosapentaenoic acid[J].Process Biochemistry,2002,38:523-529.
[19]缪礼鸿,文金丽,邹有红,等.1株异养型绿球藻的生长特性及营养价值评价[J].华中农业大学学报,2007,26(4):533-537.
[20]Xie J L,Zhang Y X,Li Y G,et al.Mixotrophic cultivation of Platymonas subcordiformis[J].Journal of Applied Phycology,2001,13:343-347.
[21]Miao X L,Wu Q Y.Biodiesel production from heterotrophic microalgal oil [J].Bioresource Technology,2006,97:841-846.
[22]de Swaaf M E,Sijtsma L,Pronk J T.High-cell-density fed-batch cultivation of the docosahexaenoic acid producing marine algaCrypthecodinium cohnii[J].Biotechnology and Bioengineering,2003,81(6):666-672.
[23]Wu Z Y,Wu S M,Shi X M.Supercritical fluid extraction and determination of lutein in heterotrophically cultivatedChlorella pyrenoidosa[J].Journal of Food Process Engineering,2007,30(2):174-185.
[24]You S,Zheng B S,Guo S Y.Efect of nitrogen on accumulation of Spirulina Platensis exopolysacchride[J].Food Science,2004,25(4):32-35.
[25]Shi X M,Zhang X W,Chen F.Heterotrophic production of biomass and lutein byChlorella protothecoideson various nitrogen sources[J].Enzyme and Microbial Technology,2000,27(3-5):312-318.
[26]Wen Z Y,Chen F.Heterotrophic production of eicosapentaenoid acid by the diatomNitzschia laeviseffects of silicate and glucose[J].Journal of Industrial Microbiology&Biotecnology,2000,25:218-224.
[27]刘晓娟,段舜山,李爱芬.不同营养因子对微藻3种培养方式生产 EPA的影响[J].食品研究与开发,2006,27(8):185-188.
[28]Chen F,Michael R J.Effect of C/N ratio and aeration on the fatty acid composition of heterotrophicChlorella sorokiniana[J].Journal of App1ied Phycology,1991,3(3):203-209.
[29]张丽君,杨汝德,肖恒.小球藻的异养生长及培养条件优化[J].广西植物,2001,21(4):353-357.
[30]Ohta S,Chang T,Aozasa O,et al.Alterations in fatty acid composition of marine red algaPorphyridium purpureumby environmental factors[J].Botanica Marine,1993,36:103-107.
[31]余若黔,刘学铭,梁世中,等.小球藻(Chlorella vulgaris)的异养生长特性研究[J].海洋通报,2000,19(3):57-62.
[32]Pahl S L,Lewis D M,Chen F,et al.Heterotrophic growth and nutritional aspects of the diatomCyclotella cryptica(Bacillariophyceae):Effect of some environmental factors[J].Journal of Bioscience and Bioengineering,2010,109(3):235-239.
[33]Jiang Y,Chen F.Effects of temperature and temperature shift on docosahexaenoic acid production by the marine microalgeCrypthecodinium cohnii[J].Journal of the American Oil Chemists' Society,2000,77(6):613-617.
[34]蒋汉明,翟静,张媛英,等.温度对海洋微藻生长及脂肪酸组成的影响[J].食品研究与开发,2005,26 (6):9-12.
[35]Jiang Y,Chen F.Effects of medium glucose concentration and pH on docosahexaenoic acid content of heterotrophicCrypthecodinium cohnii[J].Process Biochemistry,2000,35:1205-1209.
[36]Wen ZY,Chen F.Application of statistically-based experimental designs for the optimization of eicosapentaenoic acid production by the diatomNitzschia laevis[J].Biotechnology and Bioengineering,2001,75(2):159-169.
[37]汪本凡,赵良侠,叶霁,等.微藻无菌化技术的研究进展[J].微生物学通报,2007,34(2):363-366.
[38]蔡恒江,唐学玺,张培玉.3种赤潮微藻对 UV-B辐射处理的敏感性[J].海洋科学,2005,29(3):30-32.
[39]赵培,王雪青,朱潮峰,等.3种常用抗生素应用于海洋微藻无菌化培养的研究[J].天津师范大学学报,2007,27(2):27-30.
[40]林伟.几种海洋微藻的无菌化培养[J].海洋科学,2000,24(10):4-6.
[41]陈裕充,温海.两性霉素 B及其脂质体的抗真菌机制[J].中国真菌学杂志,2006,1(5):312-314.
[42]闫海,周洁,何宏胜,等.小球藻的筛选和异养培养[J].北京科技大学学报,2005,27(4):408-412.
[43]沈继红,林学政,刘发义,等.细胞融合法构建EPA和DHA高产异养藻株的研究[J].中国水产科学,2001,8(2):63-66.
[44]Zaslavskaia L A,Lippmeier J C,Shih C,et al.Trophic conversion of an obligate photoautotrophic organism through metabolic engineering[J].Science,2001,292(5524):2073-2075.
[45]陈涛,刘红涛,吕鹏举,等.杜氏盐藻异养表达载体的构建及异养转化株的鉴定[J].生物工程学报,2009,25(3):392-398.
[46]刘晨临,王秀良,张学成.卡德藻自养、异养与兼养培养的比较研究[J].青岛海洋大学学报,2002,32(4):579-584.

