微拟球藻原生质体制备与再生
马晓磊,张 琳,杨官品,朱葆华,潘克厚
(1.中国海洋大学 海水养殖教育部重点实验室 应用微藻生物学研究室,山东 青岛 266003;2.中国海洋大学 海洋生命学院,山东 青岛 266003)
随着陆地资源的日益匮乏,开发和利用海洋,从海洋生物资源中索要食品、药品和能源已成为人们的共识,也是研究者的研究重点和热点。海洋微藻是海洋生态系统中重要的初级生产者,种类繁多,数量庞大,尤其是一些经济微藻已经成功地为人类提供了丰富的资源。但是,自然资源的开发在一些研究和应用领域已经不能满足人类的需求,随着基因工程技术与手段的成熟与开发,通过对海洋微藻进行基因工程操作来研究和开发微藻已成为生产高附加值产品和选育藻种的重要手段。但相对于高等植物和大型藻,微藻基因工程改造才刚刚起步,其中微藻原生质体的制备是基础。本文旨在寻求一种高效简便的海洋微藻原生质体制备和观察方法,从而为在微藻中进行基因工程操作奠定基础。
微拟球藻(Nannochloropsis oculata)是单细胞真胞藻,属真眼点藻纲,长2~5 µm[1-3],广泛分布于海水、淡水中。它不仅被广泛用于水产动物的饵料[4],还是许多高附加值产品的重要来源,如蛋白、色素、多不饱和脂肪酸等[5],是一个具有较高经济价值的海洋藻种,也是进行遗传育种改造的良好材料。本研究在 Chen等[8]方法的基础上,综合考虑酶处理时间和初始细胞密度两个因子,选取半纤维素酶(Hemicellulase)和崩溃酶(Driselase)混合液制备原生质体。同时将原生质体细胞染色后于荧光显微镜下观察拍照,并进行了原生质体细胞的再生实验。
1 材料与方法
1.1 实验试剂及仪器
微拟球藻培养基母液配制使用的生化试剂均由国药集团化学试剂有限公司生产。光照培养箱购自南京金恒实验仪器厂。
制备原生质体所用半纤维素酶(Hemicellulase)和崩溃酶(Driselase)以及原生质体染料 Calcofluor White均购自美国Sigma公司。
再生培养基:在新鲜 f/2海水培养基中添加渗透压稳定剂(0.2M KCl溶液)和原生质体膜稳定剂(0.1% CaC12),固体培养基另加 1.0%~1.2% 琼脂制备。
1.2 藻种培养
微拟球藻(Nannochloropsis oculata)购于澳大利亚微藻种质库(Australian CSIRO Collection of Living Microalgae,http://www.cmar.csiro.au/microalgae),编号为CS-179。
培养条件:选用青岛近海海水,经0.4 μm 滤膜过滤后高压蒸汽灭菌。培养基为新鲜f/2海水培养基[6-7],pH 为 7.8,培养温度 25°C±1℃,盐度 30‰,70 μmol/(s·m2)光照连续培养,光暗比为 12h:12h。培养容器为三角烧瓶,置于光照培养箱中培养。
1.3 原生质体的制备
1.3.1 藻细胞的预处理
取培养至指数生长期的藻细胞培养液进行计数,在8 000 r/min下离心10 min收集藻细胞,用500 µL新鲜的f/2海水培养基冲洗细胞2~5次,保证细胞表面无营养盐和其他杂质以减少对原生质体制备的影响,再重悬于500 µL新鲜的f/2培养基中。
1.3.2 原生质体的制备方法
微拟球藻原生质体的制备在酶处理液的选择上参照Chen等[8]文献。实验选取处于指数生长期的藻细胞,在500 µL 密度为 1×107cells/mL,2×107cells/mL,3×107cells/mL 的藻细胞液中加入终浓度为4%半纤维素酶和2%崩溃酶溶液,调pH为5.0,用锡箔纸包被,保证严格避光,于摇床上进行80 r/min,37℃ 孵育,分别在酶处理0.5,1,2,3,3.5,4,4.5 h 7个时间点取样,用Calcofluor White染料进行染色后观察原生质体制备情况。对同一视野分别在可见光和荧光激发下进行观察拍照,每次取样至少拍摄三个视野,计算酶处理不同时间不同密度藻细胞原生质体的制备率。计算公式如下:

1.3.3 原生质体的显微观察
按照Calcofluor White染料的使用说明[9]进行原生质体显微观察样品的制备:取 20 µL制备的原生质体细胞于250 µL PCR管中,加入10 µL Calcofluor White染料和10 µL 10% KOH溶液,室温孵育 1 min以上,然后置于荧光显微镜在蓝光(波长范围为300~400 nm)激发下观察。
1.3.4 原生质体细胞的再生
分别取7个时间点酶处理样品100 µL原生质体细胞以1 000 r/min转速离心5 min收集,用500 µL新鲜的 f/2海水培养基轻轻重悬冲洗两次,再加入5 mL新鲜的f/2海水培养基,在200 r/min,28℃培养3~5 d。离心收集后重悬于20 µL新鲜的f/2海水培养基中,均匀涂布于再生培养基平板上,于 25℃光照培养箱中培养。每个样品设置3个重复。
1.3.5 原生质体再生率的计算
取100 µL酶处理后的原生质体悬液,分别使用低渗溶液(无菌水)和高渗溶液(0.2 mol/L KCl溶液)进行重悬处理,静置60 min后混匀取样用血球计数板进行计数。同时,将无菌水和高渗溶液稀释后的悬液分别接入低渗平板和再生平板,置于 28℃光照培养箱中培养,长出藻落后计数,计数方法参照王明兹等[10]的方法。

2 实验结果与讨论
2.1 不同酶处理时间和细胞密度对原生质体制备率的影响
对不同密度藻细胞(1×107,2×107,3×107cells/mL)进行不同酶处理时间,统计 7个时间点取样的原生质体细胞制备率如图1所示。发现对同一密度藻细胞处理1~3 h内原生质体制备率较高,并且在这3个时间点上相差不大。但是酶处理时间小于0.5 h或者大于3 h制备率都会下降。酶处理时间是影响原生质体制备率的一个重要因子。考虑到酶处理时间过长会对原生质的复壁产生影响,因此本实验认为适宜选用的酶处理时间为1 h。
对不同密度藻细胞进行酶处理相同时间比较发现,高密度的藻细胞要比低密度的藻细胞制备率较高,见图1。显微镜下观察不同密度藻细胞原生质体细胞酶处理1 h后发现细胞比较完整,且视野内没有出现藻细胞碎片。本实验选细胞密度为可能对2×107cells/mL进行原生质体制备。
不同的藻细胞密度和不同的酶处理时间都是制约原生质体制备率的关键因子。实验发现对同一细胞密度的藻细胞,酶处理时间过短或者过长都会降低原生质体的制备率,因此制备原生质体时必须选取合适的处理时间。酶处理时间短制备率低可能是因为酶反应时间不够充分,来不及将更多的藻细胞制备成原生质体;而延长处理时间可能使已经制备出的原生质体发生破裂导致原生质体制备率降低。因此,本实验建议选取的酶处理时间为1 h。
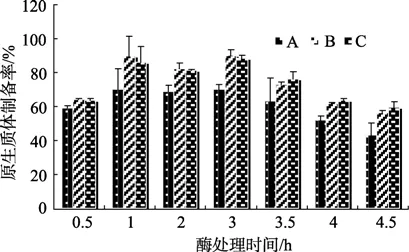
图1 不同细胞密度藻细胞进行酶处理不同时间原生质体的制备率Fig.1 Treatment time and different densities on the efficiency of protoplast preparation by enzym digestion
与 Chen等[8]的实验相比较,本研究进行了藻细胞密度对原生质体制备率的影响的实验。实验证明不同密度藻细胞原生质体制备率也不同,在一定范围内,原生质体的制备率随着细胞密度的增加而增加。当初始藻细胞密度达为2×107cells/mL,原生质体的制备率接近 90%。该实验结果与椭圆小球藻(Chlorella ellipsoidea)原生质体制备率相一致[11],推测可能是藻细胞密度高,相互之间接触比较频繁,有利于酶混合液的消化作用或者是酶混合液在细胞密度高的反应体系中能充分发挥出其活性。因此,为提高原生质体制备率,保持较高的初始藻细胞密度是十分必要的。
对原生质体制备后进行Calcofluor White染料染色,该染料绑定到细胞壁上的纤维素和几丁质,在显微镜下能在300~440 nm波长光激发下发出荧光,图2为原生质体制备后于荧光显微镜下拍摄照片,荧光显示的是细胞壁纤维素移除情况。
2.2 原生质体细胞的再生
综合考虑酶处理时间和初始细胞密度两个影响因子,选取初始密度为2×107cells/mL的藻细胞进行酶处理1 h后进行原生质体平板再生实验,以观察原生质体再生情况。取复苏3~5 d的原生质体细胞和稀释10倍后的细胞分别同时进行高渗和低渗平板培养再生。培养至第12 d原生质体在再生培养基上生长情况如图3所示,再生平板培养基上能观察到单个的藻落,这说明酶处理法制备的原生质体是可以再生的,取再生细胞在显微镜下镜检发现与未处理的藻细胞从形态上面未观察到差异。但是在低渗平板上培养的原生质体在培养至第4个周后仍然观察不到单藻落,这也说明酶处理法获得的原生质体制备率高。
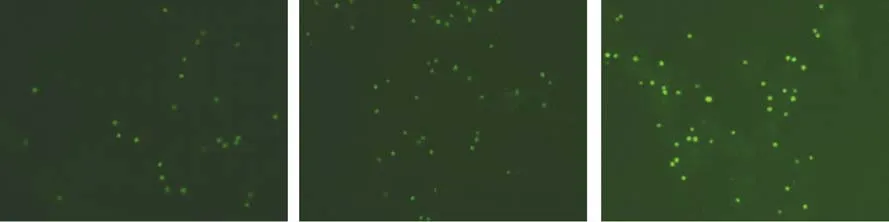
图2 藻细胞制备原生质体染色后荧光照片Fig.2 The fluorescence microscopy photos of the prepared protoplast
将再生平板上的单藻落转入新鲜的f/2海水培养基进行培养,从细胞密度为2×107cells/mL开始计数,观察藻细胞生长速率,如图4所示。实验发现,原生质体细胞生长趋势与非原生质体生长一致。
2.3 原生质体平板再生率统计
原生质体细胞经过低渗溶液处理后将会破碎失去再生能力,只有未被制备成原生质体的藻细胞才可以在低渗平板上进行生长;而高渗溶液则能保持原生质体的活力,继续在高渗平板上培养可再生。对不同初始细胞密度藻细胞制备的原生质体进行再生率的统计。实验发现培养至第12 d后再生培养平板上可观察到单个藻落,继续培养至 4周后再生平板上长出大量藻落,而低渗平板即使在培养至 4周之后依然观察不到藻细胞。这说明用酶处理的方法制备微拟球藻原生质体再生率较高。
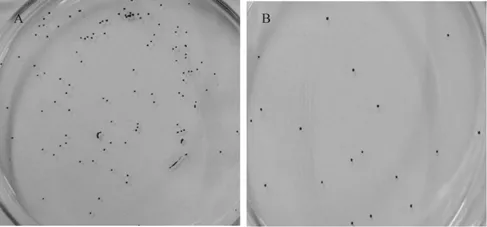
图3 不同密度藻细胞原生质体再生平板再生情况Fig.3 The regeneration of protoplasts with different densities
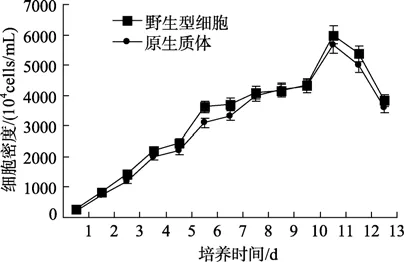
图4 原生质体与野生型藻细胞生长Fig.4 The growth of protoplasts and wild algal cells
3 小结
海藻基因工程发展缓慢主要是因为其原生质体的制备不能通过高等植物标准的制备方法获得[12]。近年来,通过消化细胞壁混合酶液进行微藻原生质体的制备取得了较大的进展。绿藻原生质体的制备已经通过商品化的纤维素酶和果胶酶获得成功[12-13],红藻和褐藻细胞壁中因为含有不同于绿藻的多糖,其原生质体则是通过来自于海洋动物和细菌的酶来处理[12,15]。微拟球藻在制备原生质体时选取了四种酶,纤维素酶,半纤维素酶,果胶酶和崩溃酶,通过实验发现终浓度为 4%半纤维素酶和 2%崩溃酶的酶混合液对微拟球藻原生质体的制备率最高[8]。将制备的原生质体和野生型藻细胞进行生长情况进行观察,发现两者生长趋势一致。本实验的研究结果证明,4%半纤维素酶和 2%崩溃酶的酶混合液消化细胞密度为2×107cells/mL的微拟球藻1 h,原生质体制备率和再生率都较高,生长趋势与野生型细胞一致,为制备该藻原生质体的最优条件。
本实验综合考虑了酶混合液处理时间和原生质体制备的初始细胞密度两个因子进行实验,并进行了微拟球藻原生质体细胞的再生研究,证明采用商品化的酶混合液进行微拟球藻原生质体的制备是可行的,这为下一步对微拟球藻进行基因工程操作奠定了基础,也为其他海洋微藻原生质体的制备提供了理论依据。
[1]Hibberd D J.Notes on the taxonomy and nomenclature of the algal classes Eustigmatophyceae and Tribophyceae (synonym Xanthophyceae) [J].Botanical journal of the linnean society,1981,82:93-119.
[2]Maruyama I,Nakamura T,Matsubayashi T,et al.Identification of the alga known as ‘marine Chlorella’ as a member of the Eustigmatophyceae [J].Japanese journal of Phycology,1986, 34:319-325.
[3]Hu H,Gao K.Optimization of growth and fatty acid composition of a unicellular marine picoplankton,Nannochloropsissp.,with enriched carbon sources[J].Biotechnology Letters,2003,25:421-425.
[4]Apt K E,Behrens P W.Commerical developments in microalgal biotechnology [J].Journal of phycology,1999,35:215-226.
[5]Fogg G E.Some comments on picoplankton and its importance in the pelagic ecosystem [J].Aquatic Microbial Ecology,1995,9:33-39.
[6]Guillard R R L,Ryther J H.Studies of marine planktonic diatoms.I.Cyclotella nanaHustedt andDetonula confervacea. Cleve[J].Canadian Journal of Microbiology,1962,8:229-239.
[7]Guillard R R L.Culture of phytoplankton for feeding marine invertebrates[M]// Smith W L,Chanley M H.Culture of Marine Invertebrate Animals.New York,USA:Plenum Press,1975:26-60.
[8]Chen H L,Li S S,Huang R.Conditional production of a functional fish growth hormone in the transgenic line ofNannochloropsis oculata(Eustigmatophyceae) [J].Journal of Phycology,2008,44:768-776.
[9]Harrington B J,Hageage G J.Calcofluor White:A Review of its Uses and Applications in Clinical Mycology and Parasitology [J].Laboratory medicine,2003,5(34):361-367.
[10]王明兹,王世锋,施巧琴,等.紫球藻原生质体再生育种[J].福建师范大学学报(自然科学版),2008,23(1):65-69.
[11]Kim D H,Kim Y T,Cho J J,et al.Stable integration and functional expression of flounder growth hormone gene in transformed microalga,Chlorella ellipsoidea[J].Marine Biotechnology,2002,4:63-73.
[12]Saga N,Sanbonsuga Y.Tissue culture and genetic engineering for seaweed aquaculture[J].NOAA Technical Reports NMFS,1988,70:47-54.
[13]Fujimura T,Kawai T,Shiga M,et al.Regeneration of protoplasts into complete thalli in the marine green algaUlva pertusa[J].Nippon Suisan Gakkaishi,1989, 55:1353-1359.
[14]Saga N,Kudo T.Isolation and culture of protoplasts from the marine green algaMonostroma angicava[J].J ournal of Applied Phycology,1989,1:25-30.
[15]Cheney D P,Mar E,Saga N,et al.Protoplast isolation and cell division in the agar-producing seaweedGracilaria (Rhodophyta)[J].Journal of Phycology,1986, 22:238-243.

