苦豆子种质资源遗传多样性的RAPD分析
阳 翠,张晓岗,杨玉蓉,刘 萍
(宁夏大学农学院,宁夏 银川 750021)
苦豆子(Sophoraalopecuroides)系豆科槐属植物,别名为苦豆根、苦豆草、苦干草,是我国西北干旱、荒漠地区广泛分布的一种多年生草本植物[1]。由于苦豆子耐旱、耐寒、耐盐碱,在荒漠和沙性土壤上具有极强的生命力,在黄河两岸常栽培以固定沙土,是北方地区生态系统中重要的生态草[2]。其植株和种子富含多种生物碱、黄酮类物质、有机酸、氨基酸、蛋白质和多糖类等,具有抗癌、免疫等药理活性[3]。目前,关于苦豆子的研究多集中在生物特性、化学成分、药理作用和临床研究等方面[4-6],而关于其遗传结构和遗传多样性方面的研究相对较少。
随机扩增多态性DNA(Random Amplified Polymorphic DNA,RAPD)是以PCR为基础的简单、快速的分子标记技术,该技术灵敏度高、操作简单、实验材料需要量少且要求不高、不需要放射性标记,适用于对种群的遗传背景了解不多或根本不了解的物种,是植物DNA水平上遗传多样性的直接反映。RAPD分子标记技术现已广泛应用于种质资源鉴定、亲缘关系研究、遗传图谱构建及遗传多样性评价等领域[7-10]。本研究采用RAPD标记技术,对22个苦豆子居群进行比较分析,旨在从DNA分子水平上探索苦豆子居群间的遗传多样性程度,从而为苦豆子种质资源的保护以及引种栽培提供理论依据。
1 材料与方法
1.1材料
1.1.1苦豆子种质资源 依据苦豆子的地理分布特点,分别采集来自宁夏、甘肃、青海、新疆、内蒙古5个省份22个居群的苦豆子种子作为供试材料,其中宁夏居群14个,其他省份的居群8个。在采集材料的同时进行生态环境的调查[6],所有种子均于2007、2008年收集,保存于-70 ℃的超低温冰箱中备用。居群编号、来源以及采集地的生态环境和伴生种如表1所示。
1.1.2试剂与仪器设备 用于RAPD反应的dNTP、Taq酶、Mg2+购自生工(上海)生物工程有限公司;引物由北京奥科生物公司合成;PTC-200型PCR循环仪购自美国伯乐公司;DYY-6B型稳压稳流电泳仪、DYCP-31F型电泳槽、UV-VIA型紫外反射透射仪均购自北京六一仪器厂;Gilson微量移液器。
1.2方法
1.2.1基因组DNA提取 采用改良的CTAB法提取基因组DNA[11]。
1.2.2RAPD的反应程序和体系 RAPD扩增反应程序:94 ℃预变性120 s;94 ℃变性 20 s,36 ℃退火30 s,72 ℃延伸60 s,39个循环;最后72 ℃延伸10min,扩增产物在0.5×TBE、电压4~5 V·cm-1、2.0%琼脂糖凝胶(含50 μg·mL-1溴化乙锭)中电泳,在紫外反射透射仪下观察并用数码相机拍照。RAPD扩增反应体系经过比较和优化确定为20 μL,具体如下:10×PCR buffer 2 μL,MgCl25 mmol·L-1,引物20 μmol·L-1,模板DNA 20 ng,dNTP 1 mmol·L-1,TaqDNA聚合酶1 U·μL-1,ddH2O 12.5 μL。
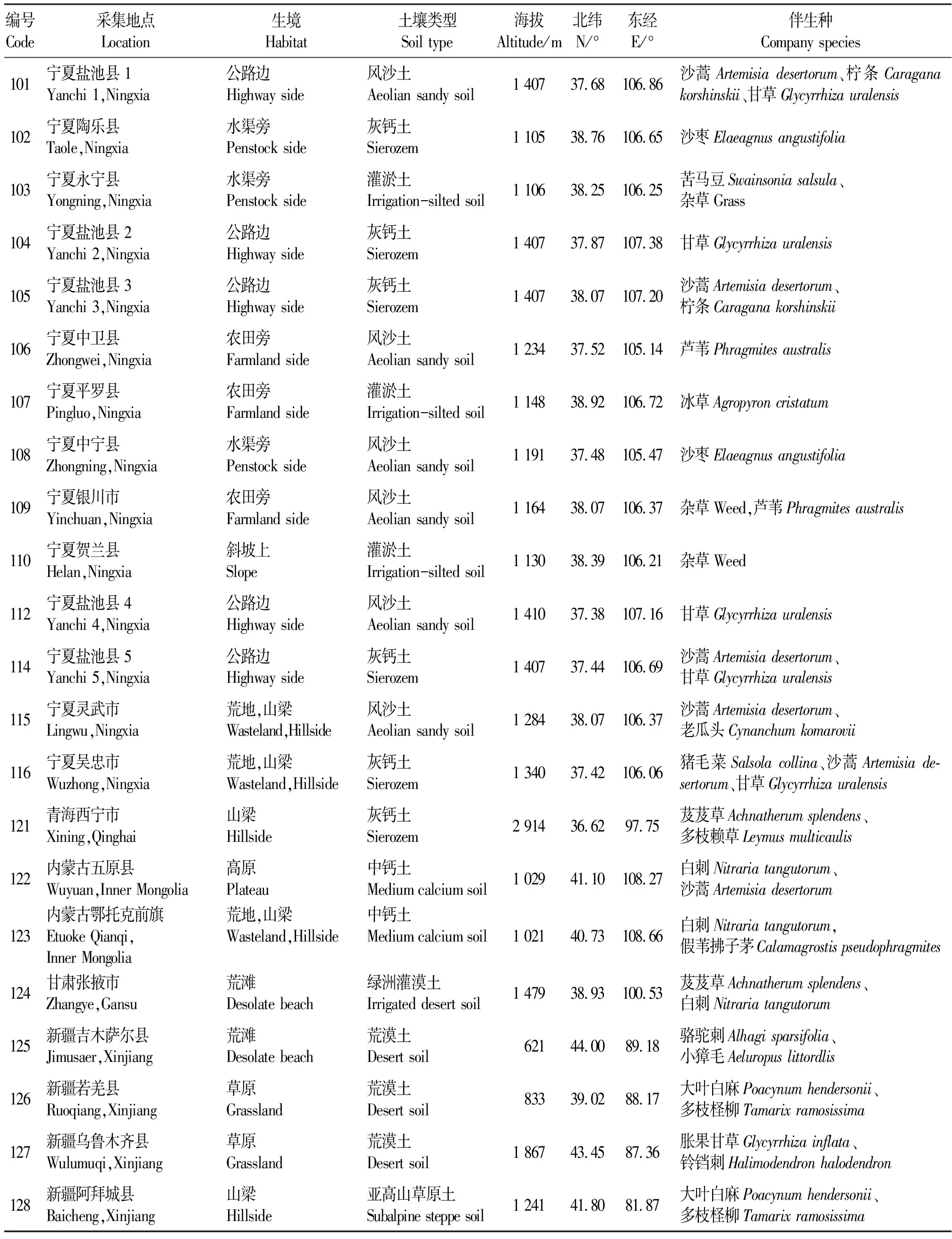
表1 供试苦豆子种质资源编号、来源及生境调查Table 1 Germplasm resources and habitat characteristics of Sophora alopecuroides
1.2.3引物筛选 以103、106居群DNA为模板对300条RAPD随机引物逐一进行筛选。记录条带清晰、有多态性的引物编号,将该引物再重复一次,验证其可靠性,如果能够清晰、稳定重复出现多态性,记录引物编号,以备用于22个居群的遗传多态性分析。
1.2.4数据统计与分析 根据PCR扩增产物的电泳结果按带的有(记为1)无(记为0)建立二元数据矩阵。通过Popgene 32软件计算下列参数:多态性位点百分比、观测等位基因数(Na)、有效等位基因数(Ne)、Nei’s基因多样性(H)、Shannon信息指数(I)、Nei’s遗传距离(GSij)和遗传相似性(GDij)。
GSij=2Nij/(Ni+Nj);GDij=1-GSij.
式中,Nij为2个居群i和j共有的条带数,Ni、Nj分别为第i个居群和第j个居群各自的条带数[12]。
用NTSYS 2.1软件并根据Nei’s遗传距离用非加权配对类平均法(Unweight pair-group method with arithmetic means,UPGMA)进行聚类分析,构建各居群之间亲缘关系树状图;用DCENTER程序进行遗传距离矩阵转换,并用EIGEN程序求特征值和特征向量进行主成分分析(Principal component analysis,PCA)。
2 结果与分析
2.1RAPD扩增结果 从300条RAPD随机引物中筛选出31条带型清晰、多态性好的引物,对22个苦豆子居群的DNA进行扩增。所有样品均得到分子量在250~2 000 bp范围内的条带(图1)。每个引物扩增的位点数为5~18个,共扩增出314个位点,平均每个引物的扩增位点数为10.13,多态性位点数为285个,多态性比率高达90.76%,多态位点百分率在60%~100%(表2),说明所研究的22个居群苦豆子在DNA水平上遗传多样性较高。不同引物扩增的位点数不同,同一引物对不同居群苦豆子扩增的位点数也不一样,充分体现出不同苦豆子基因组DNA的多态性,也表明苦豆子居群间存在遗传差异。
2.2基于RAPD标记的遗传多样性聚类分析 为确定各苦豆子居群间的遗传关系,通过Pop-gene 32软件分析RAPD标记的(0,1)矩阵二元数据,计算出苦豆子居群水平上的Na、Ne、H、I分别为1.898 4、1.492 7、0.301 5和0.453 1,表明22个苦豆子居群间有一定的遗传分化。
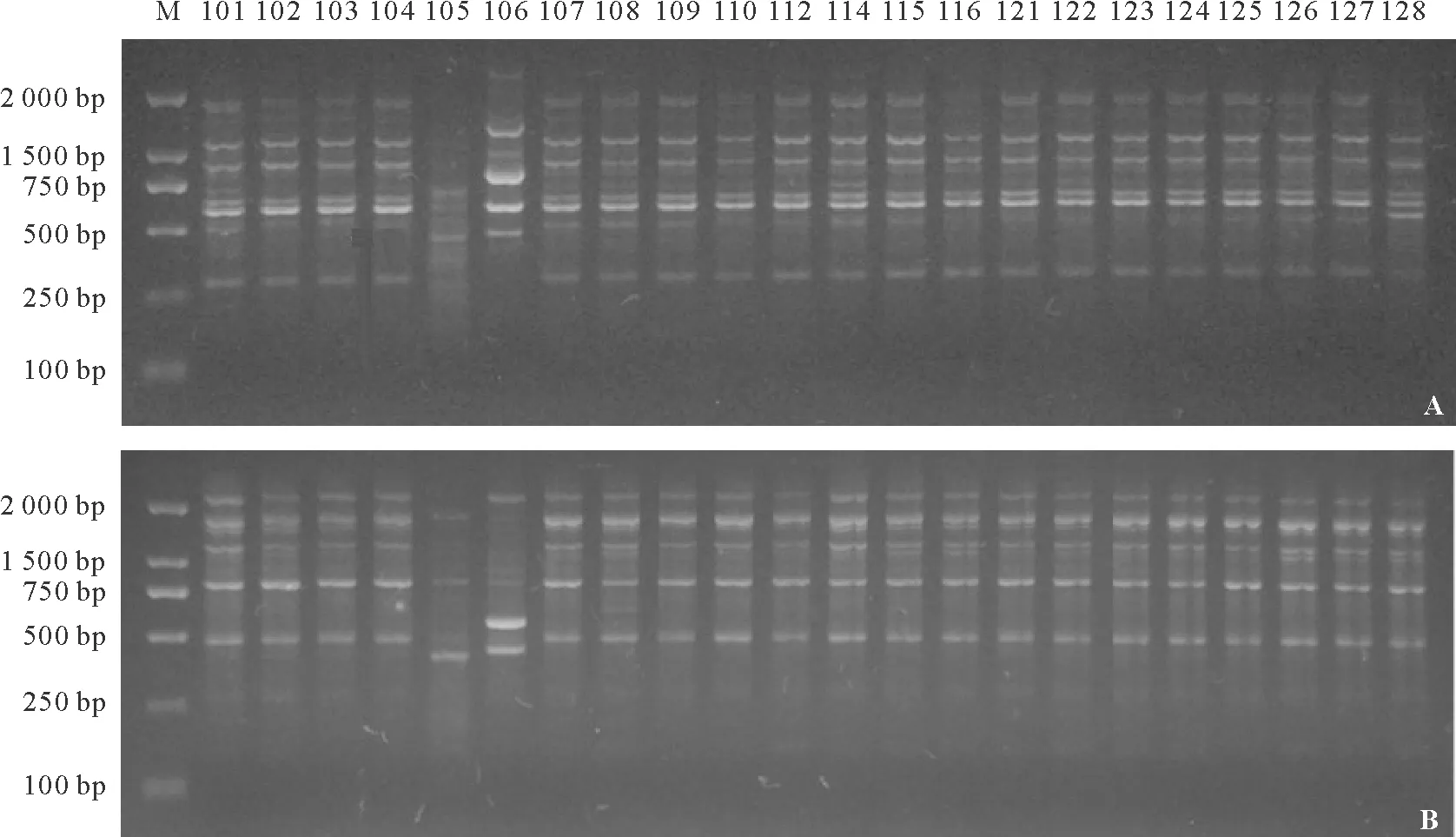
图1 引物09M27519(A)和09M27532(B)对22个苦豆子居群的扩增结果Fig.1 The amplified result of primer 09M27519(A) and 09M27532(B) in 22 populations of S.alopecuroides
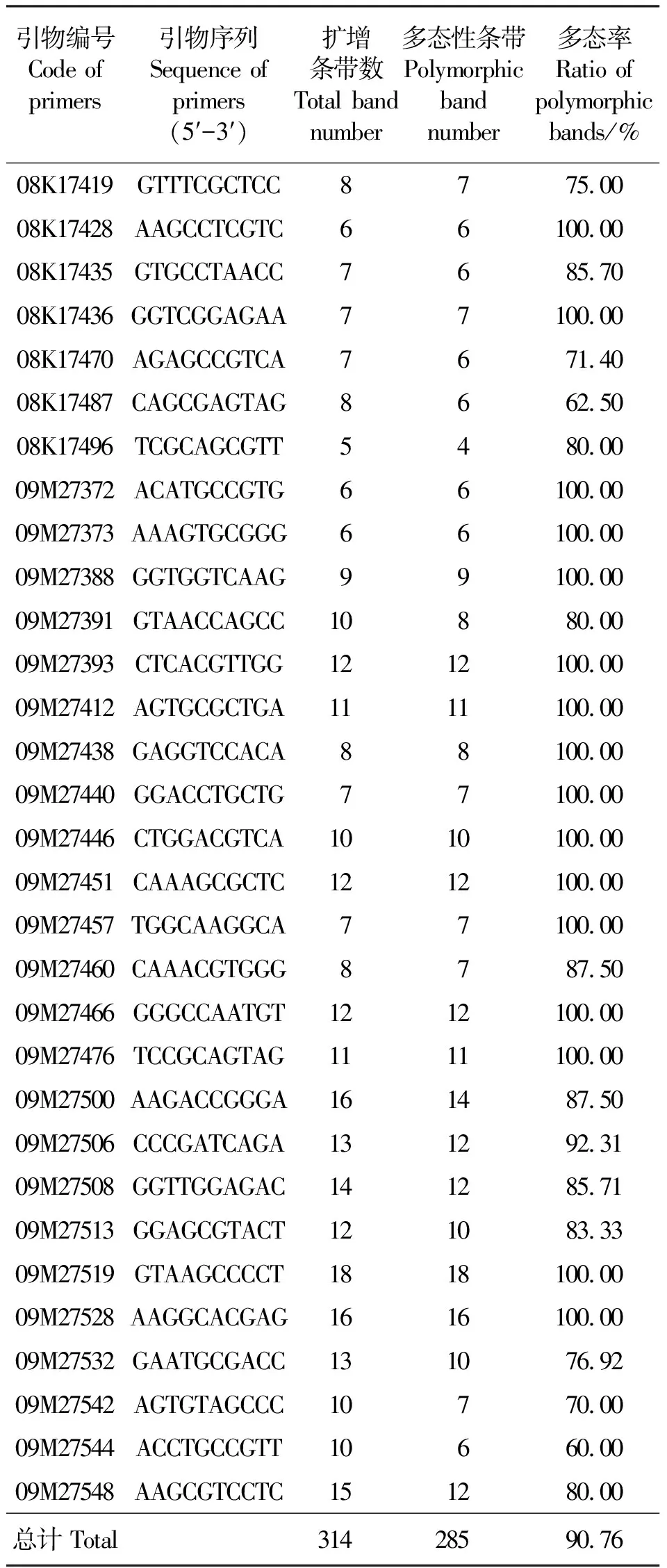
表2 苦豆子居群遗传分析的RAPD引物及其扩增结果Table 2 The sequence of RAPD primers and polymorphic efficiency in 22 populations of S.alopecuroides
22个苦豆子居群间的遗传距离在0.114~0.709,平均为0.369。其中居群124与居群127的亲缘关系最近,遗传距离为0.114;而居群105与居群125的亲缘关系最远,遗传距离为0.709(表3)。对22个苦豆子居群的遗传距离进行配对分析,发现居群105的平均遗传距离在22个居群中最大为0.527,表明居群105与其他21个居群的遗传差异最大。

表3 22个苦豆子居群遗传距离的配对分析Table 3 Pairwise analysis of Genetic distance among 22 populations of S.alopecuroides
UPGMA聚类结果显示在遗传距离0.278处可将22个苦豆子居群聚为六大类(图2)。
第Ⅰ类和第IV类均各由一个居群(105和106)单独聚为一类;第Ⅱ类全部由宁夏以外的居群组成,包括居群122、124、125、126和127;第Ⅲ类由4个宁夏居群组成,包括居群103、104、109和112,这一大类又分为2个亚类,居群103与居群104聚为一亚类;居群109与居群112聚为另一亚类;第V类由来自宁夏的居群114、115、116与来自青海的居群121、内蒙的居群123、新疆的居群128组成;第VI类:由5个宁夏居群组成,包括居群101、102、110、107和108。聚类结果显示,居群105和居群106 与其他20个苦豆子居群在DNA水平上有较大差异。
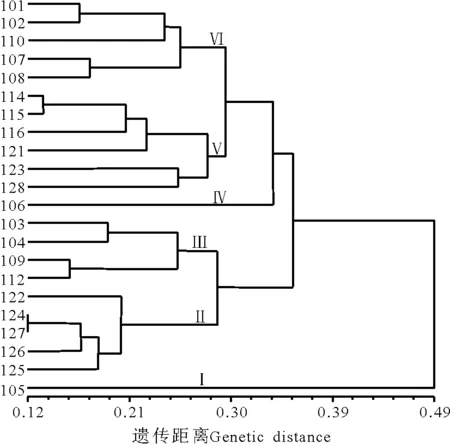
图2 22个苦豆子居群的UPGMA聚类分析Fig.2 Cluster analysis of 22 populations of S.alopecuroides
2.3基于RAPD标记的主成分(PCA)分析 对RAPD标记的数据进行PAC分析的结果显示,第1主成分解释的变异为43.70%,第2主成分解释的变异为20.41%,第3主成分解释的变异为9.62%,3个主成分综合解释的变异为73.73%,能够反映苦豆子居群间亲缘关系的远近。将第1、2主成分结合起来分析可将22个苦豆子居群分为六大类群(图3),主成分分析结果与UPGMA聚类结果一致。可见,地理分布上的远近与苦豆子居群间遗传上的差异没有必然联系。研究发现,各居群所处的生态环境、海拔高度、经纬度以及伴生种各不相同(表1),居群间的遗传差异可能与其所处的微环境的异质性所造成的变异有关。

图3 22个苦豆子居群RAPD标记的二维主坐标图Fig.3 The principal coordinate graph of RAPD among 22 populations of S.alopecuroides
3 讨论
植物的遗传多样性水平与其生物学特性、生境以及起源进化密不可分,其中繁育系统、分布范围、生活型以及花粉和种子传播方式对其影响最大[13]。本研究表明,野生苦豆子居群的多态率为90.79%,Nei’s基因多样性(H)、Shannon多样性指数(I)分别为0.301 5和0.453 1,苦豆子居群间具有较高的遗传多样性。
遗传变异的作用主要是由选择、突变和基因流动等因素产生,空间距离并不一定能够产生遗传变异,彼此相距很近的群体即使存在频繁的基因流动,在强有力的选择作用下也可能使得群体间产生遗传上的变异和分化[13]。22个苦豆子居群的主成分分析与UPGMA聚类分析的结果均显示来自宁夏的14个居群分别被划分在了5个不同类群中,就连来自宁夏盐池县的5个居群(101、104、105、112、114)也分别聚在了4个不同的类群中,而来自甘肃(124)、内蒙(122)、新疆(125~127)的居群却被归为一类,各居群间出现了一定程度的遗传分化,地理分布上的远近与居群间遗传上的差异没有必然联系。这一结果与陈小勇和宋永昌[14]对黄山西部青冈(Cyclobalanopsisglauca)种群小地理范围的遗传分化研究及刘萍等[15]对胡卢巴(Trigonellafoenum-graecum)遗传多样性的研究结果基本一致。苦豆子主要进行无性繁殖兼种子繁殖[16],种群间基因交流相对较少,不同居群间的遗传差异可能与其所处的小生境的异质性所造成的变异有关,强有力的环境选择有可能导致居群间产生遗传变异和遗传分化。
苦豆子居群间的差异与环境因素有关,但更大程度上由其遗传因素决定,RAPD分析结果证明了这一点。研究苦豆子不同地理种源间的遗传差异,对苦豆子精细成分的提取、利用、科学合理的驯化和栽培有一定的意义。
[1] 中国科学院中国植物志编辑委员会.中国植物志(第四十卷)[M].北京:科学出版社,1994:80.
[2] 李珂,王小龙.苦豆子及其利用[J].甘肃农业科技,2010(2):46-47.
[3] 廖春燕,梁健,杨燕,等.苦豆子的药理及应用概述[J].中国民族民间医药,2009(3):6-8.
[4] 纪瑛,蔺海明,陈垣,等.施氮对苦豆子生物量及生物碱积累的影响[J].草业学报,2008,17(3):40-46.
[5] 冯燕,胡小文,王彦荣,等.不同水分条件下苦豆子种子产量及其构成因素研究[J].草业科学,2010,27(7):48-51.
[6] 阳翠,杨飞,马宏玮,等.苦豆子种质资源调查及种子生物学特性研究[J].中国中药杂志,2010,35(7):817-820.
[7] 崔光红,陈敏,黄璐琦,等.药用肉苁蓉的遗传多样性RAPD分析[J].中国中药杂志,2004,29(8):727-730.
[8] Venkateswarlu M,Urs S R,Surendra B N,etal.A first genetic linkage map of mulberry (Morusspp.) using RAPD, ISSR and SSR markers and pseudotestcross mapping strategy[J].Tree Genetics and Genomes,2006,3:15-24.
[9] Naik P K,Alam M A,Singh H,etal.Assessment of genetic diversity through RAPD,ISSR and AFLP markers inPodophyllumhexandrum:A medicinal herb from the Northwestern Himalayan region[J].Physiology and Molecular Biology of Plants,2010,16(2):135-148.
[10] Dangi R S,Lagu M D,Choudhary L B,etal.Assessment of genetic diversity inTrigonellafoenum-graecumandTrigonellacaeruleausing ISSR and RAPD markers[J].BMC Plant Biology,2004,4:13-23.
[11] 黄丽霞,罗静,李文超,等.不同方法从苦豆子中提取DNA的效果比较研究[J].宁夏农林科技,2009(3):8-10.
[12] Nei M.Genetic distance between populations[J].The American Naturalist,1972,106(949):283-292.
[13] 王洪新,胡志昂.植物的繁育系统、遗传结构和遗传多样性保护[J].生物多样性,1996,4(2):92-96.
[14] 陈小勇,宋永昌.安徽黄山西部青冈种群小地理范围的遗传分化[J].植物资源与环境学报,1998,7(1):10-14.
[15] 刘萍,李应科,李小虎,等.胡卢巴等位酶变异和遗传多样性研究[J].西北植物学报,2010,30(9):1780-1785.
[16] 钟仁山.苦豆子的研究及其应用[M].银川:宁夏人民出版社,1983:17.

