大黄素对肠上皮细胞损伤的保护作用及机制研究
丁博文,嵇 武,白小武,车金辉,张 强,李秋荣
肠黏膜屏障包括机械屏障、免疫屏障、微生物屏障和化学屏障,机械屏障是肠黏膜屏障的基础和最重要的部分[1]。紧密连接形成的连续环周上皮细胞间连接,是构成肠黏膜机械屏障最重要的结构[2]。大黄素是中药大黄的重要单体,具有多种功效,如抑菌、抗炎、改善微循环、抗癌等,具有较好的临床应用价值[3],近来有研究证实大黄素对肠黏膜屏障具有一定的保护作用。本实验通过建立肠上皮细胞缺氧/复氧(hypoxia/reoxygenation,H/R)模型,研究大黄素对紧密连接蛋白的影响,探讨大黄素保护肠黏膜屏障的内在机制。
1 材料与方法
1.1 材料 肠上皮细胞株Caco-2 细胞(中国科学院上海细胞生物学研究所)、大黄素(江苏食品药品检定所,纯度>99.9%)、Mllicell 插入式培养皿(Millipore 公司)、兔抗鼠多克隆紧密连接蛋白Occludin 和ZO-1 抗体(Santa Cruz 公司)、辣根过氧化物酶(HRP)-羊抗兔二抗(Sigma 公司)、RT-PCR 试剂盒(北京全式金生物公司)、甘油醛-3-磷酸脱氢酶(GAPDH)引物(北京全式金生物公司)。
1.2 主要实验仪器 紫外分光光度计(Beckman Coulter)、JEM-1010 透射电子显微镜(日本电子株式会社)、MillicellTM 电阻测定系统(Millipore 公司)。
1.3 Caco-2 细胞的培养 Caco-2 细胞在37℃、5%CO2和90%相对湿度的CO2培养箱中培养,2 ~3 d换液一次,每5 d 按1:3 的比例传代。Caco-2 细胞接种于6 孔培养板内,供Western-blot 及RT-PCR 分析;接种于Millicell 聚碳酸酯膜(4.5cm2,0.4 μm),供跨上皮电阻值(transepithelial electrical resistance,TEER)的检测及透射电镜分析。
1.4 Caco-2 细胞H/R 损伤模型的建立方法 取生长达到80%~90%融合的Caco-2 细胞,随机分为四组:正常细胞(N)组、H/R 组、缺氧复氧+Hanks 平衡盐溶液(H/R+HBSS)组、缺氧复氧+大黄素(H/R+EN)组。H/R+EN 组细胞在H/R 前30 min 用10 μmol/L 大黄素处理。将细胞置入密闭容器中,通入95%N2、5%CO2的混合气体后将容器置于培养箱中孵育90 min(缺氧),取出,置入培养箱中孵育2 h(复氧)。
1.5 TEER 值的检测 用MillicellTM 电阻测定系统测定Caco-2 细胞单层的TEER 值。TEER 是反映肠黏膜屏障通透性的主要指标之一,与细胞单层的通透性在一定范围内呈负相关。
1.6 透射电镜观察细胞间紧密连接的变化 将Millicell 聚碳酸酯膜剪下,依次经固定、脱水、包埋、修块、切片,用醋酸铀、硝酸铅双重染色,透射电镜照相。
1.7 Western blot 检测 将刮取得到的Caco-2 细胞加入细胞裂解液提取蛋白,考马斯亮蓝法测定蛋白质浓度。取样品蛋白40 μg,以聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳分离蛋白质,湿转移法将蛋白条带转移至聚偏氟乙烯(PVDF)膜。加入兔抗鼠Occludin、ZO-1 一抗(1:500 稀释),4℃下孵育过夜,加入羊抗兔HRP-IgG 抗体(1:3000 稀释),室温孵育1 h,ECL 法显色。相应蛋白表达值为条带的灰度值除以β-actin 灰度值。
1.8 RT-PCR 检测 按照Trizol 说明书方法提取Caco-2 细胞总RNA,紫外分光光度计测量计算RNA纯度和浓度。在20μl 逆转录反应体系中,以2.0μg的mRNA 为模板将mRNA 逆转录为cDNA。PCR 反应以GAPDH 为内参,使用Primer5.0 软件设计引物序列(表1)。反应条件:95℃5 min,95℃5 s,62℃15 s,72℃1 min。PCR 扩增循环35 次。PCR 反应产物经1.5%琼脂糖凝胶电泳,数字成像仪照相分析,结果以Occludin/GAPDH、ZO-1/GAPDH 的整合光密度值(integrated density value,IDV)的比值表示。

表1 RT-PCR 引物序列及长度
2 结 果
2.1 TEER 值的检测 与N 组比较,H/R、H/R+HBSS 和H/R+EN 三组TEER 值显著降低(P <0.05);H/R、H/R+HBSS 两组TEER 值明显低于H/R+EN 组(P <0.05);H/R、H/R+HBSS 两组间差异无统计学意义(P >0.05,表2)。
表2 各组Caco-2 细胞TEER 值检测结果)
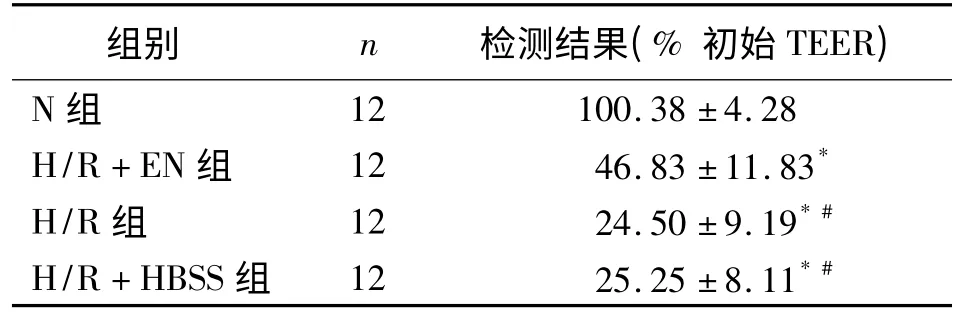
表2 各组Caco-2 细胞TEER 值检测结果)
注:与N 组比较,*P <0.05;与H/R+EN 组比较,#P <0.05
组别 n 检测结果(%初始TEER)N 组12 100.38±4.28 H/R+EN 组 12 46.83±11.83*H/R 组 12 24.50±9.19*#H/R+HBSS 组 12 25.25±8.11*#
2.2 透射电镜检测紧密连接 N 组紧密连接完整清晰;H/R+EN 组紧密连接可见肿胀,但结构仍比较清晰;H/R、H/R+HBSS 组紧密连接结构肿胀模糊,破坏明显(图1)。
2.3 Western blot 检测Occludin 和ZO-1 蛋白的表达 与N 组相比,H/R+EN、H/R、H/R+HBSS三组Occludin 和ZO-1 蛋白表达水平明显降低(P <0.05);H/R、H/R+HBSS 两组的ZO-1 和Occludin蛋白表达水平显著低于H/R+EN 组(P <0.05);H/R、H/R+HBSS 两组间差异无明显统计学意义(P >0.05,图2、表3)。
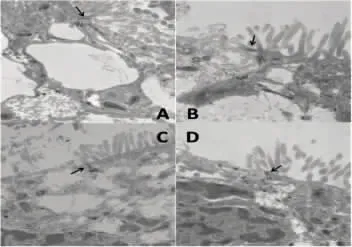
图1 Caco-2 细胞的透射电镜变化(醋酸铀、硝酸铅双重染色 ×25 000)
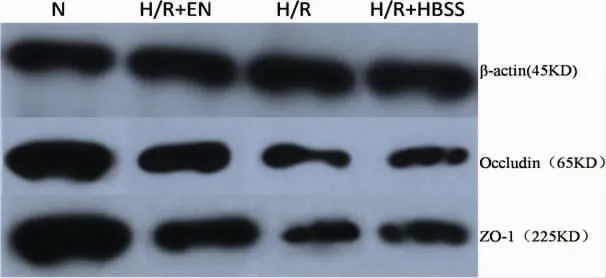
图2 各组Caco-2 细胞中Occludin、ZO-1 蛋白的表达
表3 各组Caco-2 细胞中Occludin、ZO-1 蛋白的相对表达(%)
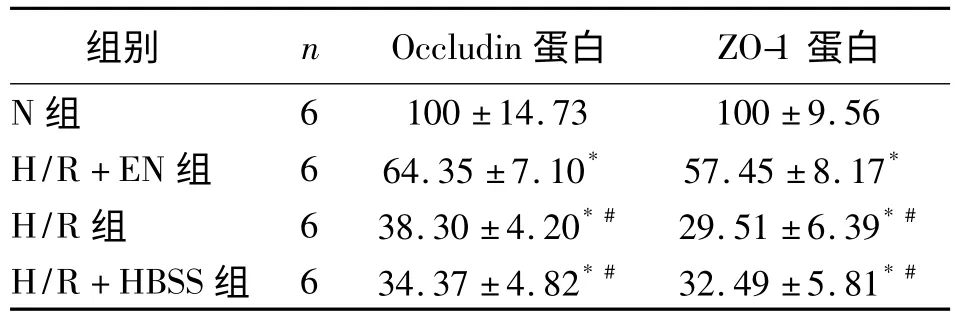
表3 各组Caco-2 细胞中Occludin、ZO-1 蛋白的相对表达(%)
注:与N 组比较,*P <0.05;与H/R+EN 组比较,#P <0.05
组别 n Occludin 蛋白 ZO-1蛋白N 组6 100±14.73 100±9.56 H/R+EN 组 6 64.35±7.10* 57.45±8.17*H/R 组 6 38.30±4.20*# 29.51±6.39*#H/R+HBSS 组 6 34.37±4.82*# 32.49±5.81*#
2.4 RT-PCR 检测Occludin 和ZO-1 的mRNA 表达
相对于N 组,H/R+EN、H/R、H/R+HBSS 三组ZO-1 和Occludin 的mRNA 表达水平明显下调(P <0.05);H/R、H/R+HBSS 两组的ZO-1 和Occludin的mRNA 表达水平显著低于H/R+EN 组(P <0.05);H/R、H/R+HBSS 两组间差异无统计学意义(P >0.05,图3、表4)。
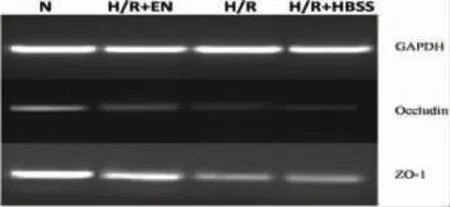
图3 各组Caco-2 细胞中ZO-1、Occludin mRNA 的表达
表4 各组Caco-2 细胞中ZO-1、Occludin mRNA 的表达()

表4 各组Caco-2 细胞中ZO-1、Occludin mRNA 的表达()
注:与N 组比较,*P <0.05;与H/R+EN 组比较,#P <0.05
组别 n Occludin mRNA ZO-1mRNA N 组6 0.808±0.117 0.952±0.101 H/R+EN 组 6 0.648±0.061* 0.752±0.031*H/R 组 6 0.431±0.014# 0.535±0.016*#H/R+HBSS 组 6 0.464±0.025*# 0.484±0.051*#
3 讨 论
肠黏膜屏障具有防止肠道内病原微生物及毒素由肠腔侵入肠外器官的作用,以机械屏障最为重要,其基础为单层上皮细胞和细胞间的紧密连接[4]。ZO-1、Occludin 是构成紧密连接的两种重要组成部分[5]。ZO-1 与ZO-2 形成稳定的复合体,直接结合Occludin 蛋白,形成一个网络支架,将Occludin 和肌动蛋白系统连接在一起形成稳定的连接系统,在信号传导过程中起转化作用,从而控制细胞周围屏障[6]。
肠黏膜屏障功能的损害是一复杂的过程,诸多因素可能参与了这一过程的调控。目前的治疗有给予肠内营养支持等[7],但其具体的作用机制未完全阐明。大黄素曾长期作为导泻、抗炎药使用。许多研究证实大黄素可以显著降低肿瘤坏死因子(TNFα)和白细胞介素-6(IL-6)的表达水平以及过氧化物酶(MPO)的活性[8-9]。大黄素具有的潜在细胞因子抑制作用是由于它抑制了核因子(NF-κB)的活性。大黄素还具有清除氧自由基抗氧化作用,增加超氧化物歧化酶、谷胱甘肽过氧化酶的活性,减少丙二醛含量等[10]。
本研究通过体外培养肠上皮细胞株Caco-2 细胞制作H/R 模型模拟肠缺血/再灌注(I/R)损伤。肠缺血时,肠系膜血管处于低灌注状态,导致肠绒毛上皮细胞坏死脱落,肠黏膜屏障功能受损、肠通透性增加;再灌注后,产生大量氧自由基,造成组织细胞氧化应激损伤,进一步削弱肠屏障功能[11]。H/R 损伤后Western blot 和RT-PCR 检测结果显示,Caco-2细胞Occludin、ZO-1 蛋白的表达量和mRNA 的表达水平均明显下降。ZO-1 蛋白表达减少会引起Occludin 等跨膜蛋白从细胞骨架上解离,Occludin 蛋白表达减少可使其封闭细胞旁缝隙的能力缺失,引起紧密连接开放[12]。透射电镜下观察到Caco-2 细胞间紧密连接结构破坏明显,TEER 值显著下降,Caco-2 单层细胞通透性大幅上升进一步证实肠黏膜屏障的完整性受到严重破坏,屏障功能下降。大黄素处理组Occludin、ZO-1 的蛋白表达量和mRNA 的表达水平明显上升,表明大黄素对紧密连接结构蛋白在蛋白表达水平和基因转录水平都具有显著的保护作用。电镜观察也显示细胞间紧密连结构的破坏减轻,TEER 值升高,证实大黄素可以有效抑制Caco-2单层细胞通透性增加,保护肠上皮细胞的屏障功能。
因此,我们推测大黄素对肠黏膜屏障功能的保护作用可能是通过减少紧密连接结构蛋白Occludin、ZO-1 的破坏,增加其表达,维持肠黏膜屏障的完整性来实现的。本研究对于大黄素对肠黏膜屏障损伤的治疗提供了部分理论依据,提示大黄素在治疗消化系统疾病中具有很大潜力。
[1] 丁 凯,汪志明,吴 波,等.放大肠镜在重症急性胰腺炎早期的结肠黏膜损害中的诊断价值[J].外科理论与实践,2010,15(1):23-26.
[2] 张明鸣,程惊秋,陆燕蓉,等.不同营养支持途径对外科创伤应激后相关肠黏膜形态和屏障功能影响的实验研究[J].四川大学学报:医学版,2009,40(4):615-618.
[3] 张喜平.大黄素的药理作用研究概况[J].中国药理学通报,2003,19(8):851-854.
[4] 赵允召,龚冠文,李 宁,等.腹腔间隙综合征小肠黏膜显微和超微结构改变的观察[J].医学研究生学报,2011,24(5):456-459.
[5] 孙晔珣,初桂兰.新生大鼠缺氧缺血性脑损伤ZO-1 和occludin的动态变化研究[J].中国现代医学杂志,2011,20(21):3210-3213.
[6] Segretain D,Fiorini C,Decrouy X,et al.A proposed role for ZO-1 in targeting connexin 43 gap junctions to the endocytic pathway[J].Biochimie,2004,86(4-5):241-244.
[7] 邵 洁,陈邦元,李 雯,等.早期肠内营养对休克后患者炎性反应的疗效研究[J].东南国防医药,2011,13(3):226-227.
[8] Wu Y,Tu X,Lin G,et al.Emodin-mediated protection from acute myocardial infarction via inhibition of inflammation and apoptosis in local ischemic myocardium[J].Life Sci,2007,81(17-18):1332-1338.
[9] 刘瑞林,张 嘉,吴 薇,等.大黄素对肠缺血/再灌注损害保护作用的实验研究[J].中国中西医结合急救杂志,2008,15(1):45-47.
[10]吴小明.大黄素对大鼠混合型高脂血症的影响[J].安徽医药,2008,12(11):1026-1028.
[11]张 敏,胡毓华,张 伟.胰高血糖素样肽-2 对幼鼠肠缺血-再灌注损伤的保护作用[J].江苏医药,2009,35(12):1473-1475.
[12]刘丽波,薛一雪,王 萍.缓激肽对脑胶质瘤大鼠occludin 和ZO-1mRNA 的调节机制[J].中国医科大学学报,2010,39(7):497-500.

