La和Cu共掺纳米TiO2光催化转化CO2研究
卫 静,谭 欣,杜菲菲,于 涛,赵 林
(1. 天津大学环境科学与工程学院,天津 300072;2. 济南大学资源与环境学院,济南 250022;3. 天津大学化工学院,天津 300072)
人类活动导致的 CO2等温室气体的排放是目前所观测到的全球变暖的主要原因.自 20世纪 90年代以来,国际社会对温室气体的减排给予了格外关注,一系列的国际行动框架逐步建立,我国在“十二五”规划中明确地将节能减排作为一项重大专项规划来实施.大量的 CO2温室气体的排放已成为一个全球性的环境问题.CO2作为碳的最终氧化产物,具有较高的稳定性和惰性,难于被活化;但CO2分子具有较低能量的 2πα轨道和较高的电子亲和能,电子云都集中于两边的氧原子上,故 CO2中 C原子表现出了较强的亲电性,易于接受电子,在反应过程中可以作为氧化剂加以利用[1].由此可见,采用适当的方式输入电子可使吸附后的CO2具有一定的活化态.
自1979年Inoue和Fujishima等[2]首次报道了利用 TiO2、SrTiO3、SiC等在水溶液中进行 CO2光催化还原反应后,近三十多年来,众多研究者通过光催化法研究了 CO2的光化学还原[3-7].Adachi等[8]研究发现,以 Cu/TiO2纳米粉体为催化剂、以Xe灯为光源可以得到甲烷、乙烯和乙烷等产物.Tseng等[9]进行了CO2和 H2O的液相反应,对 sol-gel法制备的Cu/TiO2催化剂进行了一系列的研究,结果表明2.0%Cu/TiO2(质量分数,以下相同)的光催化效率最高,254,nm 紫外光照6,h甲醇生成量达118,μmol/gcat..Wu[10]采用溶胶-凝胶法制备TiO2凝胶涂覆在自行研制的光纤反应器中进行光催化还原CO2的反应,取得了更高的光子利用率和 CO2的光催化转化效率.由于 La元素具有4f电子构型,易产生多电子组态,且具有较强的选择吸附性、电子型导电性和热稳定性等特点,因此在 TiO2晶格中引入 La离子,可以形成光生电子或空穴的浅势捕获陷阱或改变晶格类型,延长光生电子与空穴对的复合时间,从而提高 TiO2的光催化活性[11-13].
笔者利用溶胶-凝胶法制备了不同掺杂量的 La元素和 0.6% Cu元素共掺杂 TiO2纳米粉体,考察其光催化还原 CO2的活性.采用 X射线衍射(X-ray diffraction,XRD)、透射电镜(transmission electron microscopy,TEM)及 X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)等表征手段对所制备纳米粉体的晶体结构、形貌及化学组态等进行分析,探讨了 La的掺杂量对其光催化活性、晶体结构、形貌和化学组态的影响,同时对光催化还原 CO2的反应条件进行了优化.
1 实验材料与方法
1.1 材 料
钛酸丁酯(Ti(OC4H9)4,AR),天津市江天化工技术有限公司生产.硝酸(HNO3,AR),天津市江天化工技术有限公司生产.无水乙醇(CH3CH2OH,AR),天津市江天化工技术有限公司生产.硝酸镧(La(NO3)3·6H2O,AR),天津市科密欧化学试剂厂生产.硝酸铜(Cu(NO3)2·3H2O,AR),天津市江天化工技术有限公司生产.实验用水均为三蒸水.CO2气体,纯度为99.999%.
1.2 纳米La/Cu/TiO2材料的制备
室温条件下,在烧杯A中将5,mL钛酸丁酯溶于30,mL无水乙醇,并搅拌均匀.分别配制不同含量的硝酸镧、0.031,9,g硝酸铜、20,mL乙醇、0.7,mL硝酸和1.5,mL三蒸水的混合溶液于烧杯B中,通过蠕动泵将B中溶液以30滴/min的速度滴入A.滴加过程中,保证A中溶液处于剧烈搅拌状态,滴加结束后持续搅拌30,min.将得到的溶胶陈化16,h后形成凝胶,82,℃恒温干燥1.5,h,研磨后在空气气氛下 500,℃煅烧2,h,即得所需La、Cu共掺杂TiO2纳米材料.本研究中Cu添加量固定为0.6%(选用的是Cu单独改性时的最佳掺杂量),通过改变硝酸镧的添加量,制备了不同 La/Ti元素质量比的 La/Cu/TiO2纳米材料,有TiO2(BT)、0.05%La/0.6%Cu/TiO2(LTC1)、0.1%La/0.6%Cu/TiO2(LTC2)、0.5%La/0.6%Cu/TiO2(LTC3)和1.0%La/0.6%Cu/TiO2(LTC4)等.
1.3 材料表征
XRD分析采用日本理学D/MAX2500型X射线衍射仪,采用CuKα辐射,衍射光束经Ni单色器滤波,其波长为λ=0.154,18,nm.加速电压和电流分别为40,kV和200,mA,衍射角2θ的扫描范围为10°~90°.
HR-TEM分析采用 Philips公司 Tecnai G2-F20场发射透射电子显微镜.仪器工作电压为150,kV,真空度高于6.7×10-7,Pa.
XPS分析采用美国Perkin Elmer 公司PHI-1600 ESCA 型光电子能谱仪,以 MgKα为阴极靶,电压15,kV,功率300,W,分析时的基础真空为266.644,8×10-10,Pa.分析灵敏度为 0.8,eV,结合能用 C,ls峰位(284.6,eV)为内标校正荷电效应.
1.4 光催化还原CO2反应
CO2的光催化还原反应在 SGY-I型光催化反应仪中进行,以主波长为365,nm的300,W高压汞灯为光源.针对 CO2在水中溶解度小的原因,选用 NaOH溶液作为还原剂,使更多的 CO2溶解到反应溶液中,完成由气相向液相的转移;进而增加反应物在催化剂表面的吸附,提高整个光催化反应的效率.按1,g/L的浓度将 La/Cu/TiO2加入到 50,mL浓度为0.2,mol/L的 NaOH溶液中,以 N2为载气,保证催化剂在反应过程中处于悬浮状态.持续通入体积流量为 30,mL/min的 CO2气体.通入 N2和 CO2气体30,min排空溶液中的氧气后再打开光源进行反应.在讨论不同 La掺杂量对产物甲醛生成量的影响时,光催化的反应时间分别为 0.5,h、1,h、2,h、4,h和6,h,其余实验的光催化反应时间均为6,h.
采用上述的反应条件进行纯 TiO2的光催化还原CO2反应,也未检测出产物甲醛的存在,可能是由于纯 TiO2的光催化还原活性低,产物生成量过少而未被检出.此外,按上述反应条件,选用 LTC2为催化剂,进行了仅通入 N2的空白实验研究,反应时间为6,h,结果表明液相中未有有机产物被检出.
利用Agilent 6890N型气相色谱仪测定液相产物中甲醛的生成量,选用 DB-624(0.53,mm×30,m×3,μm)色谱柱.
2 结果与分析
2.1 XRD分析
图1为BT及LCT纳米粉体在煅烧温度为500,℃时的 XRD图谱.各图谱的特征衍射峰均为锐钛矿型 TiO2的 101晶面(2θ=25.2°),BT中存在少量金红石相(2θ=27.5°).La和 Cu的共掺杂起到了抑制TiO2向金红石相转变的作用,使各催化材料中 TiO2的晶相均为锐钛矿相.由于 TiO2催化材料中掺杂的La元素和 Cu元素的添加量很少,并且采用溶胶-凝胶法使其能均匀分散在催化剂的体相中,因此没有聚集产生除TiO2以外的其他特征衍射峰.此外,图1中各图谱显示的结果表明,随着 La添加量的增加,宽化作用越来越明显.当离子掺杂进入TiO2晶界后,会造成原子有序度下降,从而抑制了晶粒的生长,造成晶粒细化或结晶度下降,说明稀土添加量的变化对颗粒结晶过程有一定影响.这一点由 Scherrer公式[14]求出的样品平均晶粒尺寸可以得到验证,BT的平均晶粒大小为 18.9,nm,掺杂后的 TiO2晶粒大小在9.472~13.102,nm.掺杂后 TiO2的晶粒度有明显减小,说明 La和 Cu的掺杂起到了晶粒细化的作用.
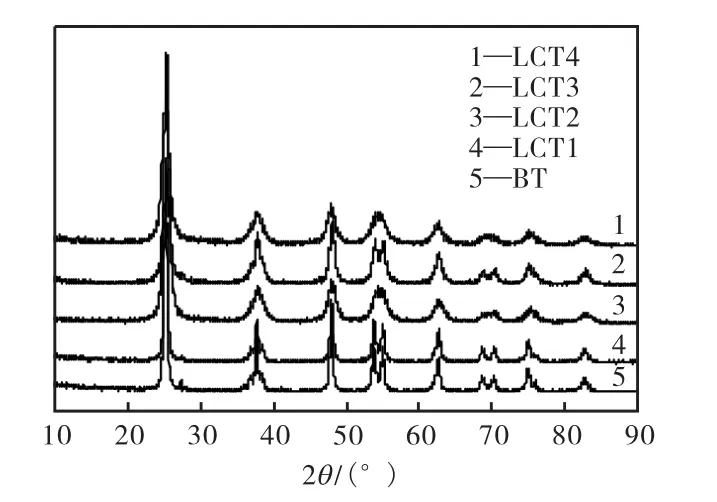
图1 不同La添加量的LCT的XRD谱Fig.1 XRD patterns of LCT with different doping amounts of La
2.2 TEM分析
图2为 BT与 LCT2在不同标尺下的 TEM全貌,可知稀土与铜共掺杂起到了抑制晶粒长大的作用,材料的晶粒粒径有所减小,但所制备纳米材料有一定的团聚现象.由图2中标尺5,nm下BT和LCT2的TEM局部放大电镜照片可以看出,掺杂后TiO2晶格条纹产生了明显的波纹(如箭头所指部位).分析其原因是由于 Cu2+和 La3+形成的替位掺杂和晶界掺杂影响了 Ti原子在晶格中的正常排布,加大了微观应力,从而产生了较明显的晶格畸变,这一现象与Václav等[15]的研究表征结果是一致的.

图2 BT和LCT2的TEM全貌Fig.2 TEM images of BT and LCT2
图3为 LCT3和LCT4纳米颗粒的能量色散 X射线荧光光谱(EDX).由10,nm标尺下的TEM图像分析颗粒的结晶状况时,会发现RE离子掺入到TiO2晶界后的晶格条纹与晶粒主体是有区别的.所制备的 LCT1和 LCT2样品可能是由于添加量太小,在EDX能谱图中未能检测出 La元素的存在.但在LCT3和LCT4两个样品的能谱图中则显示出该区域除了含有Ti、O元素外还有La元素的存在,LCT3和LCT4样品中La与Ti元素原子百分比分别为0.34%和 0.63%.这就说明了本研究采用的材料制备方法成功地使La掺杂进入到了TiO2颗粒中,证实了La元素的掺杂对TiO2的晶型结构、颗粒大小和晶面尺寸、催化剂性能均会产生一定程度的影响.

图3 LCT3和LCT4的EDX能谱Fig.3 EDX spectra of LCT3 and LCT4
2.3 XPS分析
对 LCT4纳米粉体进行 XPS表征分析,其全谱图中显示的只有C、O和Ti 3种元素的特征峰,谱图中没有出现 La在 835,eV附近的特征峰和 Cu在933,eV附近的特征峰,主要是因为Cu的离子半径为0.071,nm,与Ti的离子半径0.068,nm相近,因此较易替代Ti进入TiO2晶格中,形成替位掺杂.La的离子半径为 0.106,1,nm,大于 Ti的离子半径,会掺杂到TiO2晶界中引起诱发畸变;然而由于掺杂量较少,掺杂后的 La、Cu离子主要分散于 TiO2体相中,因此其在TiO2催化剂表面的含量过低而未被检出.
图 4(a)为纳米粉体在 Ti2p区域的 XPS图谱,图4(b)显示的是纳米粉体在 O1s区域的 XPS图谱.LCT4在 Ti2p的峰位有一定程度的偏移,其原因可能是掺杂元素离子与Ti4+及O2-形成M—O—Ti键(M为Cu或La),并使得Ti4+周围电子云密度增大,造成Ti2p轨道的结合能降低.
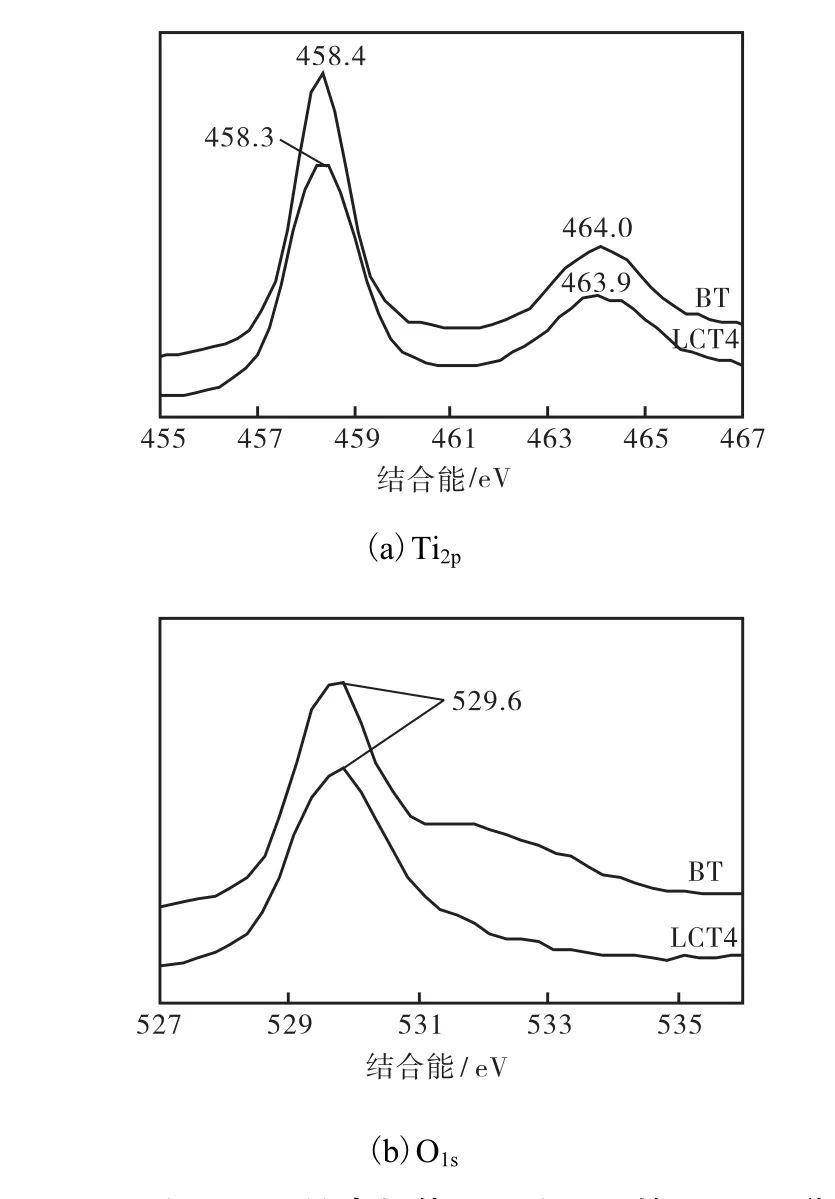
图4 BT和LCT4纳米粉体Ti2p和O1s的XPS图谱Fig.4 Ti2p and O1s XPS spectra of BT and LCT4 nanoparticles
2.4 光催化转化CO2活性测定
2.4.1 催化剂浓度对光催化转化CO2反应的影响
以LCT2纳米粉体作为催化剂,光催化反应6,h,考察不同催化剂加入量对产物甲醛生成量的影响,结果如图5所示.由图 5可知,当催化剂的加入量小于1.0,g/L时,随着加入量的增加,甲醛的生成量也呈增加的趋势.催化剂加入量的增加,有利于更多反应物吸附在催化剂表面,吸收更多的紫外光照,提高了光子生成率,进而促进了光催化还原CO2反应的进行.当催化剂的加入量大于1.0,g/L后,甲醛的生成量随着催化剂加入量的增加呈逐渐减少的趋势.产生该现象的原因是由于过多的催化剂对入射的紫外光产生了屏蔽作用,对反应液的透光率产生了影响,反而降低了光子的生成率.当催化剂的加入量为1.0,g/L时,光催化还原CO2反应的甲醛生成量最大,因此在本研究的实验条件下,催化剂的最佳用量为1.0,g/L.
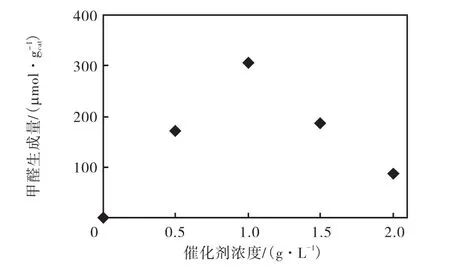
图5 催化剂浓度对光催化转化CO2反应的影响Fig.5 Effect of catalyst concentration on CO2 photoconversion
2.4.2 CO2体积流量对光催化转化CO2反应的影响
在对反应过程中CO2体积流量的变化对产物甲醛生成量影响的研究中,采用LCT2纳米粉体为催化剂,光催化反应6,h,通入的CO2体积流量分别为15,mL/min、30,mL/min、60,mL/min 和100,mL/min.实验结果表明,CO2体积流量为15,mL/min时,产物甲醛生成量为200,µmol/gcat,CO2体积流量为30,mL/min、60,mL/min和100,mL/min时,甲醛生成量分别为304.49,µmol/gcat、306.11,µmol/gcat和 310.55,µmol/gcat.由上述结果可知,当CO2体积流量大于或等于 30,mL/min时,CO2通入流量的变化对甲醛生成量基本没有影响.分析其原因是由于反应过程中通入N2进行曝气时会同时造成CO2气体的溢出,而反应过程中CO2气体的通入起到了补充原料的作用,因此甲醛生成量是随着CO2通入流量的增大而增加的.当反应过程中通入的CO2体积流量能完全弥补溢出量和反应量时,还原产物则不会再随CO2体积流量的增加而增加[16].因此,反应过程中保证通入的CO2体积流量大于或等于30,mL/min,则CO2体积流量的变化不会成为整个反应的限速步骤.
2.4.3 La不同掺杂量对光催化转化CO2反应的影响
图6为不同La掺杂量的LCT纳米材料对光催化转化CO2反应的影响.由图可知,不同La掺杂量的LCT光催化还原 CO2生成的甲醛量都是随着反应时间的增加而呈上升趋势的.反应结果表明,当 La的掺杂量为0.1%(LCT2)时,催化材料的光催化活性最高,反应6,h后,甲醛的生成量为 304.49,µmol/gcat;当La的掺杂量大于或小于0.1%时,催化剂的活性均低于LCT2.La元素与Cu元素的共掺杂会提高TiO2材料的光催化还原活性,La3+的掺杂引起晶格畸变,产生晶格缺陷和氧空位,可以作为光生电子和空穴的捕获阱,而 Cu元素除了可以进行替位掺杂来加大TiO2的晶格畸变外,其 Cu1+中间价态的存在更有利于光生电子的捕获和传递.Cu1+有着更高的捕获电子能力,这一点可以通过 Cu1+和 Cu2+的氧化还原电位(E0)来证实,即

由式(1)~式(3)可以看出,在各价态的铜物种中,Cu1+具有最正的氧化还原电位和最强的电子捕获能力,同时也最有利于光催化过程中电子和空穴的分离.吴树新等[17]的研究表明,纳米材料表面 Cu1+的存在会有利于光催化还原反应的进行,即

式(4)~式(6)表明,Cu1+通过捕获电子抑制了电子和空穴的复合,提高了光催化反应的效率,然后通过向碳物种传递电子,进而促进了光催化还原反应的进行.
当La的掺杂量小于0.1%时,掺杂离子提供的捕获陷阱数量有限,对电子-空穴复合的抑制能力较弱;当La掺杂量大于0.1%时,La3+掺杂产生了过量的晶格缺陷和氧空位,而过多的捕获阱会转变为光生电子与空穴的复合中心,导致光生电子和空穴的复合几率增加,从而降低了催化剂的活性.此外掺杂量的多少还会影响TiO2表面的空间电荷层厚度,其空间电荷层厚度随着掺杂量的增加而减少.只有当电荷层厚度近似等于入射光透入固体的深度时,所吸收光子产生的电子-空穴对才能发生有效分离[18].Yang等[19]的研究也验证了这一点,随着掺杂离子浓度的增加,光生电子-空穴对可以克服阻碍而复合,但是在一定浓度范围内,复合率满足
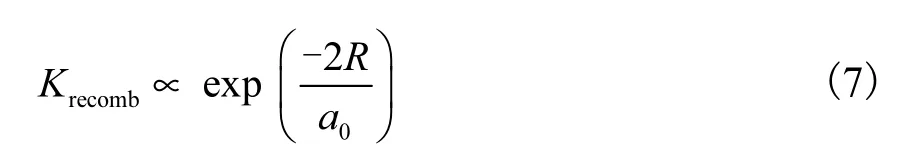
式中:Krecomb为复合率;R为捕获中心之间的距离.当掺杂超过最佳浓度时,随着金属离子浓度的增加,R值会变小,从而使光生电子-空穴对的复合率增加,光催化活性下降.
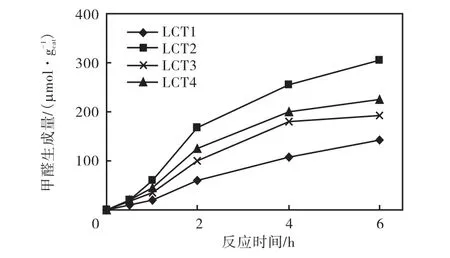
图6 不同掺杂量的LCT对光催化转化CO2反应的影响Fig.6 Effects of La doping amounts of LCT on CO2 photoconversion
3 结 语
采用溶胶-凝胶法制备的 La/Cu/TiO2纳米粉体在光催化还原 CO2的反应中表现出了较好的活性.其中 0.1%La/0.6%Cu/TiO2(LTC2)的活性最高,以0.2,mol/L,NaOH作为还原剂、300,W 高压汞灯(主波长为 365,nm)为辐照光源、光催化反应 6,h时,甲醛的生成量最大为 304.49,µmol/gcat..在本实验条件下,催化剂的最佳浓度为 1.0,g/L;当 CO2体积流量大于或等于30,mL/min时,CO2体积流量的变化不会成为整个反应的限速步骤.
[1] Peyermhoff S D,Bunker R J,Whitten J L. Linear stretch in polyatomic molecules:Accurate selfconsistent field molecular orbital wavefunctions for carbon dioxide and beryllium fluoride[J]. Chemical Physics,1967,46:1707.
[2] Inoue T,Fujishima A,Konishi S,et al. Photoelectrocatalytic reduction of carbon dioxide in aqueous suspensions of semiconductor powders[J]. Nature,1979,277(5698):637-638.
[3] Nguyen T V,Wu J C S. Photoreduction of CO2in an optical-fiber photoreactor:Effects of metals addition and catalyst carrier[J]. Applied Catalysis A:General,2008,335(1):112-120.
[4] Zhang X V,Ellery S P,Friend C M,et al. Photodriven reduction and oxidation reactions on colloidal semiconductor particles:Implications for prebiotic syn-thesis[J]. Journal of Photochemistry and Photobiology A:Chemistry,2007,185(2/3):301-311.
[5] Khedr M H,Abdel Halim K S,Zaki A H,et al. CO2decomposition over freshly reduced nano-crystallite Cu0.5Zn0.5Fe2O4at 400—600 ℃[J]. Journal of Analytical and Applied Pyrolysis,2008,81(2):272-277.
[6] Tseng I,Wu J C S,Chou H. Effects of sol-gel procedures on the photocatalysis of Cu/TiO2in CO2photoreduction[J]. Journal of Catalysis,2004,221(2):432-440.
[7] Yu K P,Yu W Y,Kuo M C,et al. Pt/titaniananotube:A potential catalyst for CO2adsorption and hydrogenation[J]. Applied Catalysis B:Environmental,2008,84(1/2):112-118.
[8] Adachi K,Ohta K,Mizuno T. Photocatalytic reduction of carbon dioxide to hydrocarbon using copper-loaded titanium dioxide[J]. Solar Energy,1994,53(2):187-190.
[9] Tseng I,Chang W,Wu J C S. Photoreduction of CO2using sol-gel derived titania and titania-supported copper catalysts[J]. Applied Catalysis B:Environmental,2002,37(1):37-48.
[10] Wu J. Photocatalytic reduction of greenhouse gas CO2to fuel[J]. Catalysis Surveys from Asia,2009,13(1):30-40.
[11] Anpo M,Yamashita H,Ichihashi Y,et al. Photocatalytic reduction of CO2with H2O on various titanium oxide catalysts[J]. Journal of Electroanalytical Chemistry,1995,396(1/2):21-26.
[12] 尹荔松,朱 剑,闻立时,等. 稀土掺杂纳米 TiO2光催化降解氯胺磷[J]. 中南大学学报:自然科学版,2009,40(1):139-144.Yin Lisong,Zhu Jian,Wen Lishi,et al. Photocatalytic degradation of chloramine phosphorus with RE doped TiO2[J]. Journal of Central South University:Science and Technology,2009,40(1):139-144(in Chinese).
[13] 胡红民,俞建长. La3+-SiO2掺杂纳米TiO2的合成及其光催化降解甲基橙的研究[J]. 中国稀土学报,2009(5):629-634.Hu Hongmin,Yu Jianchang. Synthesis of La3+-SiO2doped nano-TiO2and photocatalytic degradation of methyl orange[J]. Journal of the Chinese Rare Earth Society,2009(5):629-634(in Chinese).
[14] Spurr R A,Myers H. Quantitative analysis of anataserutile mixtures with an X-ray diffractometer[J]. Analytical Chemistry,1957,29:760-762.
[15] Václav S,Snejana B,Nataliya M. Preparation and photocatalytic activity of rare earth doped TiO2nanoparticles[J]. Materials Chemistry and Physics,2009,114(1):217-226.
[16] Kaneco S,Shimizu Y,Ohta K,et al. Photocatalytic reduction of high pressure carbon dioxide using TiO2powders with a positive hole scavenger[J]. Journal of Photochemistry and Photobiology A:Chemistry,1998,115(3):223-226.
[17] 吴树新,尹燕华,何 菲,等. 掺铜 TiO2光催化剂光催化氧化还原性能的研究[J]. 感光科学与光化学,2005,23(5):333-339.Wu Shuxin,Yin Yanhua,He Fei,et al. Photocatalytic redox performance of copper doped TiO2photocatalyst[J]. Photographic Science and Photochemistry,2005,23(5):333-339(in Chinese) .
[18] 谢先法,吴平霄,党 志,等. 过渡金属离子掺杂改性 TiO2研究进展[J]. 化工进展,2005,24(12):1358-1362.Xie Xianfa,Wu Pingxiao,Dang Zhi,et al. Research progress of photocatalytic performance of TiO2modified by doped transition metal ions[J]. Chemical Industry and Engineering Progress,2005,24(12):1358-1362(in Chinese).
[19] Yang Y,Li X,Chen J,et al. Effect of doping mode on the photocatalytic activities of Mo/TiO2[J]. Journal of Photochemistry and Photobiology A:Chemistry,2004,163:517-522.
- 天津大学学报(自然科学与工程技术版)的其它文章
- 稿 约

