呼吸道给药诱导产生干扰素的实验研究
王洪波,樊凤艳,刘 娟,祁术元
(空军总医院输血科,北京 100142)
呼吸道给药诱导产生干扰素的实验研究
王洪波,樊凤艳,刘 娟,祁术元
(空军总医院输血科,北京 100142)
目的探讨干扰素(IFNs)诱导剂从鼻腔给药,能否诱导呼吸道局部黏膜产生足量干扰素,预防呼吸道病毒感染性疾病。方法选用干扰素诱导剂聚肌胞、新城疫疫苗、阿比朵尔和刺五加多糖溶液,连续15 d从鼻腔滴入,然后检测实验动物血液和鼻腔分泌物中的干扰素含量。结果⑴各实验组动物血清中检测的干扰素含量比空白对照组明显低;鼻腔分泌物中检测的干扰素含量则比空白对照组明显高。说明通过鼻腔给予干扰素诱导剂,对血液中干扰素的产生无促进作用,对呼吸道黏膜干扰素的产生有诱导和促进作用。⑵与空白对照组比较,除刺五加多糖高剂量组差异无统计学意义(P>0.05)、刺五加多糖低剂量组差异有统计学意义(P<0.05)外,其他各实验组差异均有显著统计学意义(P<0.01)。⑶实验动物对鼻腔滴入上述制剂,有较好的适应性。结论聚肌胞、新城疫疫苗、阿比朵尔、刺五加多糖可以做为通过呼吸道给药的高效干扰素诱导剂,用于探讨预防和治疗人类呼吸道病毒感染性疾病。
干扰素;诱导剂;预防;呼吸道;病毒感染
为了探讨干扰素(IFNs)诱导剂从鼻腔滴入给药,能否诱导呼吸道局部黏膜产生足量干扰素,预防呼吸道病毒感染性疾病,笔者对通过文献检索筛选出4种高效干扰素诱导剂[1-5]进行了动物实验研究,报道如下:
1 材料与方法
1.1 干扰素诱导剂 鸡新城疫耐热保护剂活疫苗(La Sota株),批号20100101,血凝效价微量法1028、全量法1280,用5 ml注射用水稀释(A液);0.1%聚肌胞溶液(B液),广州天心制药厂生产;0.017%刺五加多糖溶液(C液),西安天一生物技术有限公司生产30%刺五加多糖粉剂,批号090303;0.1%盐酸阿比朵尔溶液(D液),苏州长征-欣凯制药有限公司生产盐酸阿比朵尔粉剂,批号090501;硝酸毛果芸香碱滴眼液(匹罗卡品),沈阳兴齐制药有限公司生产,批号091101,规格8 ml:80 mg。
1.2 实验动物 昆明种小鼠,雄性,5~8周龄,质量25~30 g,SPF级。北京大学医学部实验动物中心提供。试验动物共计140只,分组如下:实验组:分为A、B、C、D四组,A组为新城疫活疫苗组,B组为聚肌胞组,C组为刺五加多糖组,D组为阿比朵尔组;每组再分为高剂量、低剂量两个剂量组,每个剂量组14只,共计112只。对照组:包括注射用水对照组(E组)和匹罗卡品对照组(F组),每组14只。
1.3 试验方法 实验组(A、B、C、D组)按每只小鼠30 μl/次(每侧鼻腔各15 μl/次)鼻腔(点)滴入的方式给药,高剂量组每日上午、下午各一次,分别给予A、B、C、D液;低剂量组仅每日上午给药一次。均连续给药15 d,同时观察实验动物给药后的反应(有无活动弱、倦缩、食量减少、毛色差、嘶咬等)。于给药后第16天采集小鼠呼吸道及鼻腔分泌液和血清。
对照组按每只小鼠30 μl/次(每侧鼻腔各15 μ l/次)鼻腔(点)滴入的方式给予注射用水,每日上午一次。
匹罗卡品空白对照组按每只小鼠30 μl/次(每侧鼻腔各15 μl/次)鼻腔(点)滴入的方式给予注射用水,每日上午一次。但是在采集(呼吸道分泌液和)血清前,不注射0.01%匹罗卡品,也不采集呼吸道及鼻腔分泌液。
1.4 采集呼吸道及鼻腔分泌液和血清的方法 先给实验小鼠腹腔注射0.01%匹罗卡品600 μl/只/次),3 min后采集呼吸道及鼻腔分泌液,置于0.5 ml EP管中,-20℃保存[2]。然后再采用摘除眼球的方法,采集小鼠血液,分离血清,置于0.5 ml EP管中,-20℃保存。分别检测呼吸道及鼻腔分泌液和血清中的干扰素[6-7]。干扰素检测试剂由尚柏生物医学技术(北京)有限公司提供。检测仪器全自动多功能酶标仪(MULTISKAN MK3,Thermo,USA)。
1.5 统计学方法 采用SPSS11.5统计软体进行统计分析,实验数据采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 检测结果 各实验组小鼠血清中检测的干扰素含量均比空白对照组明显低;各实验组呼吸道及鼻腔分泌物中检测的干扰素含量均比空白对照组明显高。由于皮罗卡品对照组动物没有注射皮罗卡品,无法采集鼻腔分泌液,无法检测干扰素,见表1。
2.2 实验组间小鼠呼吸道及鼻腔分泌液的干扰素含量比较 各实验组中高、低剂量组检测的呼吸道及鼻腔分泌液干扰素含量结果间横向比较,聚肌胞高、低剂量组差异有显著统计学意义(P<0.01),其他各高、低剂量组间差异无统计学意义(P>0.05)。另外,选取了两组(分别以*和#标记)有代表意义的数据,进行纵向交叉比较(不同实验组、不同剂量组间),聚肌胞高剂量组与阿比朵尔低剂量组间、新城疫疫苗低剂量组与阿比朵尔低剂量组间差异有显著统计学意义(均P<0.01),见表2。
表1 各组小鼠血清中INF-a检测结果(±s,pg/ml)

表1 各组小鼠血清中INF-a检测结果(±s,pg/ml)
对照组新城疫疫苗组聚肌胞组刺五加多糖组阿比朵儿组注射用水组皮罗卡品组高剂量组低剂量组高剂量组低剂量组高剂量组低剂量组高剂量组低剂量组14 14 14 14 14 14 14 14 14 14 87.2±76.1 78.2±21.6 61.1±11.7 41.9±17.0 60.3±18.3 31.2±16.6 8.5±7.6 27.7±12.2 35.3±23.7 16.7±12.7 17.3±15.2 -93.9±31.6 125.1±19.2 135.6±20.0 37.2±17.3 37.2±17.3 39.5±14.8 72.3±11.4 79.7±12.0
表2 高、低剂量组间鼻腔分泌液INF-α检测结果比较(±s,pg/ml)
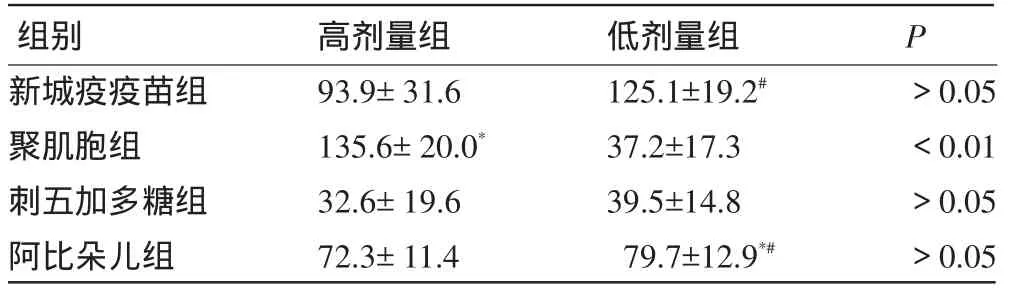
表2 高、低剂量组间鼻腔分泌液INF-α检测结果比较(±s,pg/ml)
注:聚肌胞高剂量组与阿比朵尔低剂量组比较,*P<0.01;新城疫疫苗低剂量组与阿比朵尔低剂量组比较,#P<0.01。
新城疫疫苗组聚肌胞组刺五加多糖组阿比朵儿组93.9±31.6 135.6±20.0* 32.6±19.6 72.3±11.4 125.1±19.2# 37.2±17.3 39.5±14.8 79.7±12.9*#>0.05<0.01>0.05>0.05
2.3 实验组与空白对照组小鼠呼吸道及鼻腔分泌液检测的干扰素含量比较 各实验组呼吸道及鼻腔分泌液检测的干扰素含量分别与注射用水对照组比较,除刺五加多糖组高剂量组差异无统计学意义(P>0.05)、低剂量组差异有统计学意义(P<0.05),其余各组差异均有显著统计学意义(P<0.01)。说明聚肌胞、新城疫疫苗、阿比朵尔制剂均可以通过鼻腔滴入给药,并且均能较好地诱导呼吸道黏膜产生干扰素。
3 讨论
以流感为代表的呼吸道病毒感染性疾病,由于其多发性和变异性,一直困扰着相关的医学研究、预防和治疗。干扰素具有广谱非特异性抗病毒作用,且流感、副流感等呼吸道感染性病毒几乎全对其敏感早有定论[8],但是由于外源性干扰素价格较高和具有一定的副作用,限制了其在预防呼吸道病毒感染性疾病中的广泛使用。IFNs诱导剂可诱导机体自身上皮细胞(含呼吸道黏膜上皮细胞)产生IFNs,使局部形成抗病毒状态也有定论[9]。IFNs诱导剂的应用,国内外报道较多的是和抗病毒药物(如IFNs、病毒唑等)同时应用治疗病毒感染性疾病(如流感、流行性出血热、乙型肝炎等)。近年来国外已有报道,单独采用IFNs诱导剂涂(软膏)于鼻腔、滴(液体)入鼻腔或口服(片剂)等方式预防和治疗呼吸道病毒感染性疾病(包括流感),比如文献报道的使用Ridostine、Poludane、Cycloferon等可使病程明显缩短、症状减轻、死亡率降低[10-13]。但是,将该类药物直接、单独应用于呼吸道局部,探讨预防呼吸道病毒感染性疾病,国内尚未见报道。
本研究对比观察新城疫活疫苗、聚肌胞、刺五加多糖和阿比朵尔溶液诱导小鼠呼吸道产生IFNs的实验,结果表明:⑴各实验组呼吸道及鼻腔分泌液中检测的干扰素,除刺五加多糖低剂量组与注射用水对照组差异无统计学意义外,其他实验组差异均有显著统计学意义。证明通过鼻腔滴(喷)入适当剂量高效干扰素诱导剂,可以诱导呼吸道黏膜产生干扰素。⑵各实验组血清中检测出的干扰素均比空白对照组低,说明通过鼻腔滴入干扰素诱导剂,对血液中干扰素的产生无促进作用。各实验组呼吸道及鼻腔分泌物中检测的干扰素含量均明显高于空白对照组,说明通过鼻腔给予干扰素诱导剂,对呼吸道黏膜产生干扰素有促进作用。聚肌胞高剂量组和新城疫疫苗高、低剂量组鼻腔分泌物干扰素含量明显较高;其次是阿比朵尔高、低剂量组。刺五加多糖低剂量组结果不理想。⑶在实验过程中,未发现实验动物有异常反应,说明动物对聚肌胞、新城疫疫苗和阿比朵尔的鼻腔滴入给药有较好的适应性。上述实验研究结果在国内首先证明:呼吸道单独给予干扰素诱导剂,可以诱导局部产生干扰素,达到了预期实验目的。聚肌胞、新城疫疫苗、阿比朵尔和刺五加多糖制剂,均可做为通过呼吸道给药的高效干扰素诱导剂,用于探讨预防和治疗人类呼吸道病毒感染性疾病。尤其是由于呼吸道局部给药,可以在较短时间内在呼吸道局部形成广谱抗病毒状态,比注射疫苗产生特异性抗体时间更短、抗病毒范围面宽,对于应急预防一些对干扰素敏感的已知或未知呼吸道病毒感染性疾病具有重要的意义。另外,上述干扰素诱导剂国内资源丰富,生产工艺流程不复杂,比较容量在短期内大量生产,可以用于对干扰素敏感的呼吸道病毒感染性疾病的暴发流行的预防和治疗。
[1]王国良,刘善红,宋淑英,等.聚肌胞滴鼻液佐治小儿反复呼吸道感染的临床及免疫功能观察[J].中国实用儿科杂志,2001,16(9): 555-556.
[2]沈富兵,郑崛村,程曦,等.新城疫病毒合用中药黄芪诱生内源性干扰素的研究[J].成都医学院学报,2008,3(1):24-60.
[3]靳玉琴, 孙 飞,张淑琴,等.盐酸阿比朵尔抗流感病毒感染的药效研究[J].中国药理学通报,2004,20(10):1150-1152.
[4]周一平,蒋景仪,陈四艳,等.阿比朵尔对小鼠的免疫调节作用[J].医药导报,2005,24(11):989-991.
[5]钱 农,杨吉成,盛伟华,等.人参多糖及其皂甙等五种中药提取物促生人干扰素的研究[J].苏州医学院学报,1997,17(1):31-32.
[6]司 刚,符珍珠,李 洪,等.布地奈得对支气管哮喘患儿血清中IL-4、IL-13和IFN-r水平的影响[J].海南医学,2011,22(18): 113-115.
[7]殷宗宝,邓 超,李 英,等.甘草酸二铵对博莱霉素致肺纤维化大鼠的治疗作用[J].重庆医学,2011,40(2):122-124.
[8]候云德.分子病毒学[M].北京:学苑出版社,1990:86-9.
[9]向近敏.病毒分子生态学[M].武汉大学出版社,2004:75-78.
[10]Masycheva VI,Danilenko ED,Sergeev AN.The influence of interferon inducer,a stimulator of innate immunity,on influenza[J].Eur J Immuno,2009,39(1):250.
[11]Shumilov VI,Ivannikov IG,Ogarkov PI,et al.Epidemiologic effectivness of poludane in preventing influenza and other acute respiratory diseases in troops[J].Voen Med Zh,2002,323:(1):45-47,93.
[12]Romantsov MG,Ershov FI,Kovalenko AL.Problems in treating influenza and acute respiratory infection in children[J].Eksp Klin Farmakol,2011,74(6):41-45.
[13]Romantsov MG,Golofeevskiǐ SV.Cycloferon efficacy in the treatment of acute respiratory tract viral infection and influenza during the morbidity outbreak in 2009-2010[J].Antibiot Khimioter,2010, 55:(1-2):30-35.
Study on interferon induced by respiratory tract medication.
WANG Hong-bo,FAN Feng-yan,LIU Juan,QI Shu-yuan.Department of Blood Transfusion,the General Hospital of Air Force,Beijing,100142,CHINA
ObjectiveTo explore whether the interferon(IFNs)inducer through nasal administration can induce local respiratory mucosa to produce sufficient amount of interferon,and to prevent respiratory tract virus infections.MethodsFour interferon inducers,Poly I:C,Newcastle disease virus vaccine,Arbidol,Polysaccharides of Acanthopanax senticobas(PAS)solution,were applied through nasal administration for 15 days,and then the levels of interferon in animal blood and nasal secretions were detected.Results(1)The detected interferon levels in the serum were significantly lower in the experimental groups than the control group,and that in the nasal secretions were significantly higher in the experimental groups than the control group,which indicated that interferon inducers trough nasal administration can not promote the production of interferon in the blood,but can induce and promote respiratory mucosa to produce interferon.(2)Compared with the control group,the detected interferon levels of Polysaccharides group with low dose(P<0.05)and other experimental groups(P<0.01)were significantly promoted(P<0.05)except for Polysaccharides group with high dose(P>0.05).(3)Experimental animals treated with above mentioned interferon inducers through nasal administration had good adaptability.ConclusionThe four interferon inducers,Poly I:C, Newcastle disease virus vaccine,Arbidol,PAS solution through nasal administration can prevent and treat infections of respiratory tract virus.
Interferon(IFNs);Inducer;Prevention;Respiratory tract;Virus infection
R183.3
A
1003—6350(2012)19—016—03
10.3969/j.issn.1003-6350.2012.19.006
王洪波(1956—),男,河南省濮阳市人,主任技师,本科。
2012-07-13)
·临床研究·

