马铃薯纺锤块茎类病毒山西分离物侵染性克隆的构建
白云凤,闫建俊,张耀,张忠梁,冯瑞云,张维锋
(山西省农业科学院作物科学研究所,农业部黄土高原作物基因资源与种质创制重点实验室,山西 太原 030032)
马铃薯纺锤块茎类病毒(Potato spindle tuber viroid,PSTVd)是发现最早的一种类病毒,也是已知最小的可以在寄主体内自我复制的病原。其分子是单链环状裸露的RNA,没有外壳蛋白质包裹,因此,没有免疫原性。PSTVd是引起马铃薯品种退化的重要病害之一[1-2],它能在细胞核内复制和累积,茎尖脱毒都难以剔除。其传播途径广泛,包括汁液传播(切刀、种薯切块间摩擦、农机具以及茎、叶接触等扩散)、媒介昆虫传毒、实生种子带毒等。根据受侵染植株出现的症状,PSTVd可分为强系、弱系和中间株系。强系通常能使植株减产60%以上。PSTVd侵染后潜伏期长并能持续感染,使马铃薯产量和品质严重下降,而迄今尚无有效方法防治。
本研究通过构建PSTVd的cDNA侵染性克隆,使人们在DNA水平上能开展该病毒的分子生物学研究,亦为采取有效措施进行防治提供依据,为类病毒的毒源保存提供新的途径。
1 材料和方法
1.1 供试材料
感病薯块采自山西省阳曲县,品种为紫花白。番茄品种为矮红宝,由山西省农科院作物科学研究所转基因实验室保存。克隆载体pBS-T购自Takara生物公司,大肠杆菌Top10由山西省农科院作物科学研究所转基因实验室保存。生化和分子生物学试剂包括 RNA酶抑制剂(Rnasin),M-MLV 反转录酶,Taq DNA 聚合酶,dNTP,T7 RNA聚合酶等,均购自Takara生物公司。琼脂糖凝胶回收试剂盒购自博迈德生物公司。
1.2 PSTVd的cDNA合成和PCR扩增
1.2.1 引物设计 根据报道的PSTVd同源序列设计合成1对引物,正向引物:5′-ATCCCC GGGGAAACCTGGAGCGAAC-3′;反向引物:5′-CCCTGAAGCGCTCCTCCGAG-3′。引物由北京六合华大基因科技股份有限公司合成。
1.2.2 马铃薯总RNA提取 其采用文献[3]的改进方法。
1.2.3 RT-PCR扩增 以马铃薯感病薯块总RNA为模板,按以下步骤反转录合成cDNA第1 链:2 μg 总 RNA,10μmol/L 反向引物 2 μL,10mmol/L 的 dNTP 1.5 μL 和 ddH2O 12.5 μL,混匀,70℃水浴5 min,冰浴5 min,再加入5×RT buffer 5 μL,RNasin 1 μL 和 M-MLV 反转录酶1 μL,混匀后,放于 42 ℃ 60min,然后于 70℃15 min停止反应。以cDNA第1链为模板进行PCR 扩增。扩增体系总体积为 50μL,包括:5 μL cDNA 第 1 链,10×PCR buffer 5 μL,10mmol/L dNTPs 1 μL,10μmol/L正向引物 2 μL,10μmol/L反向引物 2 μL,Taq DNA 聚合酶(大连,TaKaRa)0.3 μL和 ddH2O34.7 μL。反应程序为:94 ℃预变性 5 min;94 ℃ 45 s,57 ℃ 45 s,72 ℃ 45 s,35 个循环;72℃延伸10min。
扩增的PCR产物用1.0%琼脂糖凝胶电泳检测,目标条带用琼脂糖凝胶回收纯化试剂盒回收后,连接到pBS-T载体上,转化大肠杆菌Top10感受态细胞,酶切初步鉴定后,挑选阳性克隆,送北京六合华大基因科技股份有限公司测序。
1.3 侵染性cDNA克隆的体外转录和接种
将阳性克隆用BamHI线性化后作为模板,利用T7 RNA聚合酶进行体外转录。转录产物用于接种。寄主植物番茄苗种于花盆。出苗2周后,提取叶片总RNA,并以此为模板进行RT-PCR检测,反应体系同1.2.3,确认无毒后进行接种。接种物分别是PSTVd转录产物、BamHI线性化的阳性克隆和pBS-T空质粒。接种前,将待接种叶片表面均匀涂抹金刚砂,之后用戴PE手套的手指蘸取接种液逆叶毛方向轻轻摩擦叶片,每株植物接种2~3个叶片。接种后10min向叶片表面喷洒清水,冲洗残留的金刚砂。接种后的植物保湿1 d,然后正常培养,约2周后取叶片提取总RNA,进行RT-PCR检测,同时将RT-PCR产物纯化后送北京六合华大基因科技股份有限公司测序。
2 结果与分析
2.1 PSTVd山西分离物的cDNA合成和PCR扩增
以马铃薯感病块茎的总RNA为模板进行RT-PCR扩增。1.0%琼脂糖凝胶分离,显示扩增产物片段大小约360bp(图1),与预期相符。回收扩增产物,与克隆载体pBS-T连接,阳性克隆测序。结果表明,该片段长度为359 bp,含71个A,79个 T,108个C,101个 G,G+C含量58.2%。将克隆的PSTVd命名为PSTVd山西分离物(PST Vd-SX),将克隆载体命名为pBS-PSTVd-SX。

2.2 PSTVd-SX核苷酸序列分析
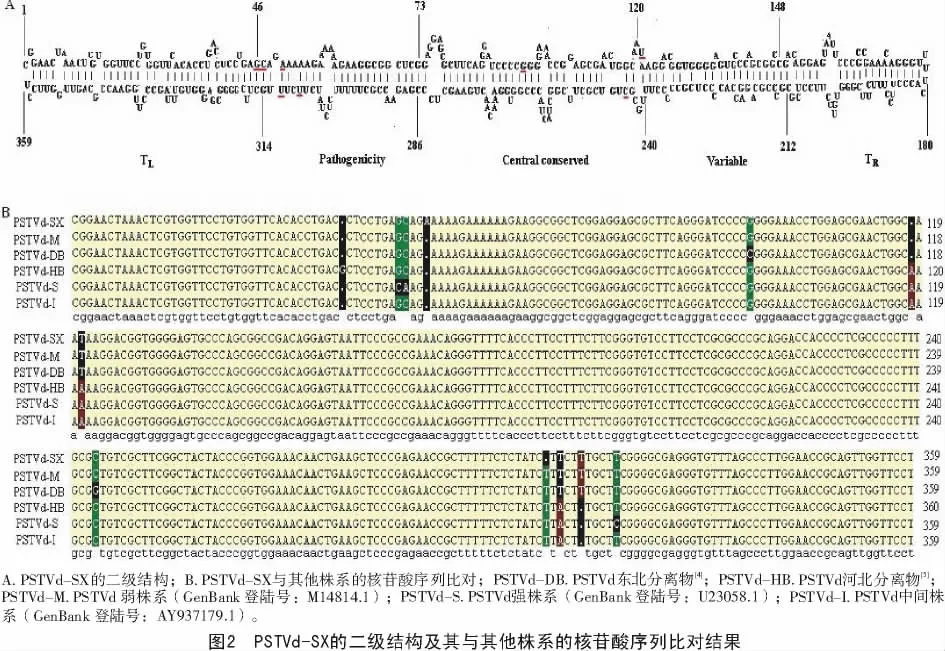
用软件DNAMAN对PSTVd-SX的核苷酸序列进行二级结构分析,表明PSTVd-SX的RNA分子能通过分子内序列互补形成致密的二级结构(图2-A)。将克隆序列作为query进行Blast搜索,结果表明,该序列与PSTVd荷兰分离物(GenBank登陆号:AY372400.1)的序列完全一致。将其与PSTVd东北分离物[4]、河北分离物[5]及已公布的PSTVd弱株系(GenBank登陆号:M14814.1)、强株系(GenBank 登陆号:U23058.1)和中间株系(GenBank登陆号:AY937179.1)进行序列比对(图2-B),共有12个核苷酸具有多态性,其中有2个发生在左末端,6个发生在致病区,3个发生在中央保守区,1个发生在可变区。
2.3 PSTVd-SX的体外转录物及其cDNA的侵染性
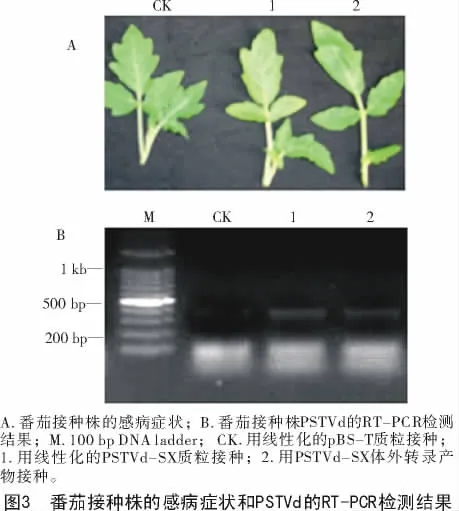
将质粒pBS-PSTVd-SX用DNA限制性内切酶BamHI消化使之线性化之后,用T7 RNA聚合酶进行体外转录。之后分别用转录产物、线性化的pBS-PSTVd-SX和pBS-T空质粒给番茄植株接种。接种20d后,接种转录产物和pBS-PSTVd-SX质粒的植株叶片出现轻微黄斑,心叶稍皱,接种pBS-T空质粒的植株正常(图3-A)。提取接种株上部叶片总RNA进行RT-PCR检测,接种PSTVd的体外转录物及其pBS-PSTVd-SX质粒的植株均显示特异条带,而接种pBS-T空质粒的植株无特异条带(图3-B)。将接种转录产物和质粒pBS-PSTVd-SX植株的RT-PCR产物纯化后测序,结果表明,二者均与PSTVd-SX的序列完全一致。
3 讨论
PSTVd是第1个被鉴定的类病毒,在体外最小自由能的情况下呈棒状或半棒状的二级结构[6],含有5个结构功能区:左末端区、致病区、中央保守区、可变区和右末端区[7]。致病区与病毒的致病性有关,中央保守区与病毒的复制有关。PSTVd山西分离物与其他几个国内外代表性株系的核苷酸序列比对结果表明,其与荷兰的弱株系一致性最高,仅有2个核苷酸的差异,结合该分离物对番茄的致病性,初步将其归为弱株系。在本研究范围内,PSTVd共有12个核苷酸具有多态性,其中有6个发生在致病区。分析这6个位点的核苷酸变化趋势,与株系强弱没有直接关系,似乎预示着致病性主要与二级结构相关。
PSTVd容易发生变异。几个核苷酸的变换不仅影响致病性,而且影响到它的寄主范围[8]。本研究构建的PSTVd侵染性克隆在接种番茄后并未发生变异。保存质粒或菌液比保存叶片更为简单经济。PSTVd侵染性克隆的构建为毒源保存提供了一条新的途径,也为下一步的遗传操作奠定了基础。
交互保护是植物与病原物互作中常见的现象[9-10]。当植株被类病毒弱株系侵染之后,会对相近病毒包括PSTVd的强株系的侵染产生抗性[11]。PSTVd传播途径广,茎尖脱毒难以剔除,实生种子也能传播,生产上很难防治。能否通过定点突变构建弱毒甚至无毒的PSTVd株系用于植物交叉保护,使马铃薯免受强株系的侵染,降低产量损失,尚需研究探讨。
本研究构建的PSTVd侵染性克隆在PSTVd序列的上、下游均有冗余序列,仍能在植物体内启动转录。如果在其末端连接功能基因也能启动转录,将对研究基因功能或作为生物反应器具有重要意义。因为PSTVd分子量小,其基因组仅具最小RNA病毒的1/10,容易构建不同毒性的株系,并且接种简单,比植物病毒载体更易进行遗传操作。
[1]Gora A,Candresse T,Zagorski W.Analysis of the population structure of three phenotypically different PSTVd isolates[J].Archives Virology,1994,138:233-245.
[2]白云凤.马铃薯束顶型退化及其防治 [J].山西农业科学,1987(5):23-25.
[3]白云凤,郭志华,白冬梅,等.马铃薯总RNA提取和鉴定方法的改进[J].园艺学报,2007,34(4):1059-1062.
[4]吕典秋,李学湛,杨希才,等.马铃薯纺锤块茎类病毒(PSTVd)东北分离物的核苷酸序列分析[J].农业生物技术学报,2005,13(1):131-132.
[5]吴志明,贾晓梅,谢晓亮,等.马铃薯纺锤块茎类病毒RTPCR检测及全序列分析 [J].华北农学报,2003,18(院庆专辑):63-65.
[6]Dingley A J,Steger G,Esters B,et al.Structural characterization of the 69 nucleotide Structural characterization of the 69 nucleotide potato spindle tuber left-terminal domain by NMR and thermodynamic analysis[J].J Mol Biol,2004,334(4):751-767.
[7]Keese P,Symons R H.Domains in viroids:Evidengce of intermolecular RNA rearrangenments and their contribution to viroid evolution[J].Proc Natl Acad Sci,1985,82:4582-4586.
[8]Wassenegger M,Spieker R,Thalmeir S,et al.A Single nucleotide substitution converts potato spindle tuber viroid(PSTVd)from a noninfectious to an infectious RNA for Nicotiana tabacum[J].Virology,1996,226:191-197.
[9]丁金城,喻衣蓉.黄瓜枯萎病生物防治的研究[J].天津农业科学,1985(1):14-18.
[10]Khoury J,Singh R P,Boucher A,et al.Concentration and distribution of mild and severe strains of Potato spindle tuber viroid in cross-protected tomato plants[J].Phytopathology,1988,78:1331-1336.
[11]Qi Y,Ding B.Inhibition of cell growth and shoot development bya specific nucleotide sequence in a noncoding viroid RNA[J].The Plant Cell,2003,15:1360-1374.
