食品级番茄红素微乳的质量评价
王 晶,刘 宁,3*
(1.乳品科学教育部重点实验室,哈尔滨 150030;2.东北农业大学食品学院,哈尔滨 150030;3.国家乳业工程技术研究中心,哈尔滨 150086)
番茄红素(Lycopene)是一种重要的类胡萝卜素,分子式为C40H56,相对分子质量为536.85[1]。番茄红素不具备β-芷香环结构[2],不表现维生素A的生理活性,因此对它研究较少。近20年来,国内外越来越多的研究和调查表明,番茄红素具有多种优越的生理功能。番茄红素是类胡萝卜素中最有效的单线态氧淬灭剂,其抗氧化性是类胡萝卜素中最强的[3]。番茄红素现已被联合国粮农组织(FAO)、食品添加剂委员会(JECFA)和世界卫生组织(WHO)认定为A类营养素,并被50多个国家和地区作为具有营养与着色双重作用的食品添加剂。目前,番茄红素对人体健康的作用日益引起广泛关注,成为营养学及相关领域研究的热点。但番茄红素稳定性较差且体内生物利用度较低等问题一直未解决。
微乳(Microemulsion,ME)一般是由表面活性剂、助表面活性剂、油相和水相按适当比例形成的一种均匀、低粘度、热力学稳定的透明或半透明分散体系[4]。其液滴一般介于10~100 nm。按结构可分为水包油(O/W)型、油包水(W/O)型和双连续型微乳。微乳具有毒性小、安全性高、不需特殊设备即可大量生产等优点,因而已被广泛应用于食品、保健品、药物等行业中[5]。本研究制备一合适的O/W型微乳来包封番茄红素,并分析该载体的性质、测定微乳包埋率和稳定性以及体外释放的考察。以制备出较为理想的番茄红素微乳,克服番茄红素易被氧化、不溶于水及生物利用度低等不足,提高其在食品中的应用。
1 材料与方法
1.1 材料与仪器
研究用的材料有:柠檬烯((R)-(+)-Limonene),纯度96%,分析纯,上海晶纯试剂有限公司;番茄红素,纯度90%,分析纯,华北制药股份有限公司;Crelnphor EL-35,Tween 80,油酸乙酯,无水乙醇,乙酸乙酯,丁酸乙酯,二氯甲烷,石油醚,均为分析纯,均来自天津市东丽区天大化学试剂厂;水为超纯水。
采用的仪器有:UV-1201紫外可见分光光度计(北京瑞利分析仪器公司);Delta320型pH计(瑞士梅特勒-托利多有限公司);HJ-3数显恒温磁力搅拌器(江苏金坛市金南仪器厂);SYNERGY超纯水仪(美国Millipore公司);ALV5000型动态光散射仪(DLS)(美国Brookhaven Instruments公司);透射电镜(日本日立H-7650)。
1.2 方法
1.2.1 微乳处方的选择
试验中初步选取柠檬烯、乙酸乙酯、丁酸乙酯、大豆油和油酸乙酯作为油相。取5个50 mL烧杯,分别加入各种油相,在各烧杯中均加入过量的番茄红素,50℃水浴加热并通入氮气持续搅拌5 min后,充分振荡后离心,取上清液用0.45 μm微孔有机膜过滤,取等体积的滤液稀释。吸取稀释液至容量瓶中稀释至刻度,在472 nm处测定吸光值,求得番茄红素在各种油中的饱和溶解度[6]。根据番茄红素在油中的溶解度大小确定油相,选择合适的表面活性剂和助表面活性剂。
1.2.2 拟三元相图的绘制
相图制备方法[7]如下:固定复配表面活性剂和油相的质量比例为1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2和9∶1,在磁力搅拌下逐滴加水,充分混合,水浴恒温(25±1)℃。充分搅拌混合均匀,当体系由浊变清或由清变浊时,记录出现相变时的加入的水的质量,计算水在体系中所占的质量分数。在相图中标出相应的点,连接成曲线即得到相图。外观为透明或半透明和离心(10 000 r·min-1,30 min)稳定不分层,可判为微乳[8]。
1.2.3 微液的形态观察
采用透射电镜观察微乳形态。将铜网置于蜡板上滴加2 μL的微乳,然后自然晾干把2%磷钨酸一滴滴在蜡板上,将晾干的铜网倒覆于染液上,负染15 min,然后用蒸馏水冲洗、吸干,电镜观察[9]。
1.2.4 微乳粒径的测定
利用DLS测定番茄红素微乳粒径。取样品的用水稀释(50 mL)在容量瓶中,轻轻混颠倒容量瓶混合。由此产生的乳液1 h后通过动态光散射仪测定其粒径[10]。并测定一个月内的微乳液的粒径变化,考察其稳定性。
1.2.5 体外释放度的考察
采用透析袋法。取番茄红素微乳原液、微乳稀释液和番茄红素对照液各1 mL(番茄红素5 mg·mL-1)。以番茄红素混悬液为对照液。温度为37℃,转速50 r·min-1,在预设的时间间隔,从溶出杯中抽取2 mL样品溶液,测定番茄红素的含量,同时补充相应体积相同温度的溶出介质。溶出介质模拟肠液(pH为6.8,PBS),比较不同剂型对番茄红素的释放率的影响。
1.2.6 微乳包埋率的测定及稳定性的考察
1.2.6.1 紫外分光光度计测定番茄红素含量方法的建立
准确称取番茄红素2 mg,用石油醚二氯甲烷溶液(比例为12.5∶1)溶解并定容在25 mL棕色容量瓶中,得浓度为80 μg·mL-1的番茄红素溶液。准确吸取上述溶液0.025、0.05、0.1、0.2和0.4 mL,用石油醚二氯甲烷溶液容于10 mL的棕色容量瓶中,摇匀,得浓度为0.2~3.2 μg·mL-1的标准溶液,冰浴保存。分别测其吸光值(OD),以OD为纵坐标,番茄红素浓度为横坐标绘制标准曲线[6]。配制浓度为0.16~2.56 μg·mL-1番茄红素标准液,以石油醚二氯甲烷溶液为空白对照,于1 d和一周内分别重复测定5次,计算回收率,日内精确度和日间精确度。
1.2.6.2 番茄红素微乳包埋率的测定及稳定性考察
称取一定量的番茄红素,在氮气保护下,95℃加热下使其溶解于已知量的柠檬烯中,再根据相图计算的量滴加乙醇、Tweeen 80和水的混合液,滴加过程中使用磁力搅拌器搅拌。即得含一定量番茄红素的微乳。采用超速离心法分离微乳[11],10 000 r·min-1离心2 h,取上层液0.5 mL,用石油醚二氯甲烷溶解,利用紫外分光光度计法测定番茄红素的含量。被包封的番茄红素的浓度(C1)。制剂中番茄红素的总浓度(C0),按下式计算番茄红素微乳中对番茄红素的质量包封率(Q)。
Q(%)=C1/C0×100%
2 结果与分析
2.1 微乳配方的选择
微乳的形成与否取决于所选择的油水比例和表面活性剂的种类等。而作为食品载体,所选组分必须无刺激性、无毒,食品在微乳中的生物利用度高,形成的微乳区域较大,对其增溶能力好。试验选定5种食品级微乳中常用的油相,即,大豆油、柠檬烯、乙酸乙酯、丁酸乙酯和油酸乙酯。测定各油相对番茄红素的饱和溶解性。试验结果为:乙酸乙酯<丁酸乙酯<油酸乙酯<大豆油<柠檬烯。因此本试验选用对番茄红素溶解度较大的柠檬烯作为制备微乳的油相。微乳制备过程中应根据油相的性质和欲制备微乳的类型选择合适的表面活性剂。一般认为,在8~18时形成O/W型微乳。作为食品级的体系表面活性剂的选择有很大限制。通过HLB值选择Crelnphor EL-35,Tween 80为表面活性剂,无水乙醇作为助表面活性剂,通过拟三元相图进一步筛选微乳配方的配比。
2.2 拟拟三元相图的绘制
以柠檬烯作为油相,分别选取表面活性剂Crelnphor EL-35和Tween 80与助表面活性剂乙醇的配比分别为1∶1、2∶1、3∶1的比例作为混合表面活性剂相在(25±1)℃下用滴定法绘制相图。所得相图如图1所示(以下均为质量百分比)。
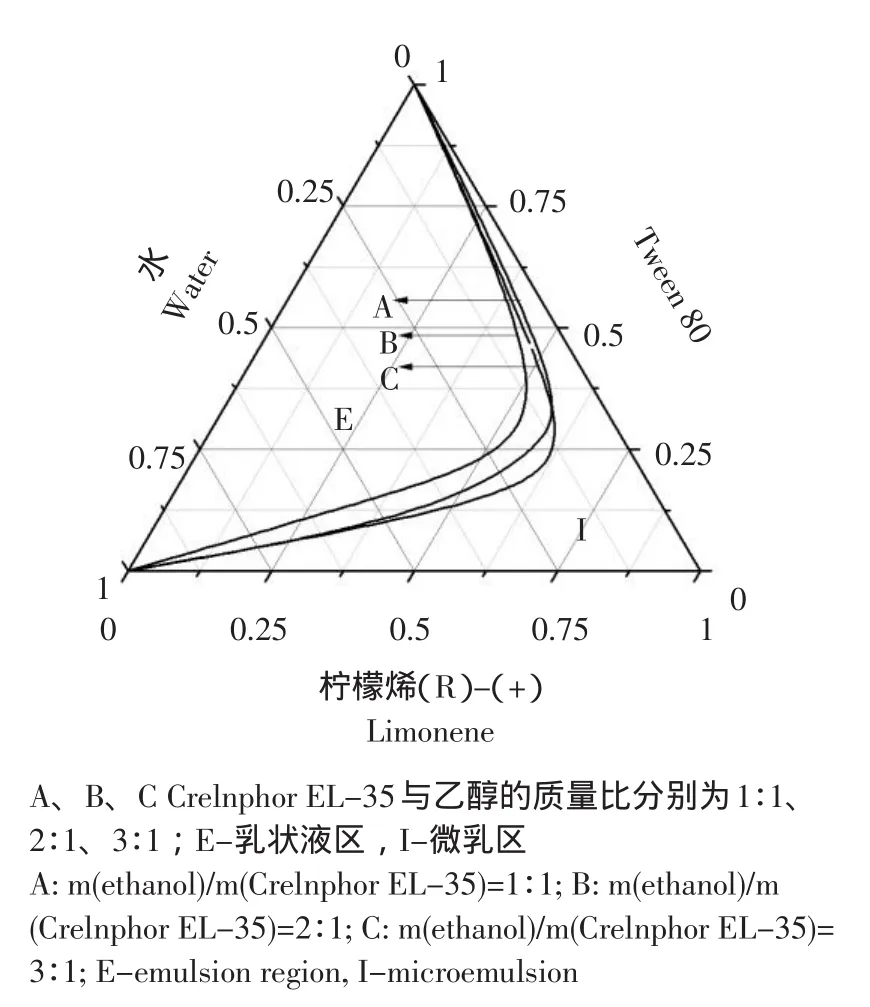
图1 不同乙醇与Crelnphor EL-35配比下Crelnphor EL-35/乙醇/柠檬烯/水体系的拟三元相图Fig.1 Pseudo-ternary phase of Crelnphor EL-35/ethanol/(R)-(+)-limonene/water system with different weight ratios of ethanol/Crelnphor EL-35
从图1中可以看出,当Crelnphor EL-35与乙醇以2∶1进行复配时微乳相图中的微乳区的面积最大,即当以柠檬烯作为油相,表面活性剂Crelnphor EL-35/乙醇以2∶1复配作为混合表面活性剂时,形成的微乳区域较大。
从图2中可以看出,当Tweeen 80与乙醇以2∶1进行复配时微乳相图中的微乳区的面积最大,即当以柠檬烯作为油相,表面活性剂Tweeen 80/乙醇以2∶1复配作为混合表面活性剂时,形成的微乳区域较大。由图2可知,Tweeen 80/乙醇以2∶1复配混合表面活性剂时,形成的微乳区域最大。即当以柠檬烯作为油相,Tweeen 80/乙醇以2∶1复配混合表面活性剂时,形成的微乳区域最大。
在相关文献中看到,在制备微乳相图时,大多是将表面活性剂与助表面活性剂进行复配作为混合表面活性剂进行微乳的制备。实验中发现,以柠檬烯与乙醇复配作为混合油相,以Tween 80作为表面活性剂在(25±1)℃下用滴定法绘制相图。所得相图如图3所示。
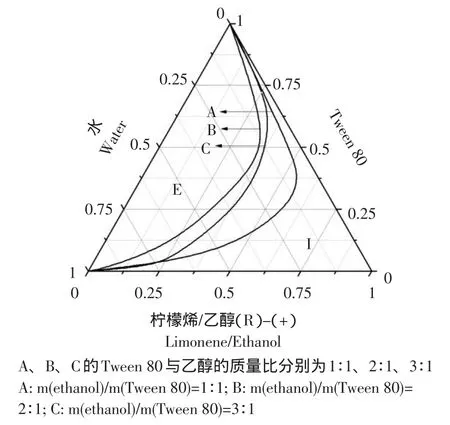
图2 不同的乙醇与Tween 80配比下Tween 80/乙醇/柠檬烯/水体系的拟三元相图Fig.2 Pseudo-ternary phase of Tween 80/ethanol/(R)-(+)-limonene/water system with different weight ratios of ethanol/Tween 80

图3 不同的乙醇与柠檬烯配比下Tween 80/乙醇/柠檬烯/水体系的拟三元相图Fig.3 Pseudo-ternary phase of Tween 80/ethanol/(R)-(+)-limonene/water system with different weight ratios of ethanol/(R)-(+)-limonene
从相图中可以明显看到,当乙醇与柠檬烯进行复配时所形成的拟三元相图与先前使用混合表面活性剂所做相图最大的区别就是微乳区域的面积明显增加。原因是油相的比例越大越不容易形成微乳,助表面活性剂与油进行复配作为混合油相,即可减小油的用量,故形成的微乳区域会增大。柠檬烯与乙醇的质量比为1:2所形成的微乳液区域最大,但考虑到该微乳液体系包埋番茄红素,因此应尽可能提高油相的含量,故选定柠檬烯与乙醇得最佳配比为1:1。因此最佳的微乳体系为柠檬烯与乙醇1:1作为混合油相,Tween 80作为表面活性剂。
2.3 微乳的形态观察
番茄红素微乳透射电镜形态学观察结果见图4。从图中可以看出,番茄红素微乳液液滴均为球形,大小分布均匀。粒径均小于100 nm,达到微乳的粒径要求。

图4 番茄红素微乳液透射电镜照片结果(×100 000)Fig.4 Representative transmission electron microscopy(TEM)image of resulting Lycopene microemulsion(×100 000)
2.4 微乳粒径的测定
微乳液粒径是考察微乳液体系稳定的重要参数[13]。通过DLS测定空白微乳的平均粒径为22 nm,番茄红素微乳的平均粒径为(43±2.35)nm。图5则是粒径与时间的关系,实验中我们仅考虑了更具有实际应用意义的O/W型微乳液。从图5中可以看出无论是空白微乳液还是含有番茄红素微乳的微乳液在制备后前5 d内粒径稍有增加以后一直保持稳定。加入番茄红素后微乳液的粒径有所增加。原因是在加入番茄红素后在界面上需要更多的表面活性剂来增溶番茄红素因而粒径有所增加。实验结果表明纳米级番茄红素微乳液具有较好的稳定性。
2.5 体外释放度的考察
番茄红素微乳(Microemulsion,ME)、微乳稀释液(Diluted microemulsion,D-ME)与番茄红素对照液的体外释放度实验结果见图6。结果表明,在模拟肠液(pH为6.8,PBS)释放介质中,微乳和稀释微乳的释放速度和程度都明显大于对照液,稀释微乳处方的释放速度快于微乳原液。这可能是因为微乳制剂粒径较小更利于释放,而且释放的程度也更好。有研究指出药物的体外释放速率和程度在一定程度上可以反映药物在体内的生物利用度,番茄红素微乳的体外释放速度和程度明显大于对照液,6 h累积释放量达90%,说明番茄红素微乳在一定程度上可提高其生物利用度。原因是微乳可通过提高难溶性药物的溶解度、增加水溶性药物的稳定性、避免肝首关效应和改善吸收屏障的通透性等机制,促进药物的吸收,提高其生物利用度[13]。
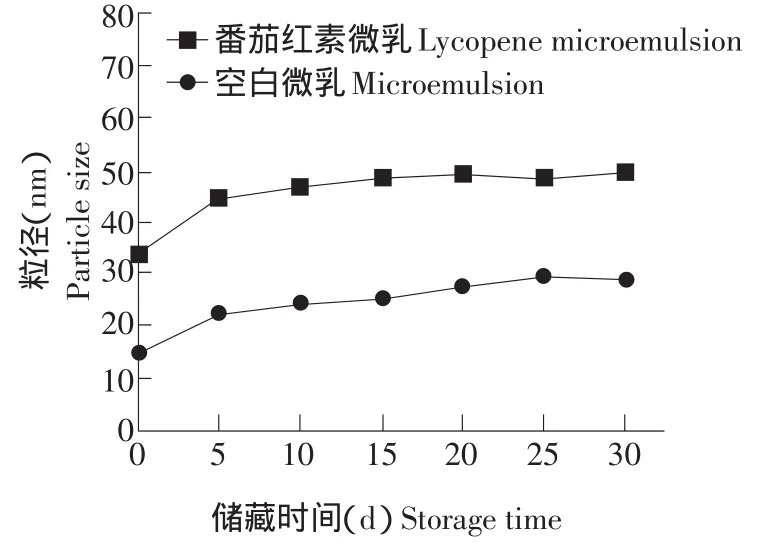
图5 微乳液体系粒径随储藏时间的变化曲线Fig.5 Variation of diameter of microemulsion vs.the storage

图6 番茄红素微乳原液、微乳稀释液和对照液在模拟肠液中的溶出曲线Fig.6 Dissolution profiles of lycopene from ME,D-ME,Solution in PBS
2.6 微乳液包埋率的测定及稳定性的考察
2.6.1 紫外分光光度法测定番茄红素的含量
2.6.1.1 标准曲线的绘制
在472 nm波长下,测定不同浓度番茄红素标准溶液的吸光值(OD),每个浓度平行测定3次。以吸光值为纵坐标,番茄红素浓度为横坐标绘制标准曲线。由此计算回归方程为:y=0.2845x-0.0161,r2=0.9998。
2.6.1.2 方法精密度、回收率实验
为验证测定番茄红素的方法的准确性需要考察测定方法的精密度和回收率,测定结果分别见表1、2。
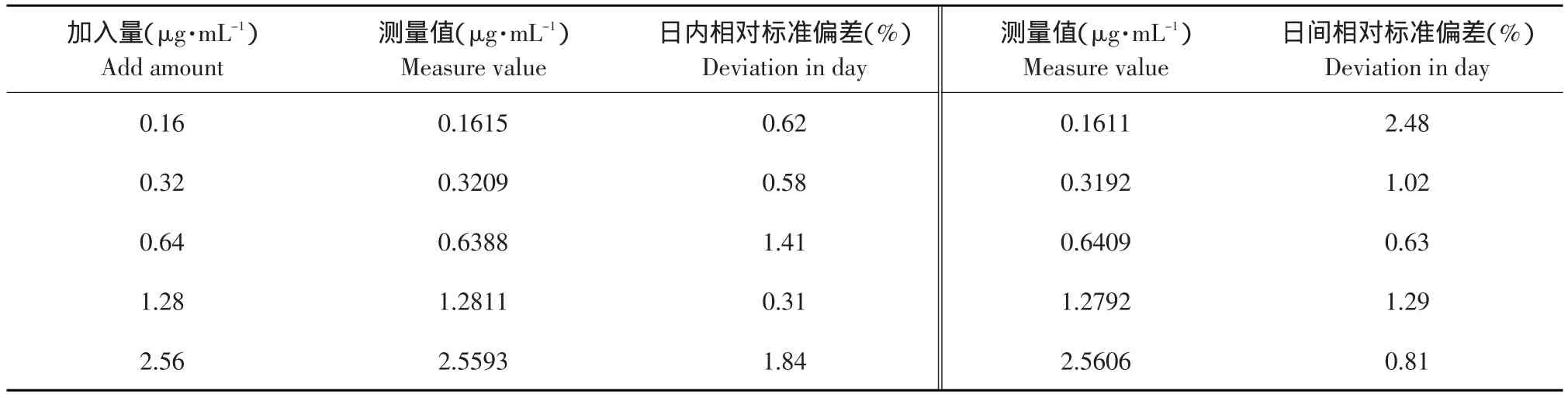
表1 番茄红素的精密度Table 1 Accuracy of lycopene(n=5)

表2 番茄红素的回收率Table 2 Recovery of lycopene(n=5)
从表1中可以看出,日内相对标准差≤2%,日间RSD≤3%,说明采用分光光度计法符合番茄红素测量方法的要求。从表2中可以看出,回收率良好,相对标准偏差RSD均≤2%,说明本试验建立测定番茄红素的方法的回收率符合要求。
2.6.2 番茄红素微乳液包封率及稳定性的考察
结果见表3。
实验中观察到,番茄红素微乳于4℃,25℃避光放置1个月未见分层、破乳现象;pH值无明显变化。在4℃和25℃下放置1个月包封率仍高达94%以上。说明番茄红素微乳液具有良好的稳定性,但实验中发现在25℃下微乳液的包封率稍有减小,因此该微乳液最好低温、避光、密封保存。

表3 番茄红素微乳的包封率及稳定性Table 3 Lycopene microemulsion entrapment efficiency and stability
3 讨论与结论
通过拟三元相图法筛选出最佳的微乳配方,得到稳定的食品级O/W型番茄红素微乳液。制备中发现将助表面活性剂与油进行复配作为混合油相与将表面活性剂与助表面活性剂进行复配作为混合表面活性剂相比,可获得相对较大的微乳液区域。Tween 80/乙醇/柠檬烯/水的微乳液制备简单,所得的微乳液平均粒径为(43±2.35)nm,包封率高达97%以上。番茄红素微乳的体外释放速度和程度明显大于对照液,6 h累积释放量达90%,可有效提高番茄红素的稳定性及生物利用度。试验中发现制备好的番茄红素微乳在25℃下避光长期储存,番茄红素的包封率稍有减小。因此该微乳液应低温、避光、密封保存。用该载体来包封番茄红素,不仅解决了番茄红素在应用中的水溶性差的问题,而且明显提高了番茄红素的稳定性。因此将其作为食品生产中的番茄红素载体具有广阔的应用前景。
[1]刘立国,吴晶.番茄红素及生产应用研究[J].食品工业科技,2002,23(4):74-75.
[2]Steven K.Clinton,M.Lycopene:Chemistry,Biology,and Implications for Human Health and Disease[J].Nutrition Reviews,1998,56(2):35-51.
[3]Mascio D.Lycopene as the most efficient biological carotenoid single oxygen quencher[J].Arch Biochem Biophys,1989,274:532-538.
[4]刘根新,张继瑜.O/W型药用微乳的制备及评价[J].中国农业科学,2009,42(9):3328-3333.
[5]颜秀花,王正武,王建磊,等.β-胡萝卜素微乳的制备及其稳定性研究[J],化学通报,2007,12(1):67-72.
[6]张连富,丁霄霖.番茄红素简便测定方法的建立[J].食品与发酵工业,2001,27(3):51-55.
[7]崔正刚,殷福珊.微乳化技术及应用[M].北京:中国轻工业出版社,1999:97-99.
[8]Radomska A,Dokruchi R.The use of the some ingredients for microemulsion preparation containing retinal and its esters[J].J Pharm,2000,196(2):131-134.
[9]陈菡.葛根素微乳的制备及生物利用度的研究[D].上海:第二军医大学,2008.
[10]颜秀花,王正武,刘汉文.O/W型微乳液对β-胡萝卜素增溶作用[J].食品科技,2010,35(2):42-46.
[11]陆琳.药物新剂型与新技术[M].北京:人民卫生出版社,2005.
[12]颜秀花,许伟,邵荣,等.共轭亚油酸的微乳及其性质研究[J].食品工业科技,2010,31(6):111-114.
[13]于巍,王春龙,赵广荣.微乳给药系统研究进展[J].医药导报,2006,25(11):1177-1179.

