鼠李糖乳杆菌(ATTC53103)高密度生产工艺研究
陈 成,韩建春
(1.黑龙江省轻工科学研究院,哈尔滨 150010;2.东北农业大学食品学院,哈尔滨 150030)
鼠李糖乳杆菌(ATTC 53103)属于乳杆菌(Lactobacillus)属、鼠李糖乳杆菌(L.rhamnosus)种,革兰氏阳性菌,无质粒;不能利用乳糖,但可代谢单糖。上世纪80年代,该菌株由两位美国科学家Sherwood Gorbach和Barry Goldin从健康人的肠道中分离而得,并命名为鼠李糖乳杆菌LGG(Lactobacillus rhamnosus GG)[1-4]。近年来,国外的科学家通过大量的动物实验和人体临床实验证明LGG能够耐受动物消化道环境,并能够在人和动物肠道内定殖,起到调节肠道菌群、预防和治疗腹泻、排除毒素、预防龋齿和提高机体免疫力等作用[5]。
高密度培养技术,也就是高密度发酵技术,由于不同菌株所能达到的最高菌体浓度相差较大,目前的文献中对高密度培养尚无确切定义。一般来说,高密度培养是指应用一定的培养技术或装置提高菌体的发酵密度,使菌体密度较分批培养有显著提高,最终提高特定产物的生产率。常用的高密度培养方法有分批补料培养、过滤培养和连续培养等。
本文就鼠李糖乳杆菌的特性对其高密度培养条件进行研究,通过制定高密度冻干菌粉最佳生产工艺参数,为实现大规模工业化生产浓缩型乳酸菌粉奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株
鼠李糖乳杆菌ATTC 53103(Lactobacillus rhamnosus ATTC 53103)。
1.1.2 培养基配方[12]
MRS培养基(液体):蛋白胨10 g,牛肉膏10 g,酵母粉5 g,葡萄糖20 g,磷酸氢二钾2 g,柠檬酸二胺2 g,乙酸钠5 g,MgSO4·7H2O 0.58 g,MnSO4·4H2O 0.25 g,吐温80 1 mL,蒸馏水1 000 mL,pH为6.3~6.5,115℃,15min灭菌。
MRS培养基(固体):在液体培养基中加入1%~2%琼脂,加热融化后,115℃,15min灭菌。
12%(W/W)脱脂乳:将13.6 g脱脂乳溶于100 mL蒸馏水中,115℃,15 min灭菌。
稀释液的配制:NaCl 0.85 g,胰蛋白胨0.15 g,蒸馏水100 mL,121℃灭菌20 min。
1.2 试验方法
1.2.1 基础培养基的优化
Nvazzaro等试验证明葡萄糖以及酵母粉对鼠李糖乳杆菌(ATTC 53103)有较好的增殖作用,他们培养出的最大活菌数达到2.2×109cfu·mL-1[4],Miller也给出类似结论[7]。固定12%的脱脂乳粉以及0.15%的吐温80用量,采用正交试验设计(L9(33))优化葡萄糖、蛋白水解物和酵母粉的用量,因素水平见表1。

表1 基础培养基优化正交试验因素水平(L(9 33))Table 1 Level of orthogonal design of basic culture (%)
1.2.2 培养方式对高密度发酵的影响
本试验利用500 mL盐水瓶和10 L发酵罐进行分批培养,通过研究发酵过程中菌体浓度与pH和发酵液内葡萄糖浓度的关系,确定抑制菌株进一步增殖的因素,并确定各因素对菌株的影响方式和极限值。在此基础上,通过对10 L发酵罐进行补料培养,调整罐内发酵液的pH与葡萄糖浓度,达到高密度培养的目的。
2 结果与分析
2.1 培养基优化结果
本试验以活菌数为指标,采用L9(33)对基础培养基进行优化结果见表2。极差分析和方差分析分别见表3与4。

表2 培养基优化的正交试验结果(L(9 33))Table 2 Results on orthogonal design of basic culture (%)
通过表3极差分析结果可以看出,影响培养基增菌效果的主次因素为:A>B>C,即葡萄糖浓度>酵母粉浓度>酪蛋白水解物浓度。从表4方差分析也可得到同样结论,A、B、C三个因素对鼠李糖乳杆菌(ATTC 53103)基础培养基菌数的影响达到显著水平,说明实验设计合理。从上述分析可知最佳组合为A3B3C3,葡萄糖浓度为10%、酵母粉浓度为1.0%、酪蛋白水解物浓度为2.0%。此组合不在试验设计中,因此需要做验证试验。按上面最佳条件A3B3C3,平行做3次试验,得菌数为6.28×108cfu·mL-1,高于正交试验中的最大活菌浓度6.22×108cfu·mL-1。因此较优的基础培养基条件为:葡萄糖浓度为10%、酵母粉浓度为1.0%、酪蛋白水解物浓度为2.0%。

表3 培养基优化的极差分析结果Table 3 Variance analysis

表4 方差分析Table 4 Anova analysis
由表4的方差分析可知,试验中所选用的三个因素中蔗糖和酵母粉对活菌数有显著影响,而酪蛋白水解物对活菌数影响相对较小。
2.2 高密度发酵培养活菌数与pH和葡萄糖浓度关系
2.2.1 盐水瓶分批培养发酵过程曲线
盐水瓶发酵过程曲线如图1所示。由图1中可以看出,培养2 h后发酵液的pH开始快速下降,4~14 h为菌体生长的对数生长期,菌体浓度增加迅速;由于生成的乳酸和乙酸在发酵液中积累,14 h菌体浓度达到最高值,为3.15×109cfu·mL-1,对应的发酵液pH降为4.6,葡萄糖浓度为6.2 g·L-1。进入稳定期后,由于酸度的升高以及营养物质的减少,活菌数浓度逐渐呈下降趋势,18 h活菌数为3.08×109cfu·mL-1。
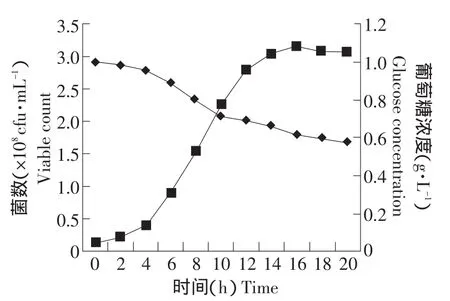
图1 盐水瓶分批培养发酵过程曲线Fig.1 Fermentation curve of bottle batch culture
2.2.2 发酵罐分批培养发酵过程曲线
发酵罐分批培养发酵过程曲线如图2所示。菌株在4 h后进入对数生长期,菌体开始快速利用培养基中的营养物质,发酵液的pH和葡萄糖浓度下降速度逐渐加快,12 h左右达到对数生长期末期,此时pH为4.4,葡萄糖浓度为5.7 g·L-1,最大活菌数为3.8×109cfu·mL-1。

图2 发酵罐分批培养发酵过程曲线Fig.2 Fermentation curve of fermenter batch culture
2.3 补料高密度培养发酵过程曲线的测定
张兰威的研究表明,发酵液酸度的上升以及营养物质浓度的下降是乳酸菌增殖停止及衰亡的主要原因[8]。在筛选增殖培养基的试验中已经证明葡萄糖浓度对鼠李糖乳杆菌(ATTC 53103)的增殖最为关键,如果发酵液的pH和葡萄糖浓度能在菌株增殖过程中保持稳定,那么菌株达到对数生长期末期的时间将得到延长,最大活菌数也会相应提高。因此可以通过流加碱液及补加葡萄糖的方式实现高密度培养的目的。
2.3.1 补料培养pH及葡萄糖浓度的确定
发酵罐分批培养实验数据表明,对数生长期末期发酵液的pH为4.4,此后菌株进入稳定期及衰亡期。这就意味着低于4.4的pH有可能会抑制菌株继续增殖,我们选择将发酵液的pH分别保持5.0、6.0和7.0,测定发酵液达到最大活菌数时间和达到最大活菌数时的葡萄糖浓度,如表5所示。

表5 发酵罐保持不同pH菌株生长情况比较Table 5 Compare of growth curve at different pH
将发酵液pH保持在6.0时,鼠李糖乳杆菌(ATTC 53103)在增殖培养基中达到最大活菌数为2.9×1010cfu·mL-1,远远高于分批培养的最大活菌数(发酵罐分批培养的最大活菌数是3.8×109cfu·mL-1),证明此pH有利于鼠李糖乳杆菌的增殖,此时活菌浓度不能继续增加的原因应该是培养基中营养物质浓度的下降。
在保持pH 6.0的发酵试验中,达到最大活菌数时葡萄糖浓度为1.9 g·L-1,此时的葡萄糖浓度有可能成为菌株增殖的抑制因素。保持发酵液的pH 6.0,分别在发酵液的糖浓度降至2、4、6、8 g·L-1时补加葡萄糖,使发酵液的葡萄糖浓度分别保持在2~4、4~6、6~8和8~10 g·L-1的范围内,并在这个过程中测定最大活菌数,如图3所示:在糖浓度降至2 g·L-1后补糖,最大活菌数为3.18×1010,糖浓度降至4、6、8 g·L-1后补糖,最大活菌数结果差异不大,均为3.7×1010左右。因此,选择补糖的最低糖浓度是4 g·L-1。

图3 不同糖浓度的最大活菌数比较Fig.3 Compare of the max viable account at different glucose concentration
2.3.2 高密度培养补料方法的确定
发酵罐的pH探头能够实时监测发酵液的pH变化,因此采取恒流补碱的方法,滴加15%的NaOH溶液,使发酵液的pH保持在6.0±0.1。
葡萄糖的补加应根据实际发酵情况而定,当葡萄糖浓度降至4g·L-1时开始第1次补糖,初次应补充10%的灭菌葡萄糖170mL,使糖浓度升至6g·L-1。当葡萄糖浓度降至4 g·L-1左右时重复补加葡萄糖,整个过程保持葡萄糖浓度在4~6 g·L-1范围内。
2.3.3 补料高密度培养的生长曲线
根据发酵罐分批培养的发酵特点,通过控制发酵液的最低葡萄糖浓度,恒定发酵液的pH,达到增加最大活菌数的目的。以培养时间为横轴,测定的活菌浓度为纵轴绘制曲线,即为鼠李糖乳杆菌(ATTC53103)补料高密度培养的生长曲线,如图4所示。
0~6 h为菌体生长的延滞期,6~20 h为菌体的对数生长期,20~30 h为菌体的稳定期,与发酵罐分批培养相比,菌体对数生长期延长约4 h,最大活菌数提高近10倍。
2.3.4 补料高密度培养葡萄糖曲线
分别以培养时间和测定的葡萄糖浓度作为横纵轴绘制曲线,即为鼠李糖乳杆菌(ATTC 53103)补料高密度培养葡萄糖浓度曲线。如图5所示。
发酵液中的葡萄糖初始浓度为l%,葡萄糖浓度在前4 h后变化缓慢,4~12 h内的葡萄糖浓度下降加速,12 h后葡萄糖浓度降至3.9 g·L-1。此时第一次向罐内补加葡萄糖,6~24 h为菌体加速消耗葡萄糖阶段,期间共补充葡萄糖7次。
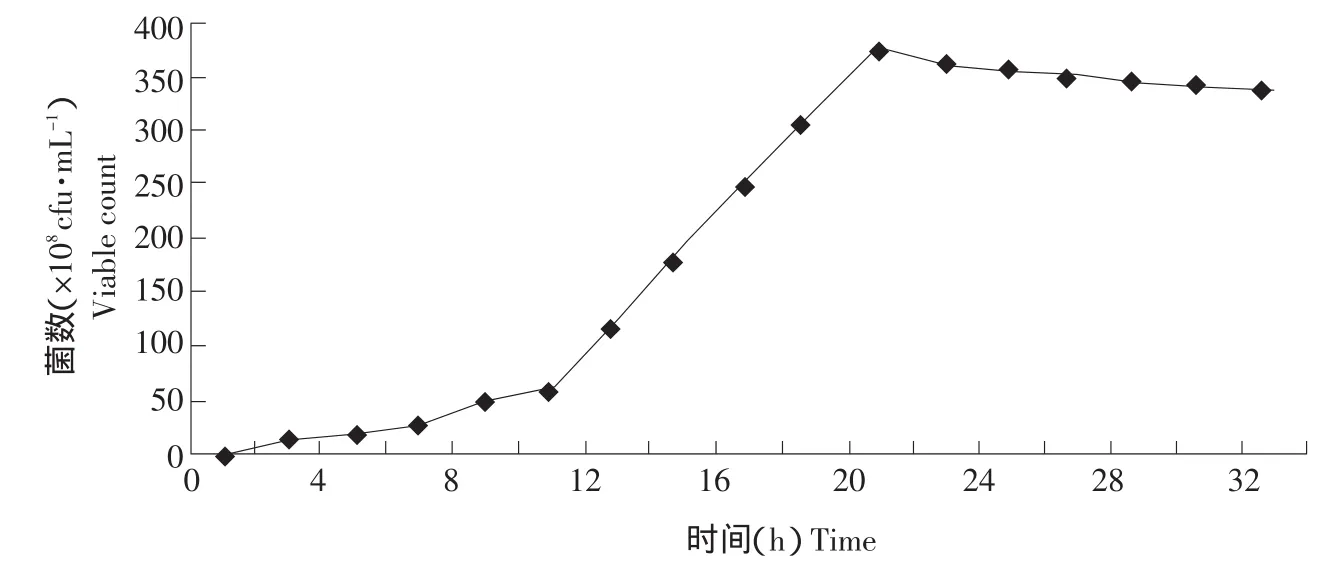
图4 补料高密度培养生长曲线Fig.4 Growth curve of fed-batch high-density culture

图5 补料高密度培养葡萄糖浓度曲线Fig.5 Glucose curve of fed-batch high density culture
3 讨论
世界范围内,就益生菌研发的专业化及系统性而言,日本和法国处于领先地位,且这两个国家的益生菌产品市场尤为活跃。早在20世纪30年代,日本京都帝国大学的代田稔教授就已成功分离出来源于人体肠道的乳酸杆菌,该株菌经过强化培养后能定殖于人体肠道内。这种后来被人们称为养乐多菌的乳酸杆菌已被广泛使用在日本的食品、饮品、医学等领域,其中在乳制品上的运用成果显著。据国外有关公司调查;日本在2000年利用益生菌生产的乳制品,其总产值就已达22亿美元。而今的养乐多在日本已家喻户晓,日本人利用养乐多菌制作的活性发酵乳饮料成功打入国际市场,目前该产品已进入13个国家,全球每天至少2 500万人在饮用这种产品。法国在益生菌方面的研究不亚于日本,目前该国已拥有一支庞大而专业化的益生菌科研队伍,每年研究开发经费高达数亿欧元。法国人对益生菌非常认同,益生菌产品市场也很发达。一种不依赖于药物的益生菌保健法,其源头就在法国。益生菌在我国的研究与利用起步较迟,在基础研究和开发利用方面,与发达国家都存在一定的差距,20世纪的中后期大部分学者中断了对益生菌的研究。因此,这一时期我国关于益生菌方面的研究论文或科研成果寥寥无几。进入21世纪后状况有所改观,益生菌的研究已开始复苏,益生菌的应用也受到了重视。例如广东省食品学会、广东微生物学会等机构此前曾经举办过两届益生菌研讨会;有关奶业协会在黑龙江也召开过乳酸菌专题高层论坛;上海奶业界亦曾邀请美国等国的乳酸菌专家云集上海召开了国际性的乳酸菌研讨交流会。国内由中国食品学会牵头,知名乳品配料企业丹尼斯克、大型乳品生产企业伊利等参与成立了乳酸菌协会。另外,在国内也相继涌现出哈尔滨美华、北京弗蒙特以及上海润盈等面向工业客户专业生产微生态产品的企业。2000年我国已有9类获得卫生部批准的国家一类活菌制剂,即口服双歧杆菌活菌制剂(回春生、丽肠乐)、口服双歧杆菌三联活菌制剂(培菲康)、口服地衣芽孢杆菌活菌制剂(整肠生)及金双歧等等。
鼠李糖乳杆菌(ATTC 53103)属于乳杆菌(Lactobacillus)属、鼠李糖乳杆菌(L.rhamnosus)种,革兰氏阳性菌,无质粒;不能利用乳糖,但可代谢单糖。该菌株在LBS番茄汁琼脂和MRS琼脂培养基中生长呈现特定的形态学特征:大的奶油白色不透明菌落,且散发奶油味道。鼠李糖乳杆菌(ATTC 53103)是目前世界上研究最为深入,应用最为广泛的益生菌之一,在芬兰,美国,澳大利亚,日本等全球30多个国家及地区有上百种含有该菌株的产品销售,主要为发酵乳制品及胶囊保健品,该菌株耐酸性良好,在肠道定殖能力强。高密度培养技术(High cell-density culture),也就是高密度发酵技术,由于不同菌株所能达到的最高菌体浓度相差较大,一般来说,高密度培养是指应用一定的培养技术或装置提高菌体的发酵密度,使菌体密度较分批培养有显著的提高,最终提高特定产物的比生产率。常用的高密度培养方法有分批补料培养、过滤培养和连续培养等。在分批培养条件下菌株数量和产物在经过一段培养时期后达到不再增加的稳定状态,主要原因是可利用底物的耗尽和抑制物的积累。如果能去除这两方面对微生物生长的限制,微生物细胞将有可能达到更高密度。当可利用底物的耗尽是细胞不再增殖的主要原因时,利用重复加入底物的方法可以提高生物量;如果是抑制物的积累引起细胞停止增长,底物不能被完全利用,单纯加入底物就不再能解决问题,需要利用某种方法去除抑制物才能使细胞浓度进一步增加。对人体有着丰富而显著的功能特性。该菌株具有耐胃酸、耐胆汁、可定植于人体肠道、产品保质期内活菌数量能够保持相对恒定等特点。很多乳制品及保健品企业对该菌株表现了浓厚的兴趣,因此工业化生产出高密度的鼠李糖乳杆菌(ATTC 53103)冻干粉存在较大的经济价值及社会效益。
4 结论
通过单因素及正交试验筛选出高密度增殖培养基,主要成分如下:脱脂奶粉12%、葡萄糖10%、平菇汁8%、啤酒8%、番茄汁5%、酪蛋白水解物2%、酵母粉1%、吐温80为0.15%。采用此增殖培养基,最大活菌浓度可达3.02×109cfu·mL-1;鼠李糖乳杆菌(ATTC 53103)10 L自动发酵罐补料高密度培养条件为:葡萄糖浓度低于4 g·L-1时补加葡萄糖,使罐内葡萄糖浓度稳定在4~6 g·L-1之间。在此条件下发酵20 h,最大活菌数可达到3.75×1010cfu·mL-1,而发酵罐分批培养最大活菌浓度仅为3.8×109cfu·mL-1,前者比后者提高近10倍。
[1]牛爱地,韩建春.一株从酸菜中分离的产细菌素乳杆菌的鉴定及其所产抑菌物质的研究[J].东北农业大学学报,2009,40(10):104-108.
[2]Rattanachaikunsopon P,Phumkhachorm P.Isolation and preliminary characterization of a bacteriocin produced by Lactobacillus plantarum No.14 isolated from nham,a traditional Thai fermentedpork[J].Journal of Food Protection,2006,69:1938-1940.
[3]吴光伟,韩建春.鼠李糖乳杆菌(ATTC 53103)产细菌素的研究[J].东北农业大学学报,2009,40(8):81-85.
[4]Nieto-Lozano J C,Reguera-Useros J I,Peláez-Martínez M C,et al.Effect of a bacteriocin produced by Pediococcus acidilacticiagainst Listeria monocytogenes and Clostridium perfringens on Spanish raw meat[J].Meat Science,2006,72:58-60.
[5]安颖,王世宾.益生菌LGG的功效及在乳品中的应用[J].食品科技,2006(7):23-25.
[6]刘慧,李铁静.新编食品微生物学实验指导[M].哈尔滨:东北农业大学,2000.
[7]Nvazzaro F,Coppola R.Marotta M.et al.Effect of added carbohydrates on survival of some dried lactic acid bacteria[J].Bioprocess Engineering,1999(5):25-26.
[8]张兰威.乳酸菌优良菌株的选育及直投式酸奶发酵剂的研制[D].哈尔滨:东北农业大学,2002:17-29.
[9]郭本恒.益生菌[M].北京:化学工业出版社,2004:245-278.

