水稻中cry1Ah1基因密码子优化方案的比较
周宗梁,林智敏,耿丽丽,苏军,束长龙,王锋,朱延明,张杰
1 东北农业大学生命科学学院,黑龙江 哈尔滨 150030
2 中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193
3 福建省农业科学院农业遗传工程重点实验室,福建 福州 350003
自1996年美国孟山都公司成功商业化种植抗虫棉以来,转基因作物商业化已经16年,至2011年年底,全球转基因作物种植面积达到1.67亿公顷[1]。国内外转Bt基因抗虫水稻在研发方面已经取得较大突破[2-4],其中我国政府于2009年批准了转基因抗虫水稻商业化应用生物安全证书,预示着转 Bt基因水稻等重要农作物在未来农业生产中将发挥重要的作用。
1987年,Vaeck等在研究转Bt基因烟草时发现野生型全长cry1A (b) 基因转化烟草后不表达,而改造后的基因在植株中却具有一定的杀虫活性[5]。究其根本原因是原核生物与真核生物基因存在很大的差别,例如:A/T (G/C) 含量和密码子的使用频率的差异,并且原核生物不具有真核生物基因中的5¢非翻译区序列和3¢末端识别信号序列[6-7],使很多来源于原核生物的基因在真核生物中直接表达时效率不高[8]。Wilbur等发现了细菌与高等植物在密码子的使用方面的差异[9],Tohru Hayakawa等对cry4Aa基因改造时发现密码子偏好性是影响基因表达的重要原因[10]。同时发现生物体对同义密码子的选择不仅在基因表达水平方面发挥重要调节作用,而且有利于提高翻译的准确性和效率[11-13]。
随后人们发现影响外源基因表达水平的因素还有表达系统 (启动子强度、载体性质、RNA二级结构)、外源基因结构 (终止密码子)、表达条件等[14]。因此人们在对编码区进行密码子优化的同时,提高基因的G+C含量[15],改造造成表达量过低的一些不稳定元件 (Instability elements),包括类似植物内含子的 A+T富含区[16]、潜在的植物 polyA 序列 (Polyadenylylationsignal sequences)[17]、对mRNA不稳定有影响的ATTTA序列[15]以及植物少用或罕见的密码子等,都是基因优化改造的必要内容。Koziel等在改造cry1Ab基因时,将GC含量由38%提高到65%,去除不稳定元件后转化玉米,发现 Bt蛋白最高表达量占总可溶性蛋白的4%[18]。Perlak等改造cry1A (b) 和cry1A (c) 基因转化番茄,发现改造后Bt杀虫蛋白表达量提高10~100倍,最高表达量占总可溶性蛋白的 0.3%[19]。但目前对外源基因密码子进行系统优化、分析比较研究在国内未见正式报道。
具有我国自主知识产权的新型Bt杀虫基因-cry1Ah1[20],其编码的 Cry1Ah蛋白对棉铃虫Helicoverpa armigera、亚洲玉米螟 Ostrinia furnacalis和水稻二化螟Chilo suppressalis等多种鳞翅目害虫具有很高的毒杀活性,超过目前商业化的cry1Ab、cry1Ac等基因,并明确了该基因的杀虫活性区域在第28~640个氨基酸[21]。这将成为我国新一代抗虫转基因作物创制的重要保证。本研究根据水稻偏爱密码子对cry1Ah1基因进行了5种不同优化,通过比较转基因水稻的转录和翻译水平的差异,分析了不同优化方案对基因表达的影响,获得了最佳的优化方案,此研究将为其他 Bt基因的优化和转基因植物的研究提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
本文所用的菌株和质粒见表1。
1.1.2 材料和试剂
T4 DNA连接酶、限制性内切酶、Ex Taq酶、M-MLV RTase cDNA Synthesis Kit反转录试剂盒购自大连宝生物工程有限公司。RNAprep pure Plant Kit植物总 RNA 提取纯化试剂盒、RealMasterMix购自天根公司。BCA Protein Assay Kit可溶性总蛋白定量试剂盒、包被液等ELISA所有试剂购自康为公司。Cry1Ah抗体由本实验室制备。
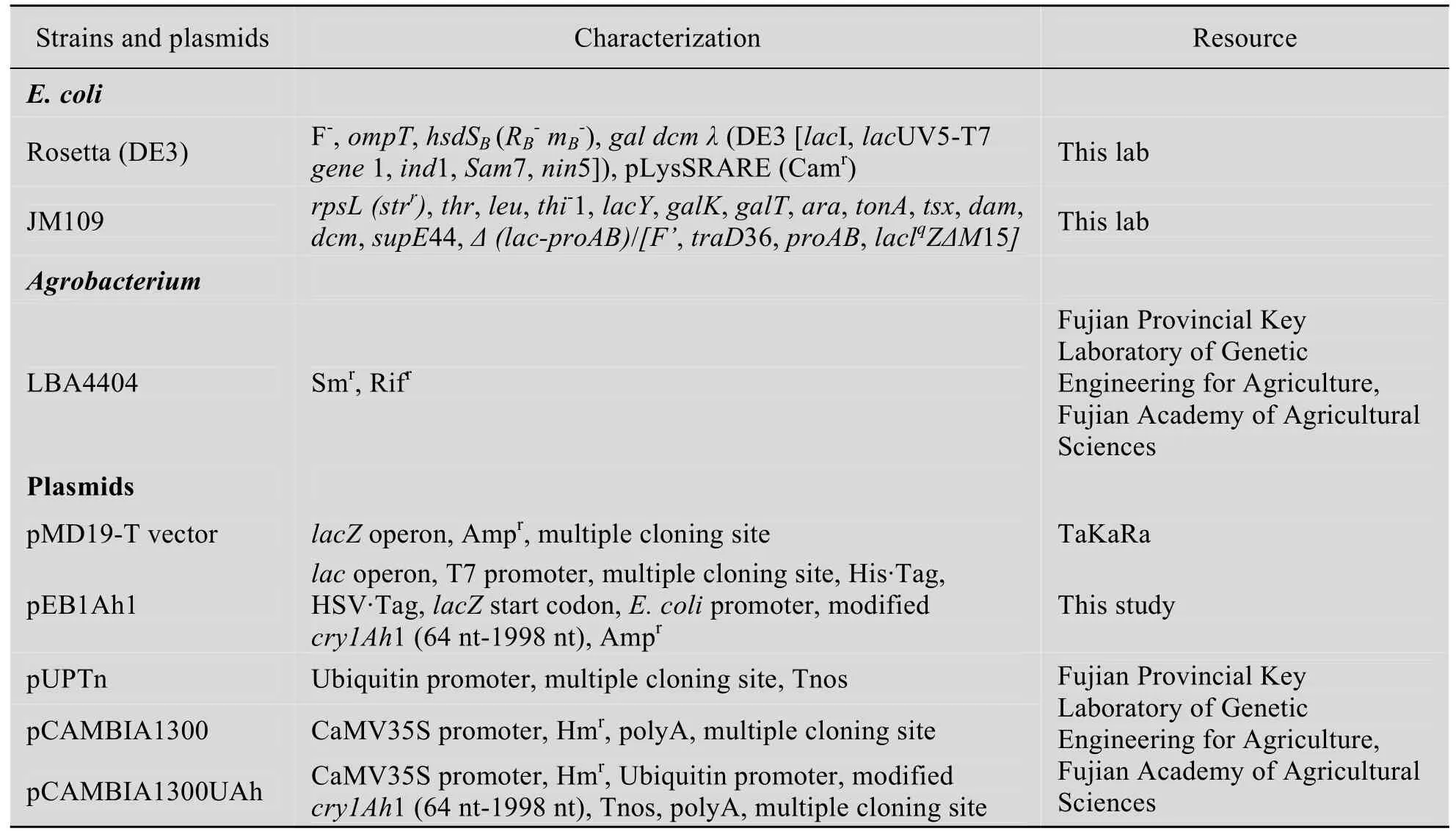
表1 菌株与质粒Table 1 Strains and plasmids
水稻日本晴Var Nippobare由福建省农业科学院农业遗传遗传工程重点实验室提供。
小菜蛾Plutella xylostella由中国农业科学院植物保护研究所生物技术组提供。水稻二化螟Chilo suppressalis由中国农业科学院植物保护研究所水稻害虫研究组提供。
1.1.3 主要仪器和设备
荧光定量PCR仪购自Bio-Rad公司。多功能酶标仪购自美国Poten公司。核酸蛋白分析仪购自美国Berkam公司。
1.2 方法
1.2.1 cry1Ah1基因的密码子优化
根据 CUTG (Codon Usage Tabulated from GenBank) (http://www.kazusa.or.jp/codon/) 中水稻密码子使用频率表对 cry1Ah1基因编码区(64~1998 nt) 杀虫关键区域[21],在不改变原有645个氨基酸序列前提下进行密码子优化,同时综合真核生物中影响基因转录、翻译及 mRNA稳定性等因素,去除编码区中的剪切信号以及常用的限制性酶切位点,起始密码子前加入Ω序列[22]和 Kozak序列[23],在双终止子 (TGATGA)前加入KDEL序列[24],经RNA二级结构分析,改掉存在二级结构臂或环上的错配碱基,去掉连续9个以上配对的二级结构臂。优化的基因由南京金斯瑞公司合成。
1.2.2 原核表达载体的构建
将合成的优化后基因1 959 bp连接至pEB载体构建pEB1Ah1质粒,经测序鉴定后转化大肠杆菌Rosetta (DE3) 菌株[25]。
1.2.3 改造后基因的原核表达
表达菌株在IPTG终浓度为1 mmol/L,30 ℃、150 r/min的条件下诱导16 h[25],SDS-PAGE分析可溶性与非可溶性蛋白,利用 MaBiophotonics Image J软件对目的蛋白定量。
1.2.4 杀虫活性测定
称取3 g小菜蛾人工饲料 (本实验室制备),将目的蛋白稀释成5、50 μg/mL的浓度梯度拌入饲料,每个样品梯度3个重复,每个重复接30头2龄敏感种群小菜蛾幼虫,置于25 ℃恒温培养箱中,光照条件为12∶12 (L/D),48 h后检查活虫数。
称取 10 g水稻二化螟人工饲料 (中国农业科学院水稻害虫组提供),将目的蛋白稀释成5、50 μg/mL的浓度梯度拌入饲料,每个样品梯度3个重复,每个重复接30头初孵敏感种群水稻二化螟幼虫,置于25℃恒温培养箱中 (保持黑暗),7 d后检查活虫数。
1.2.5 水稻遗传转化
水稻日本晴Var Nippobare的遗传转化由福建省农业科学院农业遗传工程重点实验室完成。采用 Ubiquitin[26-27]为启动子的表达载体和农杆菌介导转化方法。五种方案优化的基因采用同样的启动子、载体和转化方法 (图1)。
1.2.6 PCR检测
以 CTAB法[26]提取的水稻叶片基因组为模板,以非转基因日本晴为阴性对照,利用表2引物对水稻抗性苗进行目的基因和潮霉素抗性基因检测。
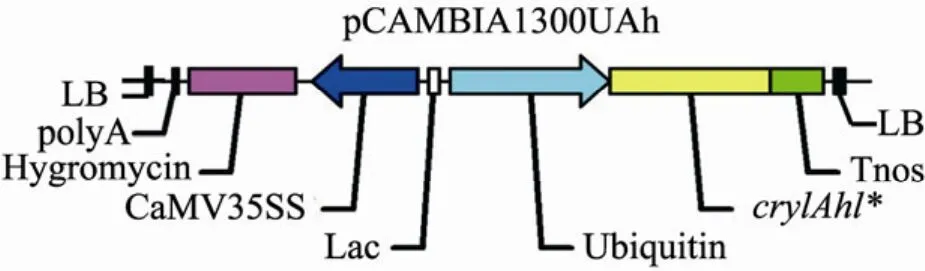
图1 植物表达载体pCAMBIA1300UAh示意图Fig. 1 Construction of vector pCAMBIA1300Ah.
所有引物由上海生工生物工程有限公司合成。
1.2.7 实时荧光定量RT-PCR检测
提取水稻叶片总RNA (步骤见植物总RNA提取纯化试剂盒说明书),反转录合成 cDNA第一链 (步骤见反转录试剂盒说明书)。利用表 3引物对采用四步法[28]以含内参基因 actin (GenBank Accession No. NM_197297) 和优化后基因重组质粒为标准品进行反应,内参基因扩增反应条件:95 2 min℃ ;94 ℃ 15 s,54 ℃ 15 s,68 ℃ 20 s,80 ℃ 6 s,plate read 40个循环,目的基因扩增反应条件:95 2 min℃ ;94 ℃ 15 s,58 ℃15 s,68 ℃ 20 s;82 ℃ 6 s,plate read 40个循环。用IQ5软件读取数据。

表2 引物Table 2 The primers and their names

表3 引物Table 3 The primers and their names
1.2.8 BCA法测定可溶蛋白含量和ELISA间接法测定Cry1Ah蛋白含量
测定可溶性总蛋白浓度 (步骤见 BCA Protein Assay Kit试剂盒说明书),建立可溶性总蛋白标准曲线,计算各样品中可溶性总蛋白浓度。采用ELISA间接法[26]测定Cry1Ah1标准品及待测样品在450 nm处的吸光值,建立目的蛋白的标准曲线,计算各样品中目的蛋白的浓度。
2 结果与分析
2.1 cry1Ah1基因的密码子优化和分析
五种方案 (方案一:将密码子全部替换为每个氨基酸中的最高频密码子;方案二:只将稀有密码子转变为最高频密码子;方案三:按照密码子频率使用表中各密码子使用频率优化;方案四:将序列中的密码子换为中等频率的密码子;方案五:使用每个氨基酸最高频的两种密码子)优化后基因的GC含量提高到45.5%以上,同源性为 70.59%以上且更倾向于使用植物偏爱的密码子。方案一优化后的基因除个别剪切位点外全部采用最高频率密码子,GC含量最高,RNA二级结构最稳定,与原序列的碱基相似性最小(表4)。
2.2 改造后基因的原核表达分析
SDS-PAGE分析结果显示,非可溶组分中含有目的蛋白与预期大小相同,65 kDa条带,与阳性对照一致。而在可溶性组分中没有该目的条带。表明改造后的基因能在大肠杆菌 Rosetta (DE3) 中正常表达 (图2)。
2.3 生物活性测定
五种方案优化后表达的目的蛋白浓度分别为0.60、0.90、0.360、0.30、0.48 μg/μL,野生型阳性对照为3.36 μg/μL。对小菜蛾生物活性测定结果表明,目的蛋白浓度为50 μg/mL时校正死亡率为100%,阴性对照死亡率为10%;五种方案目的蛋白浓度在5 μg/mL下校正死亡率分别为37%、37%、40%、41%、33%,野生型阳性对照的校正死亡率为52%,表明5种优化后蛋白小菜蛾都具有一定的杀虫活性。对水稻二化螟生物活性测定结果表明,5种方案目的蛋白浓度为50 μg/mL下死亡率为校正100%,阴性对照的死亡率为3%,5种方案蛋白在5 μg/mL浓度下的校正死亡率分别为22%、21%、27%、26%、24%,野生型阳性对照的校正死亡率为32%,表明5种优化后蛋白对水稻二化螟具有一定的杀虫活性。生测结果说明由于基因优化没有改变氨基酸的序列,不同优化的基因对靶标害虫杀虫活性没有显著影响。
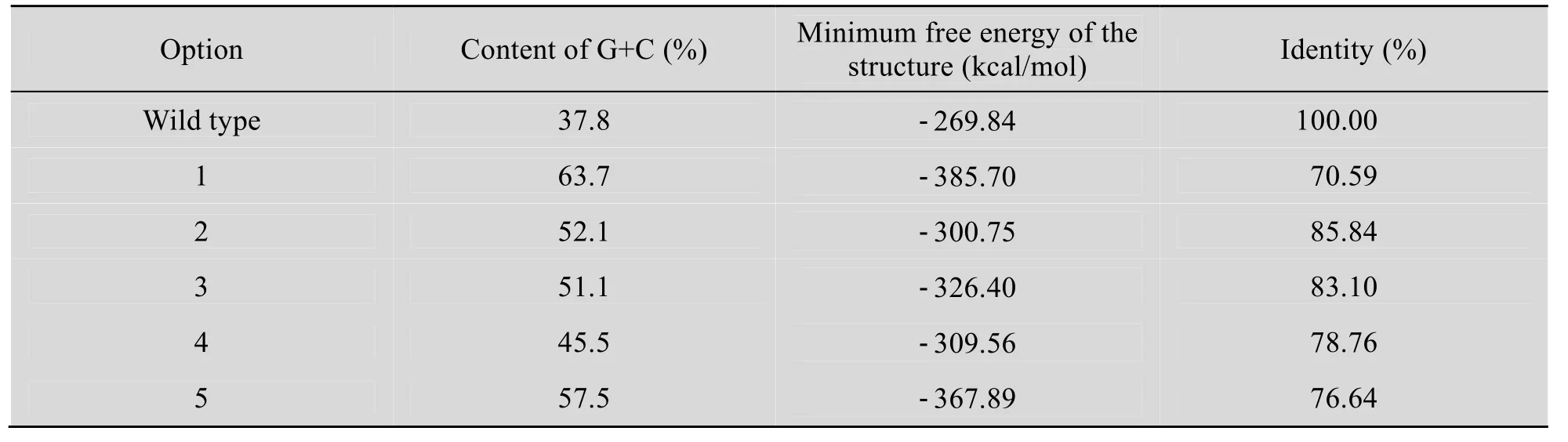
表4 cry1Ah1基因优化前后物理参数的比较Table 4 Comparison of parameters of modified cry1Ah1 gene with wild type gene.
2.4 转基因水稻PCR鉴定
五种方案样品PCR检测抗性苗分别为25、35、29、39、28株。图3为方案一样品进行PCR检测,阴性对照和空白对照均没有条带,样品扩增得到与阳性对照相同大小的目的基因 497 bp和潮霉素基因 225 bp的条带,PCR阳性率为88%,其他4
种方案阳性率分别为94%、93%、87%、93%。表明各方案 PCR阳性率较高,转化效率较高。
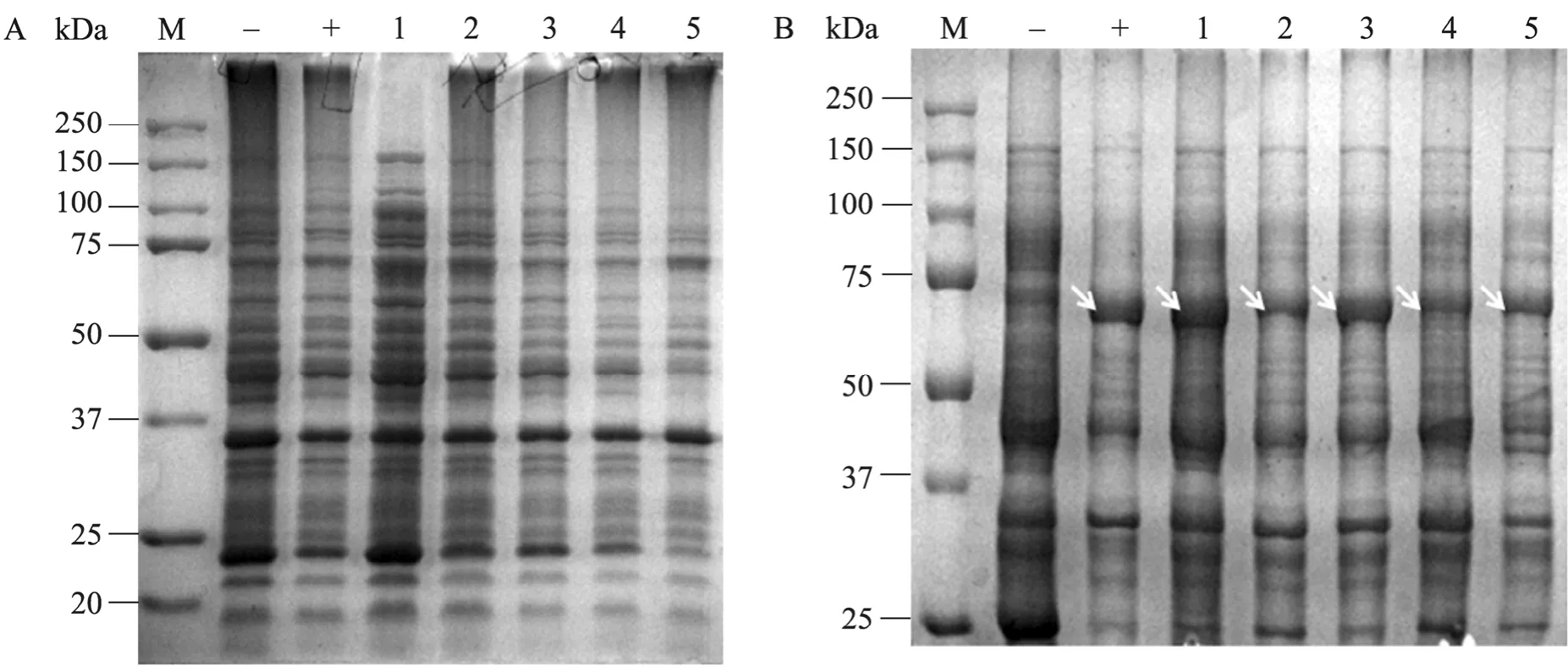
图2 表达蛋白可溶组分 (A) 和非可溶组分 (B) 的SDS-PAGE分析Fig. 2 SDS-PAGE of soluble and insoluble part. (A) M: protein marker; -: soluble part of pEB; +: soluble part of wild type; 1−5: soluble part of five program. (B) M: protein marker; -: insoluble part of pEB; +: insoluble part of wild type; 1−5: insoluble part of five program.
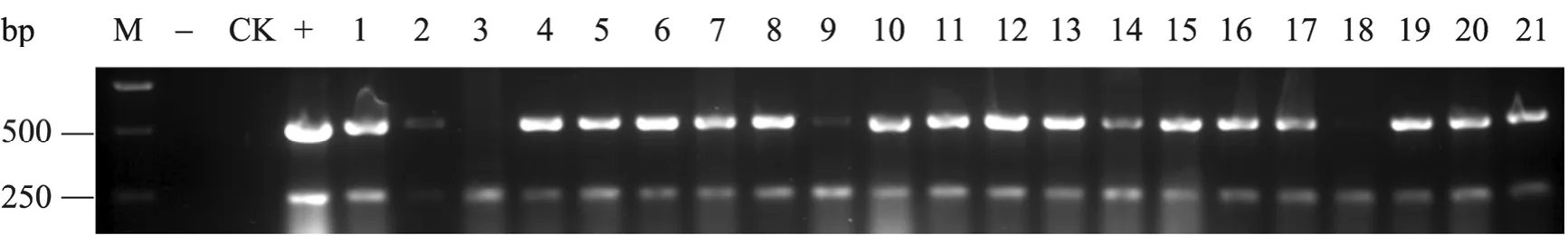
图3 水稻基因组的PCR鉴定Fig. 3 Identification of rice genomic DNA by PCR. M: DNA marker; -: blank; CK: control; +: positive control; 1−21: sample.
2.5 SYBR green Ⅰ实时荧光定量 RT-PCR鉴定分析
内参基因和目的基因的模板起始浓度的对数与模板CT值存在线性关系。图4为方案一的内参和目的基因标准曲线。内参基因的起始模板浓度的对数与CT值的相关系数为0.995>r0.01=0.9172,达到了极显著水平。目的基因的起始模板浓度的对数与CT值相关系数为0.993>r0.01=0.9587,达到了极显著水平。根据回归方程计算出各方案目的基因/内参基因即相对转录水平。
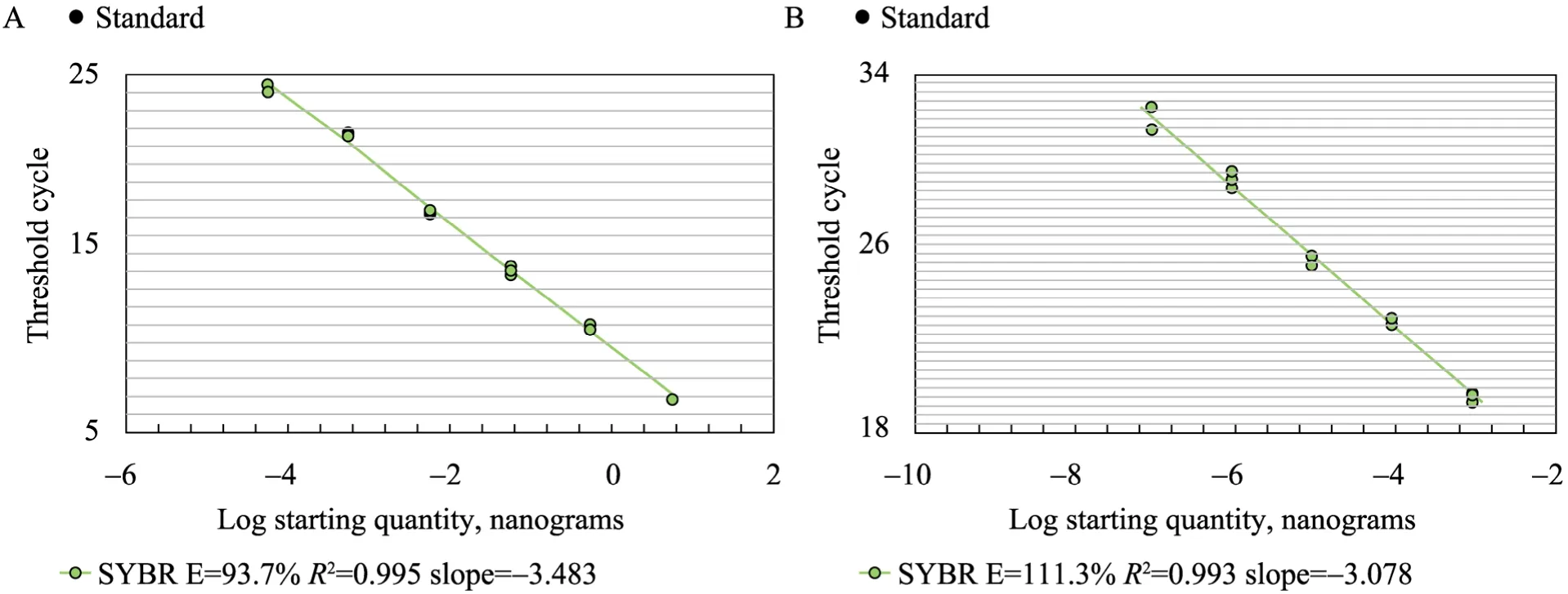
图4 内参基因 (A) 和目的基因 (B) 标准曲线Fig. 4 Standard curve of actin (A) and target gene (B) between CT value and templates.
各方案中样品的相对转录水平的平均值和标准差如图5所示,其中方案一全部采用最优密码子的优化方案的平均相对转录水平高于其他方案,平均值为 0.273,方案三按照各密码子频率使用密码子的优化方案次之,平均值为 0.103 (图5)。
2.6 ELISA间接法检测目的蛋白的相对含量
如图6所示,光密度值与蛋白浓度存在线性关系。可溶性蛋白 BSA标准品含量与相应的OD562值的相关系数为0.9999>r0.01=0.87453,达到了极显著水平。Cry1Ah1标准品含量与相应的OD450值的相关系数为0.9383>r0.01=0.87453,达到了极显著水平。计算得出目的蛋白/可溶性总蛋白即相对蛋白含量 (%)。
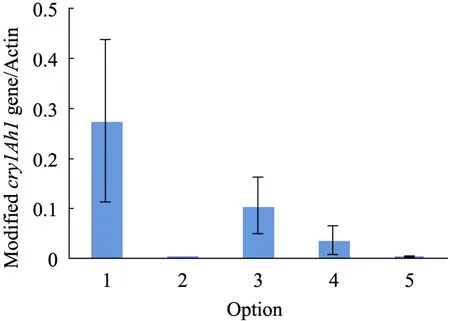
图5 改造后基因的相对转录水平Fig. 5 Relative transcript level of modified genes.
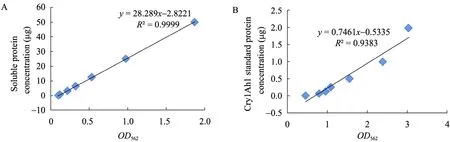
图6 可溶性总蛋白 (A) 和目的蛋白 (B) 标准曲线Fig. 6 Standard curve of soluble protein (A) and target protein (B) between OD and protein concentration.
全部采用最优密码子的优化方案相对蛋白含量优于其他方案,平均相对蛋白含量为0.104%,而方案三次之,平均相对蛋白含量为0.091%,各方案样品间相对蛋白含量较稳定(图7)。
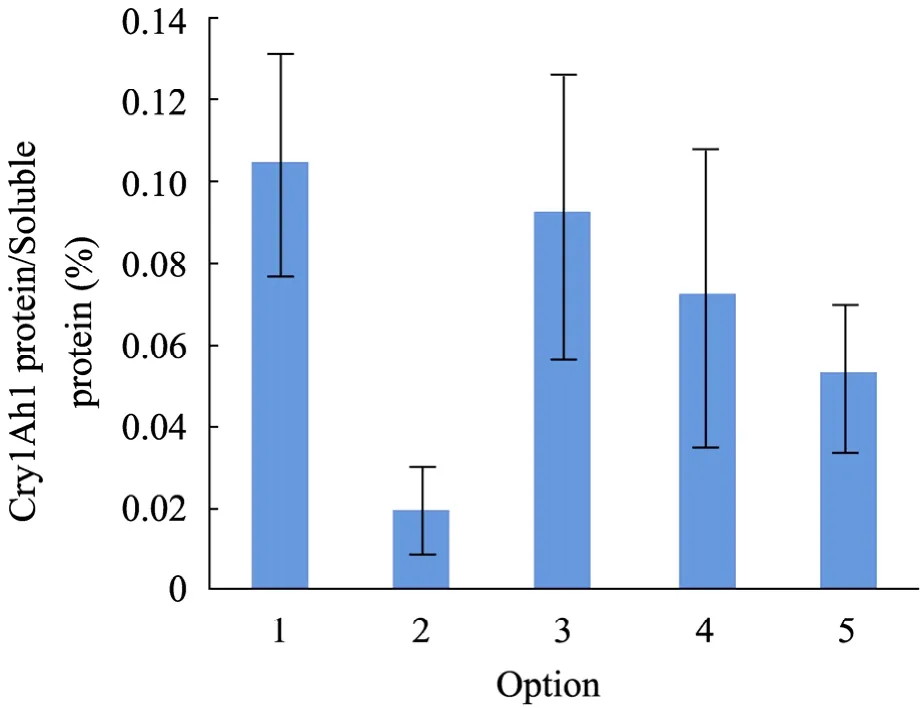
图7 Cry1Ah1蛋白的平均相对蛋白含量Fig. 7 Relative protein content of Cry1Ah1.
3 讨论
本研究根据水稻氨基酸密码子的使用频率对cry1Ah1基因杀虫关键区域进行5种不同的优化,提高GC含量,去除内含子剪切信号等不稳定因素,并加以必要的修饰,转化水稻日本晴后分子检测得出全部采用最高频率的密码子优化方案效果最好,在转录和翻译水平上比较了不同优化方案之间的差别,并获得最佳优化方案,为 Bt等原核生物基因优化和高效表达提供借鉴。为Bt抗虫转基因植物的研究奠定了坚实的基础。
在转录和翻译水平分析外源基因表达时,往往容易出现个别样品在转录和翻译水平不一致的问题[29],本实验中个别样品也有此现象产生,分析原因可能是Real-time PCR的灵敏度要远高于ELISA,所以个别样品的转录水平上的差距可能加大。同时密码子只是决定基因表达水平高低的因素之一。翻译起始区二级结构也会对基因的表达造成影响,本研究将各优化基因的-4~+37翻译起始区[30]的二级结构自由能降到最低,分别为-3.23、-2.50、-1.44、-2.03、-3.23 kcal/mol,且没有明显差异,以排除翻译起始区RNA二级结构自由能的较大差异对基因表达造成影响。此外Murray等发现在研究特异的密码子偏性时,并不是所有的高表达基因 (如编码核糖体蛋白和组蛋白的基因) 都有显著的密码子偏性[31],说明真核生物中密码子的偏性并不是由翻译效率决定的,而可能是和基因组中的isochore结构及含CG二核苷酸的密码子使用有关。这些还有待今后进一步实验进行证实。本研究从转录和翻译等分子水平分析比较了各个优化方案的差异,但是,由于转基因植物耗时长,工作量巨大,尚未积累足够的转基因水稻进行温室和田间抗虫实验,这项工作也将在近期开展,完成后续的相关评价实验。
[1] Clive J. Global Status of Commercialized Biotech/ GM Crops. Ithaca: ISAAA, 2012, Brief No. 44.
[2] Cohen MB, Gould F, Bentur JS. Bt rice: practical steps to sustainable use. International Rice Research Notes, 2000, 25(2): 4–10.
[3] Ye GY, Shu QY, Yao HW, et al. Field evaluation of resistance of transgenic rice containing a synthetic cry1Ab gene from Bacillus thuringiensis berliner to two stem borers. J Econ Entomol, 2001, 94(1): 271–276.
[4] Qiu CX, Sangha JS, Song FS, et al. Production of marker-free transgenic rice expressing tissue-specific Bt gene. Plant Cell Rep, 2010, 29(10): 1097–1107.
[5] Vaeck M, Reynaerts A, Höfte H, et al. Transgenic plants protected from insect attack. Nature, 1987, 328(6125): 33–37.
[6] Lin YJ, Zhang QF. The transformation of synthetic Bacillus thuringiensis crystal protein gene of cry2A: China, ZL021390000. 2006-03-08.林拥军, 张启发. 改造合成的苏云金芽胞杆菌杀虫晶体蛋白基因 cry2A: 中国, ZL02139000. 2006-03-08.
[7] Leigh H, Susan M, James W, et al. Nucleic acid segments encoding modified Bacillus thuringiensis coleopteran-toxic crystal proteins: US, 6060594. 2000-05-09.
[8] Mittler IJ, Plaisted DC, Honghton W, et al. DNA construct containing Bacillus thuringiensis gene and plants containing it: US, 6342660 B1. 2002-01-29.
[9] Campbell WH, Gowri G. Codon usage in higher plants, green algae, and cyanobacteria. Plant Physiol, 1990, 92(1): 1–11.
[10] Hayakawa T, Howlader MTH, Yamagiwa M, et al. Design and construction of a synthetic Bacillus thuringiensis cry4Aa gene: hyperexpression in Escherichia coli. Appl Microbiol Biotechnol, 2008, 80(6): 1033–1037.
[11] Zhang L, Jin LG, Luo L, et al. Analysis of nuclear gene codon bias on soybean genome and transcriptome. Acta Agronom Sin, 2011, 37(6): 965–974.张乐, 金龙国, 罗玲, 等. 大豆基因组和转录组的核基因密码子使用偏好性分析. 作物学报, 2011, 37(6): 965–974.
[12] Li CL, Han L, Zheng ZY, et al. Optimization of plant des-pGlu1-Brazzein gene according to yeasty biased codons and its expression in Pichia pastoris. Chin J Biotech, 2011, 27(8): 1158–1163.李春丽, 韩露, 郑振宇, 等. 植物甜蛋白des-pGlu1-Brazzein的密码子优化及其在毕氏酵母中的表达. 生物工程学报, 2011, 27(8): 1158–1163.
[13] Yang JK, Yan XX, Huang RB, et al. Codon optimization, expression and enzymatic comparison of Rhizopus oryzae lipases pro-ROL and m-ROL in Pichia pastoris. Chin J Biotech, 2011, 27(12): 1780–1788.杨江科, 严翔翔, 黄日波, 等. 米根霉脂肪酶基因pro-ROL和m-ROL在毕赤酵母中的密码子优化、表达和酶学性质的比较分析. 生物工程学报, 2011, 27(12): 1780–1788.
[14] Yin CG, Du LX, Zhao GP, et al. Optimizing the expression of Mx gene in Escherichia coli based on rare codon and mRNA structure. Hereditas, 2009, 31(1): 75–82.尹春光, 杜立新, 赵桂平, 等. Mx基因稀有密码子和 mRNA结构及大肠杆菌表达优化. 遗传, 2009, 31(1): 75–82.
[15] Nicolai S, Aviah Z, Menachem K, et al. Synthetic Bacillus thuringiensis cryiC gene encoding insect toxin: US, 6043415. 2000-3-28.
[16] Goodall GJ, Filipowicz W. The AU-rich sequences present in the introns of plant nuclear pre-mRNAs are required for splicing. Cell, 1989, 58(3): 473–483.
[17] Dean C, Tamaki S, Dunsmuir P, et al. mRNA transcripts of several plant genes are polyadenylated at multiple sites in vivo. Nucl Acids Res, 1986, 14(5): 2229–2240.
[18] Koziel MG, Beland GL, Bowman C, et al. Field performance of elite transgenic maize plants expressing an insecticidal protein derived from Bacillus thuringiensis. Nat Biotechnol, 1993, 11(2): 194–200.
[19] Perlak FJ, Fuchs RL, Dean DA, et al. Modification of the coding sequence enhances plant expression of insect control protein genes. Proc Natl Acad Sci USA, 1991, 88(8): 3324–3328.
[20] Zhang J, Song FP, Huang DF, et al. Bt-cry1Ah gene with high toxicity for lepidoptera and its expression product: China, ZL200410009918.9. 2005-05-11.张杰, 宋福平, 黄大昉, 等. 对鳞翅目昆虫高毒力的 Bt cry1Ah基因及其表达产物: 中国, ZL200410009918.9. 2005-05-11.
[21] Xue J, Zhou ZS, Song FP, et al. Identification of the minimal active fragment of the Cry1Ah toxin. Biotechnol Lett, 2011, 33(3): 531–537.
[22] Gallie DR, Sleat DE, Watts JW, et al. The 5'-leader sequence of tobacco mosaic virus RNA enhances the expression of foreign gene transcripts in vitro and in vivo. Nucl Acids Res, 1987, 15(8): 3257–3273.
[23] Kozak M. Compilation and analysis of sequences upstream from the translational start site in eukaryotic mRNAs. Nucl Acids Res, 1984, 12(2): 857–872.
[24] Wandelt CI, Khan MRI, Craig S, et al. Vicilin with carboxy-terminal KDEL is retained in the endoplasmic reticulum and accumulates to high levels in the leaves of transgenic plants. Plant J, 1992, 2(2): 181–192.
[25] Zhang JT, Shu CL, Song FP, et al. Cloning, expression and insecticidal activity of cry2Ad gene from Bacillus thuringiensis. Biotechnol Bull, 2009, (10): 146–150, 155.张静涛, 束长龙, 宋福平, 等. 苏云金芽胞杆菌cry2Ad基因的克隆及其表达产物的活性分析. 生物技术通报, 2009, (10): 146–150, 155.
[26] Wang GL, Fang HJ. Plant Genetic Engineering. 2nd ed. Beijing: Science Press, 2002: 744.王关林, 方宏筠. 植物基因工程. 2版. 北京: 科学出版社, 2002: 744.
[27] Christensen AH, Quail PH. Ubiquitin promoter-based vectors for high-level expression of selectable and/or screenable marker genes in monocotyledonous plants. Transgenic Res, 1996, 5(3): 213–218.
[28] Zhang CY, Zhang GH, Yang M, et al. Elimination of primer-dimer effect in SYBR GreenⅠReal-time RT-PCR using 4-step program. Chin J Biochem Mol Biol, 2004, 20(3): 387–392.张驰宇, 张高红, 杨敏, 等. 四步法消除 SYBR Green Ⅰ实时定量RT-PCR中引物二聚体的影响.中国生物化学与分子生物学报, 2004, 20(3): 387–392.
[29] Hiwasa-Tanase K, Nyarubona M, Hirai T, et al. High-level accumulation of recombinant miraculin protein in transgenic tomatoes expressing a synthetic miraculin gene with optimized codon usage terminated by the native miraculin terminator. Plant Cell Rep, 2011, 30(1): 113–124.
[30] Kudla G, Murray AW, Tollervey D, et al. Coding-sequence determinants of gene expression in Escherichia coli. Science, 2009, 324(5924): 255–258.
[31] Murray EE, Lotzer J, Eberle M. Codon usage in plant genes. Nucl Acids Res, 1989, 17(2): 477–498.
