转氨酶催化不对称合成芳香族L-氨基酸
夏温娜,孙雨,闵聪,韩威,吴胜
1 沈阳药科大学生命科学和生物制药学院,辽宁 沈阳 110016
2 中国科学院微生物研究所 微生物资源前期开发国家重点实验室,北京 100101
氨基酸是组成蛋白质的基本结构单元。在组成蛋白质的20种天然氨基酸中,除甘氨酸外,其他都是L-型的手性α-氨基酸。相对于L-型氨基酸的广泛存在,研究人员从微生物和高等生物中也分离到许多以游离或结合形式存在的 D-型氨基酸[1-3],这些 D-型氨基酸在生长发育、代谢调控等许多方面发挥着重要的作用[4-5]。从结构来看,含有芳香环的氨基酸具有独特的化学和生物学性质,在食品、医药和化工行业都有很广泛的应用。常见的芳香族氨基酸有色氨酸、酪氨酸、苯丙氨酸、苯甘氨酸、对羟苯甘氨酸等。L-苯丙氨酸是人体必需氨基酸之一,也是目前食品行业普遍使用的甜味剂阿斯巴甜 (Aspartame) 的主要生产原料[6]。L-酪氨酸是合成二溴酪氨酸、二碘酪氨酸及L-多巴、肾上腺素等医药产品的手性砌块,同时也可以作为氨基酸类药物治疗脊髓炎和结核脑炎等疾病[7-8]。苯甘氨酸和对羟苯甘氨酸则是合成青霉素类和头孢菌素类药物的重要手性砌块[9]。这些天然和非天然的手性氨基酸也是多肽固相合成的重要原料[10]。
L-氨基酸可以通过直接发酵法、化学合成法和生物酶法等多种方法进行生产。在微生物体内,天然氨基酸的合成都是利用葡萄糖经过复杂的代谢途径合成的,通过代谢工程改造这些生物合成途径来提高目标氨基酸的合成效率是重要的研究方向[11-13]。常规化学合成的氨基酸都是外消旋体,需要进一步通过手性拆分试剂将外消旋体中的两个对映体分离从而获得单一异构体。通过不对称化学合成手性氨基酸是目前有机合成领域的重点研究方向,在金属催化剂和有机催化剂的设计和应用方面取得很多进展[14-15]。相对于化学不对称催化,生物不对称催化具有许多独特的优势。酶催化通常在室温和水相中进行,反应条件温和;相对于化学催化剂,酶作为生物催化剂通常具有很高的催化活性以及区位和立体选择性;酶催化省去了化学催化过程中常用的对活性功能基保护和去保护过程。通过生物不对称氨化合成手性氨类化合物取得了重大的突破,2010年,Merck公司和Codexis公司的科研人员密切合作,利用分子改造后的ω-转氨酶将前手性的酮经过一步生物不对称氨化合成治疗糖尿病的药物西格列汀 (Sitagliptin),并且实现工业化生产,为企业带来巨大的经济效益[16-17]。
通过生物不对称催化合成 L-氨基酸的酶促反应的类型很多[18-20],在众多的酶促反应中,经由转氨酶催化的不对称转氨反应合成手性 α-氨基酸具有独特的生物学地位,转氨酶催化的α氨基酸和酮酸之间的氨基转移反应在氨基酸的代谢中占有重要地位。转氨酶是 5-磷酸吡哆醛(PLP) 依赖型,其催化的反应是可逆的,在反应过程中存在5-磷酸吡哆醛 (PLP) 和5-磷酸吡哆胺 (PMP) 的互相转换 (图 1)。转氨酶催化的是典型的双底物反应,遵循乒乓反应机制[21]。通常转氨酶具有底物的不专一特点,因此可以用一种转氨酶合成多种类型的氨基酸。转氨酶对作为氨基供体的不同氨基酸底物的催化活性不同,命名主要是根据其催化活力最大的氨基酸来命名,比如天冬氨酸转氨酶和苯丙氨酸转氨酶的氨基供体最适底物分别为天冬氨酸和苯丙氨酸。通过转氨酶合成手性氨基酸是酶促不对称催化合成氨基酸的一种重要的途径[22-26]。
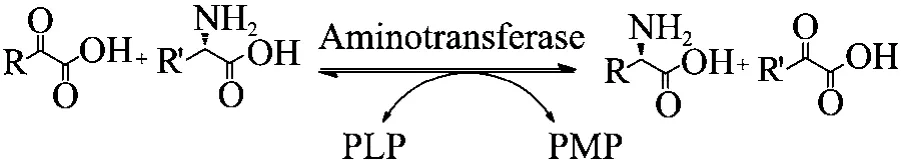
图1 转氨酶催化的生物不对称氨化合成氨基酸Fig. 1 Biosynthesis of amino acids by asymmetric transamination catalyzed by aminotransferase.
本文通过对不同来源转氨酶的进化分析,选择分别源自原核生物 E. coli和真核生物S. cerevisia具有代表性的Ⅰ型转氨酶TyrB和Aro8进行研究,转氨酶TyrB和Aro8的生物学功能和基本的酶学性质已有较为详细地研究[27-29],本文重点探索两酶通过逆转平衡反应不对称合成芳香族氨基酸的效率。首先克隆了两酶的编码基因并过量表达纯化,对转化生成的氨基酸进行了手性 HLPC检测。详细比较研究了两酶在催化 α-酮酸合成天然和非天然芳香族 L-氨基酸的反应过程和催化效率,测定了两酶在制备规模条件下合成芳香族氨基酸的转化率和比生产速率。结果表明两酶都可以有效地合成芳香族氨基酸。在生物不对称氨化合成非天然苯甘氨酸时,转氨酶Aro8较TyrB催化效率更高,比生产速率是后者的2.2倍;在合成天然氨基酸苯丙氨酸和酪氨酸时,两酶的催化效率相近。
1 材料与方法
1.1 材料
1.1.1 工具酶与试剂
限制性内切酶、Taq DNA聚合酶和T4 DNA连接酶购于加拿大MBI Fermentas公司;IPTG购于北京赛百盛基因技术有限公司;苯甲酰甲酸、4-羟苯丙酮酸购于比利时ACROS试剂公司;苯丙酮酸购于美国 Sigma-Aldrich公司;L-苯甘氨酸购于北京偶合科技有限公司,L-酪氨酸、D-丙氨酸、L-丙氨酸购于国药集团化学试剂北京有限公司;基因组提取试剂盒、质粒提取试剂盒购于天根生化科技 (北京) 有限公司;丙烯酰胺、DNA凝胶回收试剂盒购于德国QIAGEN公司;丙烯酰胺、N,N’-亚甲叉丙烯酰胺、TEMED购于美国 AMRESCO公司;蛋白胨、酵母膏、氯化钠均为国产分析纯试剂。
1.1.2 菌株与质粒
酿酒酵母S. cerevisiae购于中国普通微生物菌种保藏管理中心 (CGMCC)。E. coli DH5α、E. coli BL21 (DE3) 与表达载体pET-28a、pET-30a均为本实验室保存。
1.2 方法
1.2.1 转氨酶基因的克隆、表达与纯化
原核微生物 E. coli DH5α和真核微生物S. cerevisiae分别接种到LB和麦芽汁培养基中,分别在37 ℃和28 ℃培养14 h,离心收集菌体。基因组DNA的提取按照基因组提取试剂盒指示的方法进行。通过对S. cerevisiae基因组的生物信息学分析表明编码转氨酶Aro8的基因aro8中无内含子的存在,因此对基因 aro8的克隆直接用S. cerevisiae基因组DNA为模板,无需提取总mRNA,通过逆转录PCR进行。根据NCBI数据库中E. coli中tyrB基因序列 (GenBank Accession No. M12047) 和S. cerevisiae中aro8基因序列(GenBank Accession No. Y13624) 分别设计上游引物和下游引物,见表1。
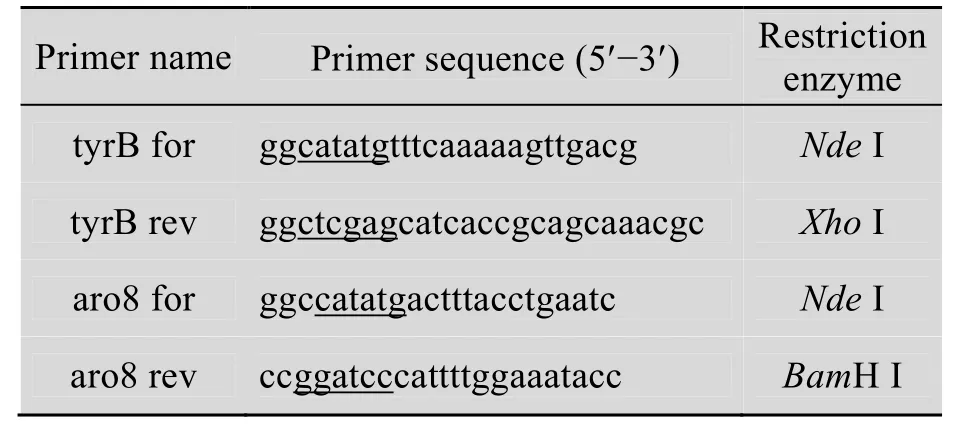
表1 用于扩增tyrB和aro8基因的PCR引物Table 1 PCR primers for amplification of tyrB and aro8 genes
分别以E. coli和S. cerevisiae基因组DNA为模板,进行PCR扩增。PCR的条件为:94 ℃5 min;94 ℃ 1 min,53 ℃ 1 min,72 ℃ 1.5 min,进行30个循环;72 ℃ 10 min。PCR产物切胶回收后,分别用NdeⅠ/XhoⅠ以及NdeⅠ/BamHⅠ双酶切,连接到经同样酶切处理的表达载体pET-30a和 pET-28a,构建重组质粒 pET30-tyrB 和pET28-aro8,转化宿主E. coli BL21 (DE3)。菌落PCR,酶切验证以及序列测定表明克隆的基因序列与数据库中的序列一致,并且正确地连接到表达载体的读码框中。
含有表达质粒的重组大肠杆菌接种到LB液体培养基中,加入终浓度为10 mg/L卡那霉素,37 ℃、200 r/min培养至OD580等于0.8左右时,加入诱导剂IPTG,终浓度为1 mmol/L。转移到28 ℃摇床中,200 r/min继续诱导培养6 h。离心收集的菌体用PBS缓冲液洗涤后,加入破碎缓冲液 (50 mmol/L NaH2PO4,300 mmol/L NaCl,10 mmol/L咪唑) 悬浮菌体,在冰浴条件下超声破碎细胞,低温高速离心 (12 000 r/min,25 min)收集上清液,将收集的样品加到预先处理过的His-Trap镍离子螯合柱,然后以高浓度的咪唑缓冲液 (50 mmol/L NaH2PO4,300 mmol/L NaCl,250 mmol/L咪唑) 进行洗脱,收集的目的蛋白在PBS缓冲液中透析脱盐后,分装冻存于-80 ℃保存备用。
1.2.2 蛋白质浓度测定和电泳检测
蛋白浓度采用紫外分光光度法,应用日本Malcom公司的e-spect测定。SDS-PAGE进行蛋白检测时,浓缩胶浓度为 5%,分离胶浓度为10%。电泳完毕分离胶用考马斯亮蓝R250染色,脱色后观察蛋白质的表达和纯化效果。
1.2.3 转氨酶的活性测定
无特别说明时,转氨酶活力测定的1 mL反应体系中包含 100 mmol/L 磷酸盐缓存液(pH 8.0),1 mmol/L α-酮酸 (氨基受体),4 mmol/L L-丙氨酸 (氨基供体),0.1 mmol/L PLP,以及一定量的转氨酶。30 ℃、1 000 r/min反应20 min (处于一级反应范围之内)。芳香族酮酸和氨基酸的检测和定量按1.2.5中所示的HPLC法进行测定。酶活的定义:转氨酶在上述实验条件下每分钟催化生成1 µmol氨基酸定义为1个活力单位 (U)。酶的比活力定义为每毫克纯的转氨酶每分钟催化生成氨基酸的微摩尔数。
1.2.4 制备规模的生物不对称转氨合成芳香族氨基酸
为了比较规模化制备过程中,两种酶 (Aro8和TyrB) 催化不对称氨化3种不同的α-酮酸生成相应的芳香族L-氨基酸的最大生产效率,反应体系中苯丙酮酸和 4-羟苯丙酮酸的浓度为各自的饱和浓度,浓度分别为23 mmol/L和27 mmol/L,两种酮酸在水相中的溶解度与其是否成盐以及成盐的类型有关[30]。苯甲酰甲酸的浓度为 Aro8和 TyrB各自的最适底物浓度 (20 mmol/L和10 mmol/L)。反应体系中氨基供体L-丙氨酸的浓度为α-酮酸浓度的4倍,PLP浓度是0.1 mmol/L,用0.5 mol/L NaOH调节反应液pH为8.0,加入转氨酶后启动反应。反应体系总体积为40 mL,反应温度为30 ℃,转速为1 000 r/min。在反应过程中定时取样,用HPLC定量检测残留的酮酸和生成的芳香族氨基酸。
1.2.5 分析方法
转氨反应结束后,反应液经高速冷冻离心和微孔滤膜过滤处理,芳香族酮酸和生成氨基酸的定性和定量分析在HPLC上进行,定量采用标准曲线法。常规 HPLC分析色谱柱为Dikma C18反向色谱柱,柱温为室温25 ℃。流动相A液为50 mmol/L KH2PO4+2%乙腈,B液为色谱级乙腈。分离苯甲酰甲酸及其产物时,A液和B液的比例为94∶4,苯甘氨酸和苯甲酰甲酸的保留时间分别为3.8 min和10.5 min;分离苯丙酮酸及其产物时,A液和B液的比例为90∶10,苯丙氨酸和苯丙酮酸的保留时间分别为3.8 min和10.2 min;分离4-羟苯丙酮酸及其产物时,A液和B液的比例为98∶2,酪氨酸和 4-羟苯丙酮酸的保留时间分别为 4.2 min和7.9 min。
芳香族氨基酸在进行手性分析时,色谱柱为Chirex 3126(D)-pheicillamine 手性柱,A 液为2 mmol/L CuSO4溶液;B液为色谱级甲醇。分离DL-苯丙氨酸和DL-苯甘氨酸时,A液和B液的比例为 75∶25;分离 DL-酪氨酸时,A液和 B液的比例为85∶15。分离过程中保持色谱柱的柱温为35 ℃。各种芳香族氨基酸对映体的保留时间见图5。转化率指反应过程中消耗底物酮酸的量与反应前加入总的底物酮酸量的比例。比生产速率指在实验条件下,每小时每克纯的转氨酶催化生成氨基酸的产量 (g/(g·h))。
2 结果与分析
2.1 转氨酶的进化分析
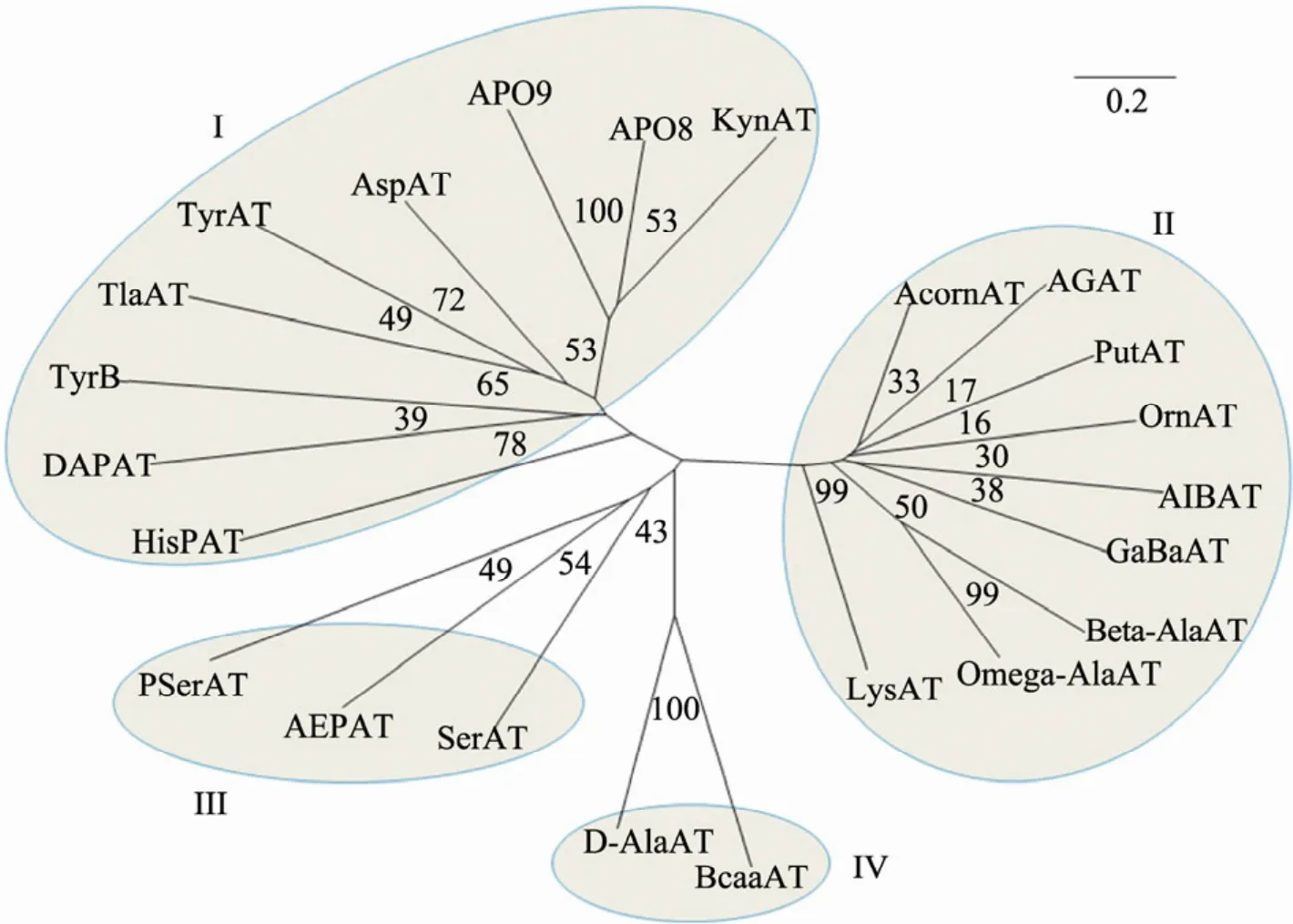
图2 转氨酶系统进化分析Fig. 2 Phylogenetic analysis of aminotransferases from different sources. Groups I-IV are shaded and labeled. Bootstrap values are given on the relevant branches of the tree. HisPAT from Burkholderia rhizoxinica HKI 454(CBW74631); DAPAT from Simkanina nogevensisz (YP_004671405); TyrB from E. coli (AAA24703); AlaAT from Haemophilu shaemolyticus HK386 (EIJ73959.1); TyrAT from Bos taurus (DAA20108); AspAT from Methanococcus jannaschii (D64385); ARO9 from S. cerevisiae (NP_012005); ARO8 from S. cerevisiae (CAA73946); KynAT from Bos taurus (DAA27093.A); AcornAT from Corynebacterium jeikeium K411 (CAI37006); AGAT from Bos taurus (DAA17829); PutAT from E. coli BL21 (CAQ33409); OrnAT from Mus musculus (NP_058674); AIBAT from Actinoplanes sp. SE50/110 (YP_006266630); GaBaAT from Bacillus amyloliquefaciens Y2 (AFJ60460); Beta-AlaAT from Pseudomonas fluorescens A506 (AFJ59042); Omga-AlaAT from Burkholderia rhizoxinica HKI 454 (CBW76658); LysAT from Mycobacterium sp. (AFJ37069); PSerAT from Bartonella tribocorum CIP 105476 (CAK01014); AEPAT from Vibrio cholerae IEC224 (AFC60092); SerAT from Homo sapiens (CAA39572); D-AlaAT from Staphylococcus carnosus subsp. carnosus (CAL28261); BcaaAT from Methanocella conradii HZ254 (AFC98904).
将文献报道的不同来源的转氨酶的蛋白质序列进行比较和聚类分析,可以将转氨酶分为4类 (图2)。己报道的转氨酶都是以5-磷酸吡哆醛(PLP) 为辅基,催化同一类型的反应,它们之间的主要区别就在于转氨酶的底物特异性 (此处的底物主要指氨基供体,即氨基酸) 不同。每一类型的氨基转移酶的底物结构类似。第Ⅰ类氨基转移酶是4种类型中数量较多的一类,这类酶作用的底物较多,存在底物交叉现象,比如天冬氨酸转氨酶 (AspAT) 和酪氨酸转氨酶 (TyrAT)都能催化苯丙氨酸的转氨反应。第Ⅳ类转氨酶包含比较少见的D-型氨基酸转氨酶如D-丙氨酸转氨酶 (D-AlaAT) 等。在本研究旨在通过生物不对称催化氨化合成芳香族L-氨基酸,因此选择Ⅰ型转氨酶中具有代表性的两个芳香族氨基酸氨基转氨酶Aro8和TyrB,两者分别来源于真核生物S. cerevisiae和原核生物E. coli。芳香族氨基酸转氨酶的最适氨基供体底物是苯丙氨酸和酪氨酸等,氨基受体为丙酮酸或α-酮戊二酸。本研究中是基于转氨酶可以催化可逆反应,探索利用较为廉价的丙氨酸或谷氨酸为氨基供体,通过逆转化学反应平衡从而逆向合成具有重要用途的天然和非天然芳香族氨基酸的反应过程和催化效率。
2.2 转氨酶的克隆、表达和纯化
根据 NCBI数据库中来源于 E. coli 和S. cerevisiae的转氨酶TyrB和Aro8的基因序列分别设计引物tyrB for和tyrB rev以及aro8 for和aro8 rev。以各自的基因组为模板进行PCR扩增,产物经琼脂糖凝胶电泳鉴定大小分别约为1 200 bp和1 700 bp (图3)。进一步通过常规的分子生物学操作分别构建重组表达载体pET28-aro8和pET30-tyrB。转化E. coli BL21 (DE3) 后获得正确的重组菌。重组菌经IPTG诱导后,重组蛋白在大肠杆菌中得到高水平的可溶性表达。重组的转氨酶Aro8和TyrB分别在N末端和C末端含有6个His-Tag,能够特异性地结合到带有镍离子的亲和层析柱上,破碎后的粗蛋白经过亲和纯化之后,得到纯度较高的目的蛋白。经过10%的SDS-PAGE电泳显示,Aro8的蛋白分子量约为57 kDa,TyrB的蛋白分子量约为44 kDa (图4)。

图3 aro8和tyrB基因PCR产物电泳图Fig. 3 Ananlysis of PCR products of aro8 and tyrB gene. M: DNA marker; 1: aro8 PCR product; 2: tyrB PCR product.
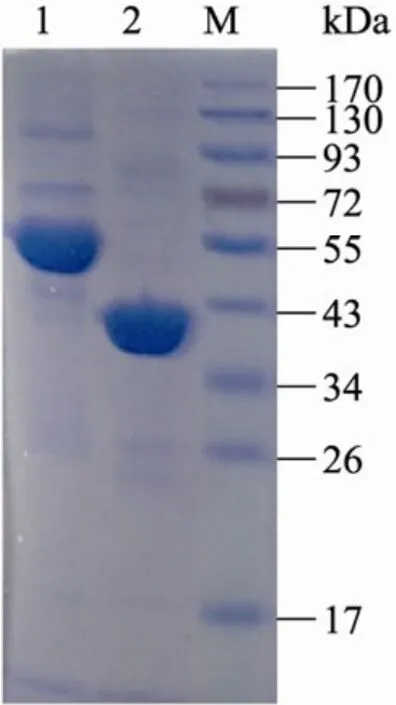
图4 SDS-PAGE分析纯化的转氨酶Aro8和TyrBFig. 4 SDS-PAGE analysis of the purified aminotransferases. M: protein molecular marker; 1: purified Aro8; 2: purified TyrB.
2.3 转氨酶活力
如表2所示,以L-丙氨酸为氨基供体,转氨酶Aro8和TyrB催化α-酮酸合成芳香族氨基酸苯甘氨酸、苯丙氨酸和酪氨酸时,以4-羟苯丙酮酸为底物时,催化活力最大,苯丙酮酸次之,苯甲酰甲酸为底物催化活力最低。催化苯甲酰甲酸转氨生成苯甘氨酸时,来自S. cerevisiae的转氨酶Aro8是来自E. coli的TyrB催化活力的5.6倍。底物芳香族 α-酮酸中芳香环上的取代基以及脂肪酸碳链部分的长度都对酶催化的转氨效率有显著的影响。

表2 转氨酶TyrB和Aro8转氨合成芳香族氨基酸的活力Table 2 Aromatic transamination activity of Aro8 and TyrB
2.4 转氨酶催化生成芳香族氨基酸的构型分析
转氨酶能够催化将氨基酸的氨基转移到 α-酮酸上,α-酮酸发生不对称氨化生成相应的氨基酸。在转氨过程需要辅酶PLP与氨基酸结合形成复合物,通过内源性醛亚胺与外源性醛亚胺之间的互换完成氨基的转移。本实验以苯甲酰甲酸、苯丙酮酸、4-羟苯丙酮酸作为氨基的受体,以L-丙氨酸作为氨基供体,在转氨酶TyrB和Aro8的作用下形成相应的苯甘氨酸、苯丙氨酸和酪氨酸。氨基受体浓度为 1 mmol/L,L-丙氨酸为2 mmol/L,PLP为0.1 mmol/L,体系中转氨酶的量为 0.3 mg。经过 12 h的反应后产物经手性HPLC检测,发现生成的氨基酸构型均是L型,e.e值等于100% (图5)。这表明转氨酶Aro8和TyrB催化的转氨反应具有绝对的立体选择性,可以用来合成光学纯的L-氨基酸。
2.5 氨基供体的选择
Aro8和 TyrB均为芳香族氨基酸氨基转移酶,转氨反应中最适的氨基供体是苯丙氨酸、酪氨酸、色氨酸等。本研究是利用转氨酶催化反应的可逆性通过逆转化学反应平衡从而逆向合成芳香族氨基酸。本研究选择芳香族的α-酮酸作为氨基受体,选择比较廉价的氨基酸如L-丙氨酸和L-谷氨酸作为氨基供体,为了比较不同氨基供体对转化率的影响,以苯丙酮酸为氨基受体为例,反应体系为:1 mmol/L苯丙酮酸,4 mmol/L L-丙氨酸或L-谷氨酸,0.1 mmol/L PLP,0.3 mg转氨酶Aro8或TryB,30 ℃反应22 h,HPLC检测生成的L-苯丙氨酸的产物量,计算转化率,结果见表3。
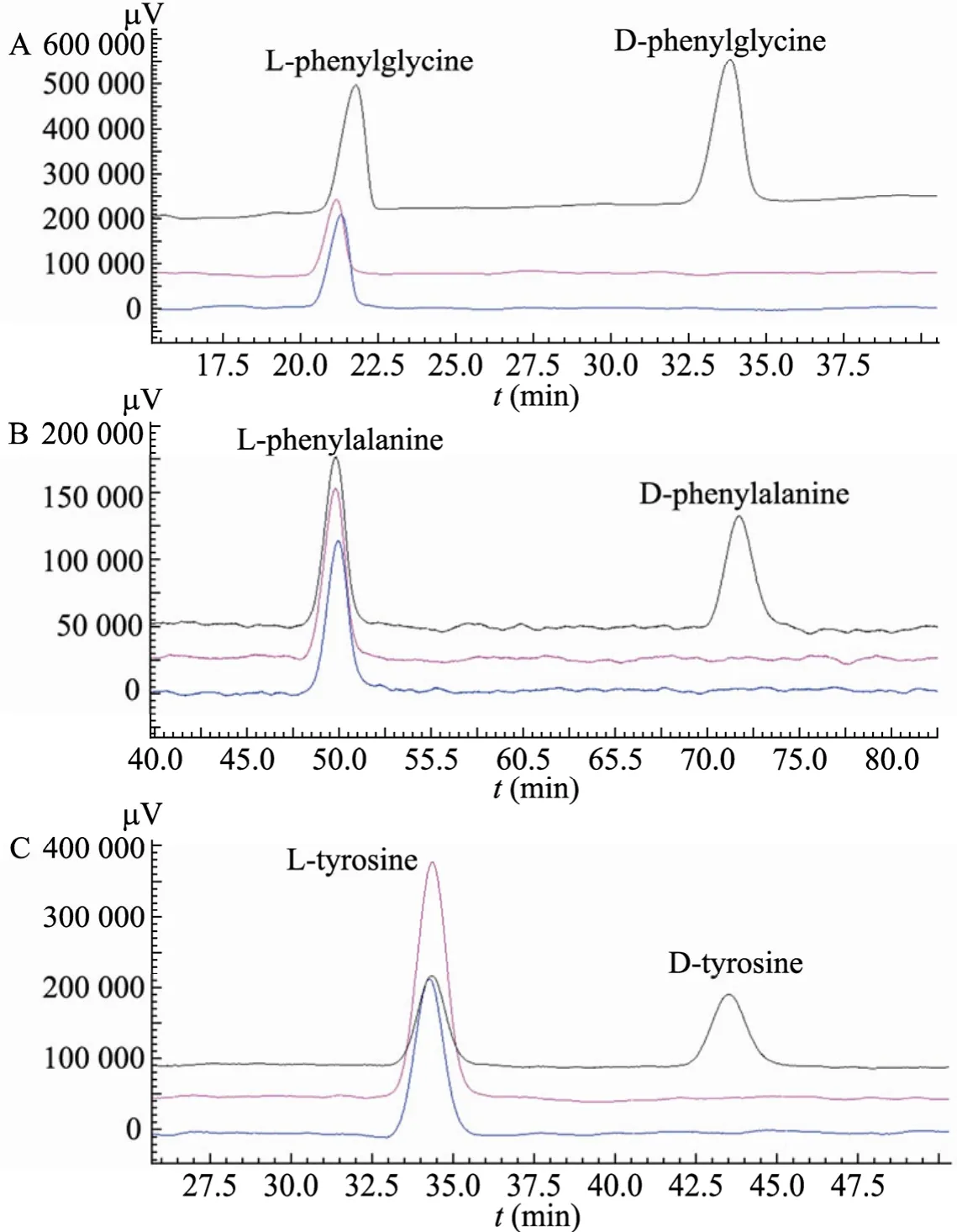
图5 手性HPLC分析转氨酶Aro8和TyrB催化的转氨反应生成产物的立体构型Fig. 5 Chiral HPLC analysis of products after transamination reaction catalyzed by Aro8 and TyrB. (A) Bioconversion benzoylformic acid to L-phenylglycine by Aro8 (purple) and TyrB (blue). (B) Bioconversion phenylpyruvic acid to L-phenylalanine by Aro8 (purple) and TyrB (blue). (C) Bioconversion 4-hydroxyphenylpyruvic acid to L-tryrosine by Aro8 (purple) and TyrB (blue). Racemic DL-phenylglycine, DL-phenylalanine and DL-tyrosine in Fig. A, B and C, respectively, were showed in black.
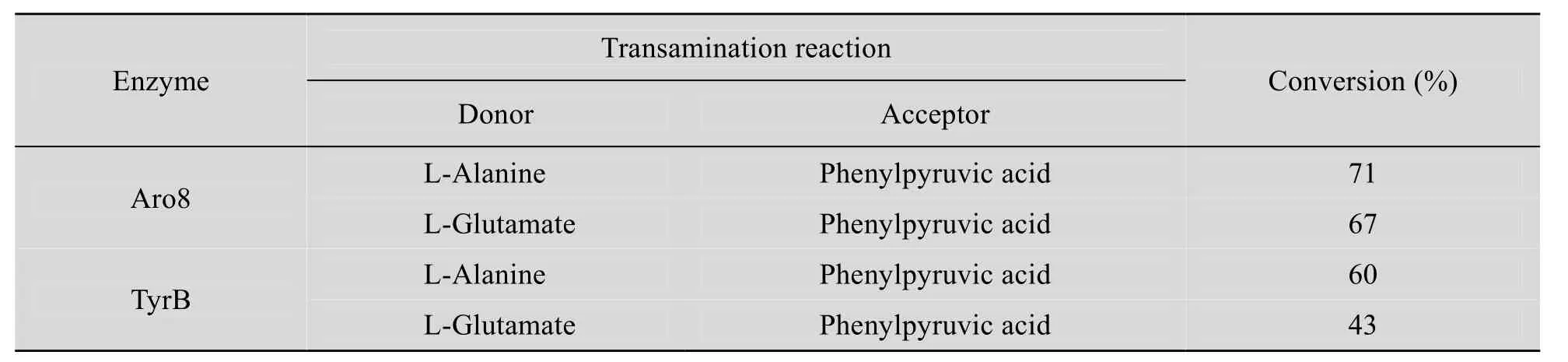
表3 不同氨基供体转氨效率的比较Table 3 Comparison of the transamination efficiency using L-alanine and L-glutamate as amino donors
如表3所示,L-丙氨酸和L-谷氨酸都可以作为氨基供体用于不对称合成 L-苯丙氨酸,其中L-丙氨酸作为氨基供体生成苯丙氨酸的效率要优于L-谷氨酸。在实际应用时,L-谷氨酸不仅溶解度低,而且为酸性氨基酸,大量使用会改变反应体系的pH值,往往需要加入碱溶液调节体系的pH值,增加额外的操作步骤。所以L-丙氨酸为适宜的氨基供体。
研究中也探索了不同来源的两种转氨酶是否可以利用D-氨基酸作为氨基供体,如D-丙氨酸等,结果显示无论Aro8还是TryB都不能利用D-氨基酸作为氨基供体合成芳香族氨基酸。
2.6 转氨反应中氨基供体和受体比例的选择
转氨酶催化的氨基迁移反应是可逆反应,为了使反应平衡向合成芳香氨基酸的正反应方向进行,可以通过增加氨基供体与受体的比例来提高底物酮酸的转化率。反应体系为:1 mmol/L苯丙酮酸,氨基供体L-丙氨酸浓度依次为受体的1、2、3、4、5、10倍,0.1 mmol/L PLP,0.3 mg 转氨酶Aro8或TryB,30 ℃反应12 h,HPLC检测生成的L-苯丙氨酸的产物量,计算转化率,结果见图6。
如图6所示,随着氨基供体L-丙氨酸浓度的增大,转氨合成L-苯丙氨酸的效率增加。当氨基受体和供体的浓度比为 1∶10时,Aro8催化的苯丙酮酸转化率达到 47.2%,TyrB催化转化率达到29.2%,因此增加氨基供体的比例可以有效地提高转化率,促进芳香族氨基酸合成。当受体与供体摩尔比超过1∶4时,尽管转化率有所提高,但增加的幅度并不明显,表明氨基供体的实际利用效率降低。根据提高转化率和降低反应成本两方面因素的考虑,转氨反应中氨基受体和供体的适宜比例选择为1∶4。

图6 不同摩尔比的氨基受体和供体比例对合成转氨反应的影响Fig. 6 Effect of the ratio of amino acceptor and donor on the transamination reaction.
2.7 苯甲酰甲酸转化的最佳浓度
前手性的 α-酮酸苯甲酰甲酸通过不对称转氨反应可用合成非天然氨基酸苯甘氨酸,后者在医药工业上有广泛的用途。在实际的生产过程中需要考虑反应体系中底物的投料量,底物浓度太稀则生产过程不经济,底物浓度过高,有可能导致底物抑制效应。在本实验中设定苯甲酰甲酸的浓度依次为1、10、20、30、40、50、70 mmol/L,L-丙氨酸浓度为苯甲酰甲酸对应浓度的4倍,由于高浓度的苯甲酰甲酸会改变缓冲体系的 pH值,因此用0.5 mol/L NaOH调节反应体系的pH值为 8.0。反应体系中, 辅酶 PLP浓度为0.1 mmol/L,转氨酶Aro8和TyrB的量为0.3 mg。30 ℃反应20 h后,用HPLC检测定量生成的苯甘氨酸,计算转化率,结果见图7。
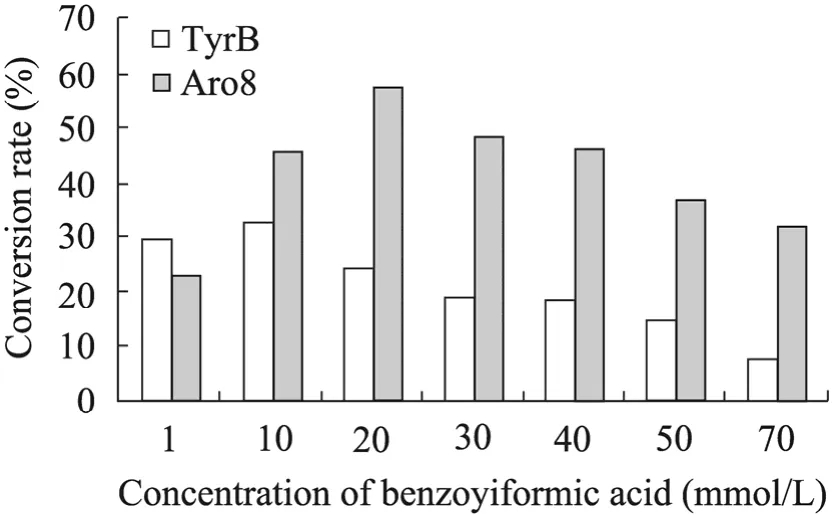
图7 不同浓度苯甲酰甲酸对转化率的影响Fig. 7 Effect of the different concentration of benzoylformic acid on the conversion rate.
由图7可见,在一定范围内,随着底物苯甲酰甲酸浓度的增加,转化率也在增加,但过高的底物浓度,导致酶的催化活性受到明显抑制。当Aro8催化苯甲酰甲酸不对称转氨反应的最适底物浓度为20 mmol/L;TyrB催化最适底物浓度为10 mmol/L。
2.8 反应进程及比生产速率
按照方法1.2.4中所述,在40 mL的制备规模的反应体系中,底物苯丙酮酸和4-羟苯丙酮酸处于饱和浓度,苯甲酰甲酸分别为Aro8和TyrB的最适底物浓度,在两酶生物不对称催化下将L-丙氨酸的氨基转移到酮酸上生成相应的手性芳香族氨基酸苯丙氨酸、酪氨酸和苯甘氨酸。反应过程中,定时取样,HPLC定量检测酮酸和生成氨基酸的变化,绘制转化反应的进程曲线 (图8和图9)。
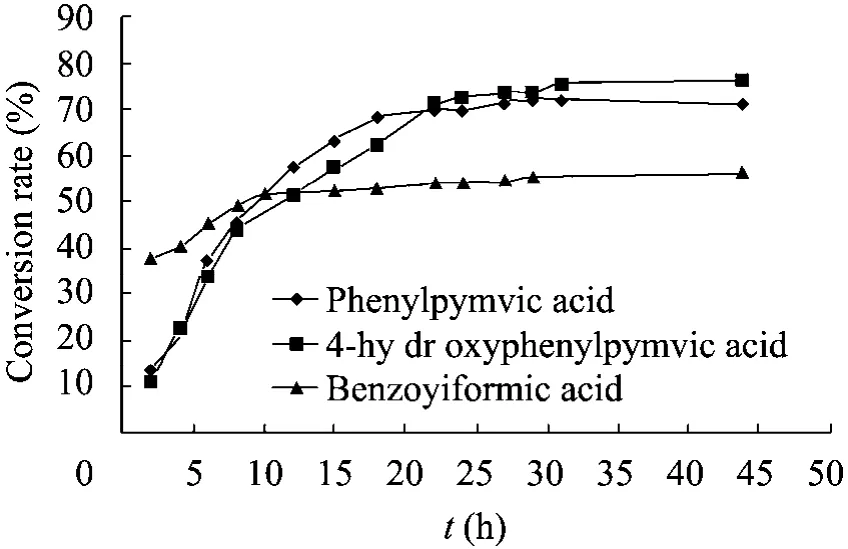
图8 Aro8催化不同底物的反应进程图Fig. 8 Bioconversion of the different substrates using transaminase Aro8.
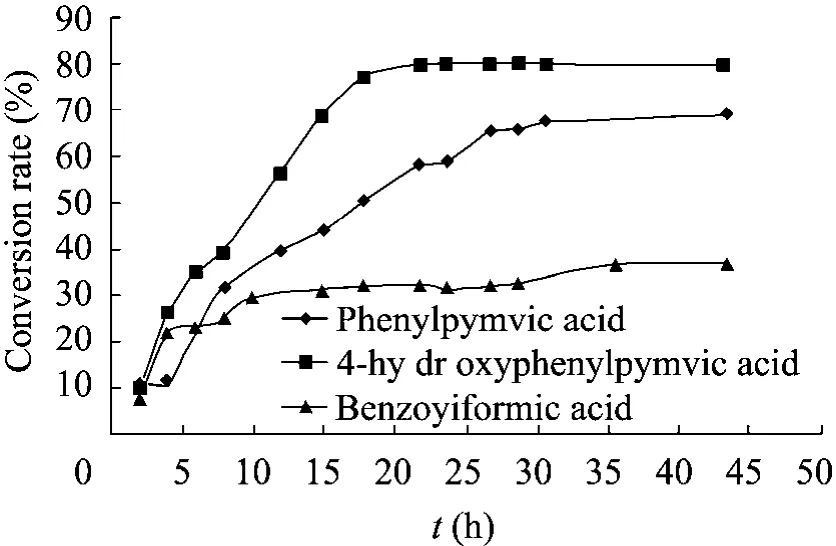
图9 TyrB催化不同底物的反应进程图Fig. 9 Bioconversion of the different substrates using transaminase TyrB.
从图8和图9可见,Aro8 和TyrB催化不对称转氨反应合成手性芳香族氨基酸的效率都是4-羟苯丙酮酸>苯丙酮酸>苯甲酰甲酸。Aro8催化酪氨酸、苯丙氨酸和苯甘氨酸 3种芳香族氨基酸合成的最大转化率分别为 74%、72%和54%,比生产速率依次为0.59 g/(g·h)、0.48 g/(g·h)和0.61 g/(g·h)。转氨酶TyrB催化上述3种氨基酸不对称合成的最大转化率为79%、67%和32%,比生产速率依次为 0.60 g/(g·h)、0.31 g/(g·h)和0.28 g/(g·h)。在生物不对称氨化合成非天然苯甘氨酸时,转氨酶Aro8较TyrB催化效率更高,比生产速率是后者的2.2倍。转氨酶催化4-羟苯丙酮酸合成 L-酪氨酸的效率最高的原因主要是因为酪氨酸溶解度在3种芳香族氨基酸中最低,反应过程中可以观察到生成的酪氨酸以固体的形式不断析出,从而有效地推动反应正向进行。
就生物不催催化合成L-苯丙氨酸而言,来自酵母菌的转氨酶Aro8的转化效率高于来自大肠杆菌转氨酶 TyrB以及天冬氨酸转氨酶AspTA[31]。
3 结论
芳香族氨基酸是重要的手性砌块,在医药、农业和化工行业有广泛的用途。与微生物发酵生产天然芳香族氨基酸不同,本研究探索了利用转氨酶具有高活性和高立体选择性的特点,通过不对称转氨反应合成天然和非天然的芳香族 L-氨基酸。通过对不同来源转氨酶的进化分析,选择分别源自原核生物 E. coli 和真核生物S. cerevisia中的两种具有代表性I型转氨酶TyrB和Aro8,进行基因克隆和在E. coli BL21 (DE3)进行表达。重组转氨酶TyrB和Aro8在大肠杆菌中获得高水平可溶性表达。纯酶活性分析表明TyrB和Aro8均能有效地催化不对称转氨反应合成天然和非天然的L-型芳香族氨基酸。D-型氨基酸不能作为氨基供体。反应体系中氨基供体 L-丙氨酸和氨基受体芳香族 α-酮酸的最适摩尔比为 4∶1。底物芳香族 α-酮酸中芳香环上得取代基以及脂肪酸碳链部分的长度都对酶催化的转氨效率有显著的影响。在生物不对称氨化合成非天然苯甘氨酸时,转氨酶Aro8较TyrB效率更高,比生产速率是后者的2.2倍;在合成天然氨基酸苯丙氨酸和酪氨酸时,两酶催化的转氨效率相近。本研究为通过生物不对称催化合成芳香族L-氨基酸的工业化提供了直接的实验数据支持,同时为利用D-氨基酸氧化酶和L-转氨酶双酶偶联通过去消旋化实现 D-型氨基酸转化为 L-型氨基酸奠定了基础。
REFERENCES
[1] Ohide H, Miyoshi Y, Maruyama R, et al. D-Amino acid metabolism in mammals: biosynthesis, degradation and analytical aspects of the metabolic study. J Chromatogr B Analyt Technol Biomed Life Sci, 2011, 879(29): 3162−3168.
[2] Robinson T. D-Amino acids in higher plants. Life Sci, 1976, 19(8): 1097−1102.
[3] Cotter PD, O'Connor P M, Draper LA, et al. Posttranslational conversion of L-serines to D-alanines is vital for optimal production and activity of the lantibiotic lacticin 3147. Proc Natl Acad Sci USA, 2005, 102(51): 18584−18589.
[4] Lam H, Oh DC, Cava F, et al. D-amino acids govern stationary phase cell wall remodeling in bacteria. Science, 2009, 325(5947): 1552−1555.
[5] Kolodkin-Gal I, Cao S, Chai L, et al. A self-produced trigger for biofilm disassembly that targets exopolysaccharide. Cell, 2012, 149(3): 684−692.
[6] Yagasaki M, Hashimoto S. Synthesis and application of dipeptides: current status and perspectives. Appl Microbiol Biotechnol, 2008, 81(1):13−22.
[7] Deijen JB, Wientjes CJ, Vullinghs HF, et al. Tyrosine improves cognitive performance and reduces blood pressure in cadets after one week of a combat training course. Brain Res Bull, 1999, 48(2): 203−209.
[8] Claus H, Decker H. Bacterial tyrosinases. Syst Appl Microbiol, 2006, 29(1): 3−14.
[9] Prieto M, Mayor S, Lloyd-Williams P, et al. Use of the SPhos ligand to suppress racemization in arylpinacolboronate ester Suzuki couplings involving alpha-amino acids. Synthesis of biaryl derivatives of 4-hydroxyphenylglycine, tyrosine, and tryptophan. J Org Chem, 2009, 74(23): 9202−9205.
[10] Nilsson BL, Soellner MB, Raines RT. Chemical synthesis of proteins. Annu Rev Biophys Biomol Struct, 2005, 34(1): 91−118.
[11] Becker J, Wittmann C. Systems and synthetic metabolic engineering for amino acid production-the heartbeat of industrial strain development. Curr Opin Biotechnol, 2012, 23: 718−726.
[12] Park JH, Lee SY. Towards systems metabolic engineering of microorganisms for amino acid production. Curr Opin Biotechnol, 2008, 19(5): 454−460.
[13] Zhang K, Li H, Cho KM, et al. Expanding metabolism for total biosynthesis of the nonnatural amino acid L-homoalanine. Proc Natl Acad Sci USA, 2010, 107(14): 6234−6239.
[14] Xiao X, Xie Y, Su CX, et al. Organocatalytic asymmetric biomimetic transamination: from α-keto esters to optically active α-amino acid derivatives. J Am Chem Soc, 2011, 133(33): 12914−12917.
[15] Ma JA. Recent developments in the catalytic asymmetric synthesis of α- and β-amino acids. Angew Chem Int Ed Engl, 2003, 42(36): 4290−4299.
[16] Savile CK, Janey JM, Mundorff EC, et al. Biocatalytic asymmetric synthesis of chiral amines from ketones applied to sitagliptin manufacture. Science, 2010, 329(5989): 305−509.
[17] Desai AA. Sitagliptin manufacture: a compelling tale of green chemistry, process intensification, and industrial asymmetric catalysis. Angew Chem Int Ed Engl, 2011, 50(9):1974−1976.
[18] Clemente-Jiménez JM, Martínez-Rodríguez S, Rodríguez-Vico F, et al. Optically pure alpha-amino acids production by the "Hydantoinase Process". Recent Pat Biotechnol, 2008, 2(1): 35−46.
[19] Poppe L, Paizs C, Kovács K, et al. Preparation of unnatural amino acids with ammonia-lyases and 2,3-aminomutases. Methods Mol Biol, 2012, 794: 3−19.
[20] Gotor-Fernández V, Gotor V. Biocatalytic routes to chiral amines and amino acids. Curr Opin Drug Discov Devel, 2009, 12(6): 784−797.
[21] Soda K, Yoshimura T, Esaki N. Stereospecificity for the hydrogen transfer of pyridoxal enzyme reactions. Chem Rec, 2001, 1(5): 373−384.
[22] Xu H, Ouyang PK, Zhou WB. Study on preparation of L-phenylalanine from phenylpyruvic acid by E. coli EP8-10. Acta Microbiol Sin, 1999, 39(3): 272−274.徐虹, 欧阳平凯, 周卫斌. 大肠杆菌 EP8-10 转化苯丙酮酸生成 L-苯丙氨酸的研究. 微生物学报, 1999, 39(3): 272−274.
[23] Zhu D, Hua L. Biocatalytic asymmetric amination of carbonyl functional groups-a synthetic biology approach to organic chemistry. Biotechnol J, 2009, 4(10): 1420−1431.
[24] Steward JD. Dehydrogenases and transaminases in asymmetric synthesis. Curr Opion Chem Biol, 2001, 5(2): 120−129.
[25] Patel RN, Chen YJ, Goldberg SL, et al. Enzymatic preparation of (S)-amino acid from (R.S) amino acid or from keto acid: US, 20070231858, 2007-10-04.
[26] Then J, Bartsch K, Deger HM, et al. Process for preparing L-tertiary-leucine and L-phosphinothricine by transamination: US, 5919669, 1999-07-06.
[27] Iraqui I, Vissers S, Cartiaux M, et al. Characterisation of Saccharomyces cerevisiae ARO8 and ARO9 genes encoding aromatic aminotransferase I and II reveals a new aminotransferase subfamily. Mol Gen Genet, 1998, 257(2): 238−248.
[28] Fotheringham IG, Dacey SA, Taylor PP, et al. The coloning and sequence analysis of the aspC and tyrB genes from Escherichia coli K12. Biochem J, 1986, 234(3): 593−604.
[29] Kradolfer P, Niederberger P, Hütter R. Tryptophan degradation in Saccharomyces cerevisiae: characterization of two aromatic aminotransferases. Arch Microbiol, 1982, 133(3): 242−248.
[30] Qian M, Fan WP, OuYang PK, et al. Comparison of main physicochemical properties of phenylpyruvates. J Nanjing Univ Chem Technol, 1997, 19(1): 24−28.钱明, 范伟平, 欧阳平凯, 等. 苯丙酮酸及其盐的理化性质比较. 南京化工大学学报, 1997, 19(1): 24−28.
[31] [31] Cárdenas-Fernández M, López C, Álvaro G, et al. L-phenylalanine synthesis catalyzed by immobilized aspartate aminotransferase. Biochem Eng J, 2012, 63: 15−21.

