扩散加权成像在复杂性卵巢肿瘤的临床应用研究
崔艳芬,李文华,祝明洁,汪登斌,张 萍,张忠阳,储彩婷
(上海交通大学医学院附属新华医院放射科,上海 200092)
卵巢肿瘤是女性生殖系统常见的肿瘤之一,术前准确判断其良恶性,对临床选择腹腔镜、剖腹手术或随访观察等至关重要[1]。MRI具有良好的软组织对比分辨率,可多方位、多层面成像,且随着平面回波成像(EPI)等快速成像技术的飞速发展,使得DWI功能成像技术在盆腔中得到广泛应用[2-4],本文回顾性分析84例经手术病理证实的卵巢肿瘤的常规MRI及DWI资料,着重探讨DWI及ADC值定量分析在确定卵巢囊实性肿瘤性质中的诊断价值,并寻求良恶性病变的ADC值最佳阈值。
1 材料和方法
1.1 临床资料
收集2011年1月—2012年2月经手术病理证实的、并行常规MRI及DWI检查的84例卵巢肿瘤患者的资料进行回顾性分析(其中双侧性病灶17个,病理结果相同,选取典型侧分析)。84例患者的年龄范围为 17~88 岁,平均(53.1±12.16)岁,多数患者的临床表现包括下腹部或盆腔包块、停经后阴道不规则流血、尿频、腹水、血清CA125不同程度升高(46.5~4439.6 U/mL)等。
1.2 检查方法
全部患者均先行常规MRI检查(MR设备为GE Signa Twinspeed 1.5T超导全身磁共振机),三维定位后行常规横断面T1WI(TR 400~600 ms,TE 10~14 ms) 和脂肪抑制 T2WI(TR 4000~6000 ms,TE 100~120 ms),层厚 6 mm,间隔 1 mm,视野(FOV)32~42 cm,矩阵256×256,激励次数为2。矢状位T1WI和非脂肪抑制 T2WI(TR 3000~6000 ms,TE 100~110 ms)以及增强后横断面及矢状位T1WI扫描。DWI采用单激发EPI,横轴位成像,TR 8000~10000 ms,按各向同性施加扩散敏感梯度磁场,取2个扩散敏感度b值分别为0和1000s/mm2,层厚6mm,间隔 1 mm,视野32~42 cm,矩阵 128×128,激励次数为2次。
1.3 图像资料处理
所有图像传输至GE后处理工作站(ADW 4.1),ADC图由相应图层的DWI图自动生成。数据测量方法是在ADC图上选取病灶最大径所在层面,将感兴趣区放置在实性明显区域,每次所取感兴趣区面积依肿瘤大小而定,一般<120 mm2,取3次选平均值作为最终ADC值。
1.4 统计分析
2 结果
84例患者中,67例为单侧病变,17例双侧病变(患者同时患有1种以上的卵巢病变,本文中每位患者仅分析一种表现明显、导致患者临床症状的疾病)。所有患者均经手术病例证实,病理结果见表1。
2.1 MRI表现
卵巢囊腺瘤(27例),以单房或多房囊性为主肿块。①浆液性囊腺瘤(16例)呈长T1、长T2信号,直径范围3.2~15.3 cm,囊液信号大多数与水相近;②黏液性囊腺瘤(11例)呈长或短T1、长T2信号,最大径范围为5.4~17.6 cm,多数为多房性囊性病灶,典型者各房的囊液信号不同,27例囊腺瘤增强后均可见不同比例的强化囊壁、间隔及壁结节;③纤维卵泡膜类肿瘤(7例),3例为典型纤维瘤,T2WI、DWI均表现为低信号;4例为纤维卵泡膜瘤(图1),T2WI呈高低混杂信号,卵泡膜成分丰富区呈高信号,纤维成分丰富区呈低信号,相应的DWI也呈混杂信号。
50例卵巢癌及转移性肿瘤表现为一侧或两侧附件区囊实性或实性肿块,最大径范围4.9~17.9 cm,①浆液性及黏液性卵巢癌(38例),多数形态不规则,有分叶,部分有乳头状突起,厚壁分隔,赘生物及其他实性成分的出现,实性成分明显强化,DWI呈明显高信号(图2);②卵巢子宫内膜样癌(4例),3例T2WI、DWI均为高低混杂信号,1例为明显实性,双侧,且合并子宫内膜癌(图3);42例上皮源性卵巢癌中,20例合并腹水,9例合并腹膜种植转移,其中1例有明显腹腔假黏液瘤表现,7例可见盆腔淋巴结转移。③颗粒细胞瘤(1例)T2WI、DWI均为高低混杂信号。④7例转移癌的原发灶均为胃肠道肿瘤,其中4例为双侧性。
2.2 统计分析
常规MRI诊断卵巢肿瘤的敏感度、特异度及阳性预测值(PPV)和阴性预测值(NPV)分别为92.0%(46/50),76.47% (26/34),85.19% (46/54),86.67%(26/30)。其中良、恶卵巢肿瘤患者的年龄分别为17~75(50.8±13.14)岁,29~88(54.5±11.45)岁,两者之间无明显统计学意义(P>0.05)。
各病理类型T2WI、DWI高信号的例数及对应ADC值如表1所示。良性卵巢肿瘤实性成分T2WI高信号(25/34)低于恶性(46/50),且两者之间有统计学意义(P<0.05)。7例性索间质类瘤中3例为纤维瘤,T2WI上均呈明显低信号;此外,尚有22.22%(6/27)的囊腺瘤在T2WI为低信号。而恶性卵巢肿瘤中,只有14%(7/50)囊腺癌呈T2WI稍低信号。DWI图像上,良性卵巢肿瘤呈明显高信号的比例为91.18%(31/34), 低于恶性卵巢肿瘤 100%(50/50)。这些数据表明:实性成分在T2WI高信号,DWI高信号,且 ADC 较小(≤1.225×10-3mm2/s),是提示恶性的有利证据;而以下标准则提示良性的可能性大:实性成分在T2WI高或者稍低信号,DWI高信号且相应 ADC 较大(≥1.225×10-3mm2/s),或者是实性成分在T2WI及DWI上均为低信号且ADC值较小。

图1 纤维卵泡膜瘤。图1a:T1WI示肿瘤呈等低信号;图1b:T2WI示肿瘤呈高低混杂信号;图1c:增强T1WI示肿瘤呈不均匀性强化;图1d:DWI示肿瘤呈不均匀性高信号,其ADC值如图所示。Figure 1.Fibrothecoma.Figure 1a:Axial T1WI shows a right overian mass with an isointensity.Figure 1b:Axial T2WI reveals the solid ovarian tumor predominantly shows hypointensity with intervening hyperintensity.Figure 1c:Axial T1WI at the same level shows the lesion is
当常规MRI结合DWI序列时,诊断卵巢肿瘤的敏感度、特异度及PPV和NPV分别为96.0%(48/50),88.23%(30/34),92.31%(48/52),93.75%(30/32),结果表明DWI能增加诊断的敏感度、特异度。尽管所测良、恶性卵巢肿瘤实性成分的ADC值有重叠区域,但对良性肿瘤而言,其均值为(1.456±0.297)×10-3mm2/s,而恶性者均值为(0.929±0.215)×10-3mm2/s, 两者之间有明显统计学差异(P<0.01)。ROC曲线(图4)结果显示,ADC值≥1.225×10-3mm2/s可作为良、恶性卵巢肿瘤鉴别的最佳阈值,以此点为阈值的敏感度、特异度及曲线下面积分别为86.7%、94%和92.1%。

表1 84例患者的病理类型和相应ADC

图2 黏液性囊腺癌。图2a:T2WI示肿瘤呈等高混杂信号;图2b:增强T1WI示肿瘤呈明显不均匀性强化;图2c:DWI示肿瘤呈不均匀性高信号,其ADC值如图所示;图2d:病理图片。Figure 2.Mucinous cystadenoma.Figure 2a:Axial T2WI demonstrates unilateral complex solid/cystic adnexal masses.Figure 2b:Axial fat-saturated contrast-enhanced T1WI reveals the solid portion of masses displays remarkable enhancement.Figure 2c:Axial DWI map shows very strong signal intensity(the ADC value is 0.948×10-3mm2/s).Figure 2d:The pathlogical picture.

图3 双侧卵巢宫内膜样腺癌伴子宫内膜癌。图3a:T2WI示肿瘤呈高低混杂信号;图3b:矢状位示子宫内膜增厚;图3c:增强T1WI示肿瘤呈不均匀性强化;图3d:DWI示肿瘤呈不均匀性高信号。Figure 3.Bilateral endometrioid adenocarcionma with endometrial cancer.Figure 3a:Axial T2WI demonstrates bilateral complex solid/cystic adnexal masses.Figure 3b:The sagittal T2WI shows distinct endometrial thickening.Figure 3c:Axial fat-saturated contrast-enhanced T1WI reveals remarkable enhancement of the solid portion of masses.Figure 3d:Axial DWI map shows very strong signal intensity of the sol-
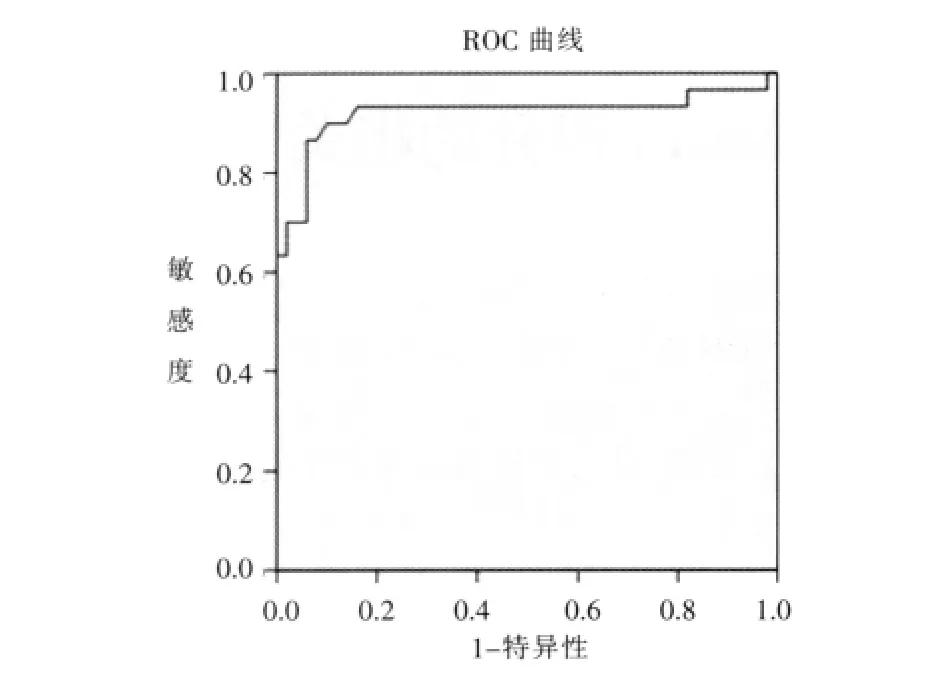
图4 ROC曲线。Figure 4.ROC curve.
3 讨论
卵巢肿瘤的组织学类型繁多,可为卵巢的上皮源性、生殖细胞源性和性索-间质源性或转移性。肿瘤的形态学可从单纯囊性、明显囊性、囊实性(复杂性)到实质性,常存在异质同形、异形同质或异影同质等现象,导致卵巢良、恶性肿瘤术前诊断和鉴别困难,尤其是囊实性卵巢肿瘤。尽管一些常规MRI指标如病灶大小>6 cm、厚壁分隔(>3 mm)及不规则乳头状突起(赘生物)、壁结节及其他实性成分、坏死、出血等征象有助于恶性肿瘤,尤其是对恶性上皮源性卵巢肿瘤的诊断[5-7],但这些指标在良、恶性卵巢肿瘤间仍有重叠,不具有特异性,也因此不能作为良、恶性鉴别的可靠标准。例如,一些恶性卵巢病变,尤其是低分化腺癌,常以实性为主,但常因间质纤维组织增生和间质水肿明显而在T2WI上的表现类似于其他实性良性病变的信号特征[8];相比之下,当纤维卵泡膜瘤的卵泡膜成分明显又合并大量胸腹水时(梅格斯综合征),常被误诊为恶性肿瘤[9],而卵巢黏液瘤腹腔播散时也易误诊为恶性。我们的数据同时也显示良、恶性肿瘤的大小存在交叉,单纯依靠大小不能区分肿瘤的良、恶性。
DWI是目前惟一能在活体观察组织水分子微观运动的功能成像,既可以反映肿瘤的信号特征又可以测量肿瘤兴趣区的表观扩散系数即ADC值进行量化分析。ADC值的大小主要受细胞内、外水分子运动和微循环灌注等形式水分子运动的影响[10]。本文研究结果证明,实性成分在T2WI及DWI呈高信号及低ADC值可作为恶性卵巢肿瘤强有力证据,本研究中,恶性卵巢肿瘤实性成分在T2WI呈高信号的占86%(43/50),DWI呈高信号占100%及低ADC值(≤1.225×10-3mm2/s),这与恶性恶性肿瘤细胞密集、胞外间隙减小、肿瘤细胞核浆比例增大等导致细胞内外水分子运动受限有关;而良性肿瘤在T2WI及DWI上呈低信号,则与高纤维成分所致细胞密度低、细胞内外间隙小有关[11-13]。
我们的研究结果还表明,结合DWI信号特征和ADC的定量分析能够提高MRI在卵巢肿瘤诊断上的敏感性和特异性。尽管良、恶性卵巢肿瘤实性成分ADC测量值有重叠区域,但两组间均值有明显统计学意义(P<0.05),且以 ADC 值≥1.225×10-3mm2/s为阈值鉴别良、恶性卵巢肿瘤具有较高的敏感性(86.7%)、特异性(94%)及 PPV(92.31%)和 NPV(93.75%),这与部分文献的结论相一致[5,14-15]。 例如,Takeuchi等[15]对10个良性及39个恶性卵巢肿瘤的研究结果表明,恶性组ADC值明显低于良性组,两者之间有明显统计学意义,以1.15×10-3mm2/s为最佳阈值,其鉴别卵巢良、恶性肿瘤的敏感度、特异度及 PPV、NPV 分别为 74%,80%,94%,44%。 而与Fujii等[9]和 Thomassin-Naggara等[16]的研究结果不相符,他们的结果分别表明DWI、ADC量化在良、恶性组间无统计学意义,这种差异可能与所选取良性组病例的病例构成有关。例如,卵巢纤维瘤等良性肿瘤中含大量成纤维细胞或胞外基质中有较多胶原纤维,阻碍了水分子运动,导致其ADC较低,从而降低了良、恶性组之间的ADC差异;也可能由于是T2穿透效应,因为DWI信号强度不仅受被测组织水扩散率的影响,还受其本身的T2特征影响。况且,以前的研究也表明,成熟畸胎瘤等良性病变的ADC值也较低[17]。这些解释是导致他们结论的差异的基础。
本文也存在一些局限性,第一,在选取病例的时候,将无实性成分的单纯囊性病变,如单纯性囊肿、巧克力囊肿,以及在普通MRI即可明确诊断的病例,如成熟性畸胎瘤等剔除在外,这可能会造成选择偏倚;第二,样本量小,各种病例的发病比例并不一定与相应的发病率完全相符,例如,我们选择的性索间质类肿瘤病例较少,良性肿瘤纤维瘤可能会因ADC值较低而降低良、恶组间的差异,引起误差。
综上所述,DWI作为常规MRI的有益补充,在卵巢肿瘤良、恶性的鉴别方面发挥广泛应用,但是在实际应用中,我们还是需要和常规MRI及各种病理类型的影像特征相结合,以达到更好的术前判断肿瘤的性质。
[1]Medeiros LR,Freitas LB,Rosa DD,et al.Accuracy of magnetic resonance imaging in ovarian tumor:a systematic quantitative review[J].Am J Obstet Gynecol,2011,204:67.
[2]Jung SE,Lee JM,Rha SE,et al.CT and MR imaging of ovarian tumors with emphasis on differential diagnosis[J].Radiographics,2002,22:1305-1325.
[3]Bazot M,Darai E,Nassar-Slaba J,et al.Value of magnetic resonance imaging for the diagnosis of ovarian tumors:a review[J].J Comput Assist Tomogr,2008,32:712-723.
[4]Thomassin-Naggara I,Darai E,Cuenod CA,et al.Dynamic contrast-enhanced magnetic resonance imaging:a usefultoolfor characterizing ovarian epithelial tumors[J].J Magn Reson Imaging,2008,28:111-120.
[5]Li WH,Chu CT,Cui YF,et al.Diffusion-weighted MRI:a useful technique to discriminate benign versus malignant ovarian surface epithelialtumors with solid andcystic components[J].Abdom Imaging,2012,37(5):897-903.
[6]Bazot M,Nassar-Slaba J,Thomassin-Naggara I,et al.MR imaging compared with intraoperative frozen-section examination for diagnosis of adnexal tumors;correlation with final histology[J].Eur Radiol,2006,16:2687-2699.
[7]Sohaib SAA,Sahdev A,Trappen PV,et al.Characterization of adnexal mass lesions on MR imaging[J].AJR,2003,180:1297-1304.
[8]Tanaka YO,Nishida M,Yamaguchi M,et al.MRI of gynecological solid masses[J].Clin Radiol,2000,55:899-911.
[9]Fujii S,Kakite S,Nishihara K,et al.Diagnostic accuracy of diffusion-weighted imaging in differentiating benign from malignant ovarian lesions[J].J Magn Reson Imaging,2008,28:1149-1156.
[10]席艳丽,白旭.MR扩散成像对卵巢病变定性诊断的研究[J].临床放射学杂志,2008,27(4):466-469.
[11]Umemoto M,Shiota M,Shimono T,et al.Preoperative diagnosis of ovarian tumors,focusing on the solid area based on diagnostic imaging[J].J Obstet Gynecol Res,2006,32:195-201.
[12]Erturk SM,Ichikawa T,Sano K,et al.Diffusion-weighted magnetic resonance imaging for characterization of focal liver masses:impact of parallel imaging(SENSE)and b value[J].J Comput Assist Tomogr,2008,32:865-871.
[13]Nakai G,Matsuki M,Inada Y,et al.Detection and evaluation of pelvic lymph nodes in patients with gynecologic malignancies using body diffusion-weighted magnetic resonance imaging[J].J Comput Assist Tomogr,2008,32:764-768.
[14]Thomassin-Naggara I,Toussaint I,Perrot N,et al.Characterization of complex adnexal masses:value of adding perfusion-and diffusion-weighted MR imaging to conventional MR imaging[J].Radiology,2011,258:793-803.
[15]Takeuchi M,Matsuzaki K,Nishitani H.Diffusion-weighted magnetic resonance imaging of ovarian tumors:differentiation of benign and malignant solid components of ovarian masses[J].J Comput Assist Tomogr,2010,34:173-176.
[16]Thomassin-Naggara I,Darai E,Cuenod CA,et al.Contribution of diffusion-weighted MR imaging for predicting benignity of complex adnexal masses[J].Eur Radiol,2009,19:1544-1552.
[17]Katayama M,Masui T,Kobayashi S,et al.Diffusion-weighted echo planar imaging of ovarian tumors:is it useful to measure apparent diffusion coefficients?[J].J ComputAssistTomogr,2002,26:250-256.

