两种MHC-B单倍型鸡群在发育过程中四种细胞因子转录水平的变化①
蔡文博 李 行 武永淑 杨 柳 张 伟 韩凌霞
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,哈尔滨150001)
两种MHC-B单倍型鸡群在发育过程中四种细胞因子转录水平的变化①
蔡文博 李 行 武永淑 杨 柳 张 伟 韩凌霞
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,哈尔滨150001)
目的:从分子水平探讨鸡免疫系统的个体发生学。方法:利用双重荧光定量RT-PCR(dqRT-PCR)技术,对14~35日龄主要组织相容性复合体(MHC)单倍型鸡品系G2(B15单倍型)和G5系(B5单倍型)鸡群的肺组织(包括气管)、脾脏和外周血淋巴细胞(PBL)中IFN-γ、IL-18、IL-4和IL-10的mRNA含量进行定量检测。结果:随日龄增长,两鸡群脾脏中IFN-γ转录水平升高,PBL中IL-18和IL-10整体下降。G5系鸡群脾脏中IFN-γ转录水平始终高于肺组织和PBL。两鸡群脾脏中IL-18转录水平均高于肺组织和PBL,脾脏中IL-4在孵化后早期转录水平较高,而肺组织中则出现较晚。两鸡群肺组织、脾脏和PBL中IL-10均在35日龄降到最低。结论:14~35日龄无特定病原体(SPF)鸡脾脏中IFN-γ转录水平随生长发育而增多,而肺组织和PBL中未见明显随生长发育变化的规律;PBL中IL-18和IL-10转录水平随生长发育而下降;18~35日龄,肺组织、脾脏和PBL中IL-10转录水平均随日龄增长而降低;不同MHC-B单倍型鸡群细胞因子转录水平受日龄调节相似。
IFN-γ;IL-18;IL-4;IL-10;MHC;双重荧光定量RT-PCR
禽类免疫系统的发育及功能的发挥与日龄密切相关,特别是T细胞的分化和发育。禽类肺脏免疫系统是抵御呼吸道病原体的第一道防线,在先天性免疫应答中具有重要作用。不同发育阶段,肺粘膜上含有的细胞数量有很大区别。脾脏作为二级淋巴器官,在诱导抗体介导的免疫反应,抵御胸腺依赖性抗原中具有重要作用[1]。脾脏中的T细胞随着生长发育而增多,其中,胚胎期增殖较少,孵化后早期增加迅速[2,3]。血液作为特殊类型的结缔组织,在血浆和组织液间进行持续的物质和细胞运输,其中的白细胞是免疫系统中重要的组成部分,在血液中仅存在12~20小时,随后离开循环系统进入组织,发挥功能。
鸡主要组织相容性复合体(Major histocompatablity complex,MHC)是鸡的免疫遗传相关基因,与疾病抗性或易感性有关。G2系和G5系鸡群是MHC特异单倍型无特定病原体(Specific pathogen free,SPF)鸡群,分别属于B15和B5单倍型。B5单倍型鸡群的抗病能力较差,对马立克氏病(Marek’s disease,MD)、传染性法氏囊病(Infectious bursal disease,IBD)、禽白血病(Avian leucosis,AL)及劳氏肉瘤病(Rous sarcoma,RS)均易感[4];B15 单倍型鸡群对MD的抵抗能力相对较强[5]。
本试验以G2系和G5系SPF鸡群为试验对象,通过检测不同发育阶段,两鸡群肺组织、脾脏和外周血淋巴细胞(PBL)中 IFN-γ、IL-18、IL-4和 IL-10 的mRNA含量,从分子转录水平探讨鸡免疫系统的个体发生学。
1 材料与方法
1.1 实验动物、感受态细胞 40周龄SPF成年鸡,7日龄BW系列G2系和G5系SPF鸡由中国农业科学院哈尔滨兽医研究所培育提供,使用许可证编号为SYXK黑(2006-)。大肠杆菌感受态细胞TG1由本实验室保存。
1.2 主要试剂 鸡淋巴细胞分离液购自天津灏洋生物制品科技有限责任公司;Hank′s平衡盐溶液、改良型RPMI1640培养基、优级胎牛血清(FBS)购自Hyclone公司;Concanavalin A(ConA)购自Solarbio公司;RNA Isoplus、M-MLV反转录酶、RNA酶抑制剂、dNTP Mixture(10 mmol/L)、Ex Taq 酶、20 bp DNA Ladder Marker、pMD-18T 载体、X-Gal、异丙基硫代半乳糖苷(IPTG)、Premix Ex TaqTM等均购自大连宝泰克生物工程有限公司;胶回收试剂盒购自上海华舜生物技术有限公司;质粒小量提取试剂盒E.Z.N.A Plasmid Mini KitⅡ购自美国 OMEGA 公司。
1.3 dqRT-PCR引物及探针的合成 以28s rRNA为内参基因,分别建立鸡IFN-γ、IL-4、IL-10和IL-18基因的 dqRT-PCR 方法。IFN-γ、IL-4、IL-10、IL-18和28s rRNA的引物及荧光素标记探针参照文献设计合成[6-10],见表1。引物和探针均由上海生工生物技术有限公司合成。
1.4 目的基因及内参基因的克隆 无菌采集成年SPF鸡翅静脉血,肝素钠抗凝,按照产品说明书分离外周血淋巴细胞。即将抗凝血与等体积Hank′s液混匀,加至等体积鸡淋巴细胞分离液上方,2 000 r/ min,室温离心15分钟;吸取中间淋巴细胞层,1 500 r/min,室温离心10分钟收集细胞。用RPMI1640培养基洗涤2次。加入终浓度为25 μg/ml的ConA作为刺激剂,于37℃、5%CO2培养箱中培养36小时。收获细胞,参照RNA isoplus试剂说明书提取总RNA。参照M-MLV反转录酶说明书进行随机引物反转录。以cDNA为模板,分别PCR扩增IFN-γ、IL-4、IL-10、IL-18和28s rRNA基因,反应条件均为:95℃,5分钟;94 ℃,20秒,60 ℃,30秒,72 ℃,30秒,30个循环;72℃,10分钟。胶回收各基因的扩增片段。参照说明书,将各基因的回收产物分别连接于pMD-18T载体,转化于TG1感受态细胞。将PCR鉴定大小正确的重组质粒在中国农业科学院哈尔滨兽医研究所基础与技术服务部进行测序。用MEGA 4.0软件对序列测定结果与GenBank中的参考序列比对分析。测序正确的各重组质粒分别命名为p-IFN-γ、p-IL-4、p-IL-10、p-IL-18 和 p-28s rRNA。
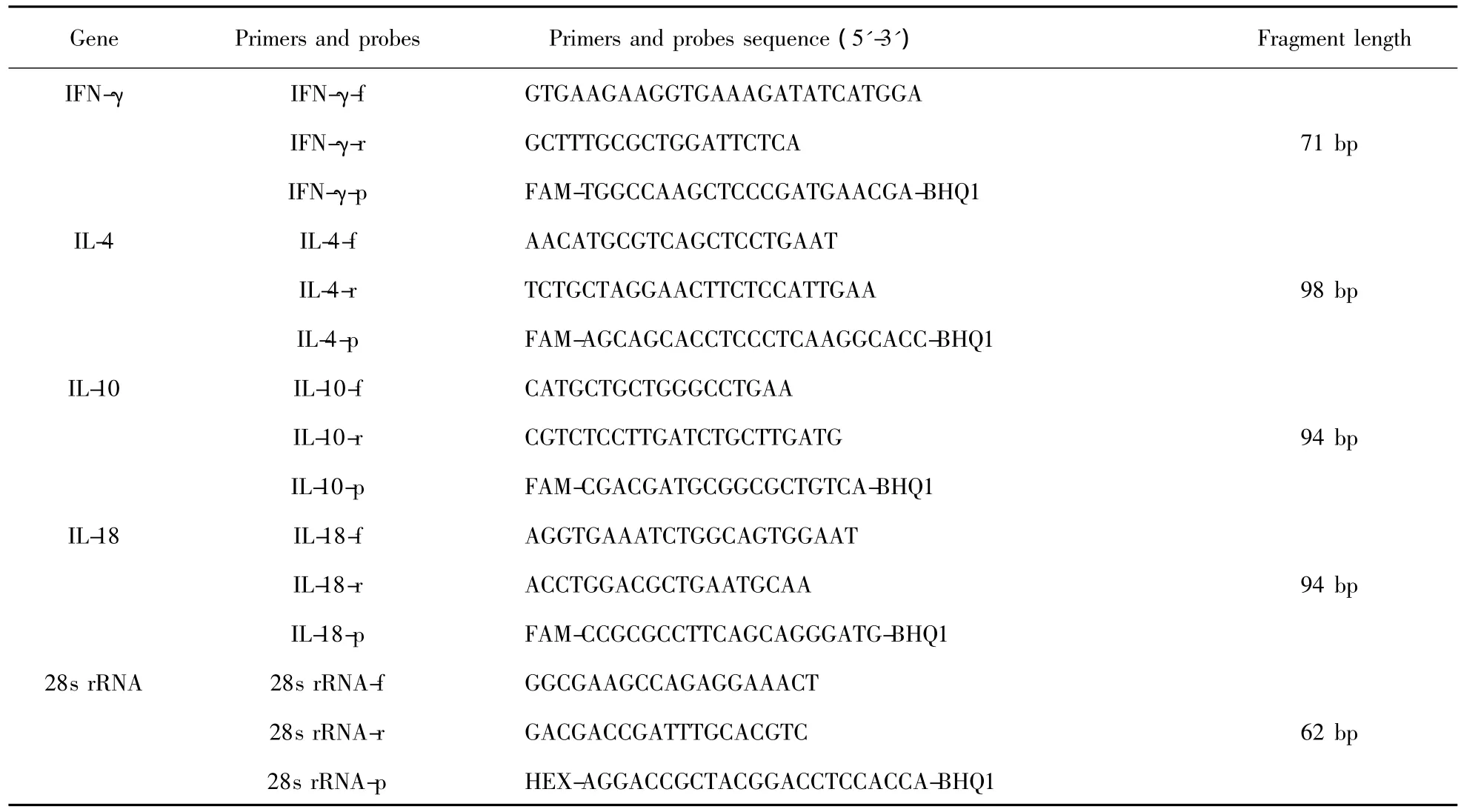
表1 双重荧光定量PCR的引物和探针序列Tab.1 Primers and probes sequence of duplex quantitative PCR
1.5 标准曲线的绘制 使用紫外分光光度计测定各质粒的浓度和纯度,并参考以下公式计算基因的拷贝数:单位体积质粒拷贝数(copies/μl)=6.023×1023(copies/ mol)×C(g/μl)/碱基数×660(g/mol)。将重组质粒用 TE 稀释至 1.0 ×1010拷贝/μl,p-IFN-γ、p-IL-4、p-IL-10 和p-IL-18 各取10 μl,分别与10 μl p-28s rRNA 一同加入80 μl的ddH2O中,漩涡振荡充分混匀后,吸取10 μl至90 μl的 ddH2O 中,依次 10 倍倍比稀释至1.0 ×101拷贝/μl,以101~1010拷贝/μl质粒作为标准品绘制标准曲线,使用Bio/Rad IQ5定量PCR仪进行扩增。各基因的反应体系均为25 μl,反应条件为:95 ℃,30秒;94℃,20秒,60 ℃,1分钟,40个循环。
1.6 G2系和G5系鸡群细胞因子转录水平动态分析 7日龄G2系(18羽)和G5系(20羽)SPF雏鸡饲养于负压隔离器内,分别于 14、15、16、18、24和35日龄从两鸡群中取出3~5羽,采集翅静脉抗凝血,分离PBL(B);利用CO2将鸡窒息致死后,摘取气管及肺脏(L),分离单细胞,具体操作如下:将摘取的肺脏和气管置于预冷的PBS中洗涤,在一平皿上方放置一块200目铜网,加入5 ml预冷的Hank′s平衡盐溶液,将肺脏和气管移至铜网上,一并剪碎,用20 ml注射器尾部进行充分研磨,使之透过铜网成单细胞,在15 ml离心管中加入5 ml鸡淋巴细胞分离液,将制备好的单细胞悬液沿管壁缓慢加于分离液之上,2 000 r/min,离心15分钟,吸取中间云雾层于新的离心管中,4℃,8 000 r/min,离心2分钟,弃上清即得;采集脾脏(S)约100 mg,剪碎并用研磨棒充分研磨。分别提取各处理后组织总RNA,经反转录得到 cDNA,用于 IFN-γ、IL-4、IL-10 和 IL-18 mRNA含量的检测。计算目的基因与内参基因的比值,利用SAS软件中的LSD法进行数据分析。
2 结果
2.1 目的基因的扩增 利用IFN-γ、IL-18、IL-4、IL-10和28s rRNA的特异性引物,从SPF鸡PBL中扩增获得特异的条带,大小与预期符合,图略。
2.2 重组质粒的鉴定 分别从重组质粒p-IFN-γ、p-IL-18、p-IL-4、p-IL-10和 p-28s rRNA 中扩增出71、94、98、94和62 bp的特异性条带,与预期大小相符,见图1。使用MEGA 4.0软件对测得的重组质粒p-IFN-γ、p-IL-18、p-IL-4、p-IL-10 和 p-28s rRNA 的核苷酸序列分别与GenBank中登录的参考序列NM205149、BM489174、NM_001007079、EF554720 和X59733进行比对,结果表明,所有克隆的目的基因序列均与各自的参考序列完全一致,同源性为100%。
2.3 dqRT-PCR标准曲线的建立 分别将p-IFN-γ、p-IL-18、p-IL-4和p-IL-10重组质粒与p-28s rRNA质粒混合,依次进行10倍倍比稀释,取浓度范围在101~1010拷贝/μl的混合质粒标准品进行定量PCR扩增,构建标准曲线。结果显示,各扩增反应中扩增曲线均呈标准的“S”型,目的基因与内参基因的扩增效率相近,且均呈良好的线性关系,如图2。
2.4 G2和G5系鸡群3种组织中IFN-γ转录水平的动态变化 两鸡群同一被检组织中IFN-γ转录水平随日龄变化的趋势大体一致,脾脏中IFN-γ水平整体随日龄增长而升高,且几乎始终高于肺组织和PBL,而肺组织和PBL中无明显随日龄变化的规律。G2鸡群PBL中IFN-γ转录水平基本一直低于肺组织和脾脏,14日龄时其3种被检组织中IFN-γ转录水平相近,35日龄时出明显差异,即脾脏>肺组织>PBL;G5鸡群24日龄时PBL中IFN-γ显著高于15日龄(P<0.05),极显著高于18和35日龄(P <0.01),如图3A。
2.5 G2和G5系鸡群3种组织中IL-18转录水平的动态变化 两鸡群脾脏中IL-18转录水平均始终高于肺组织和PBL,G2鸡群脾脏中IL-18在24日龄时最低,而此时G5系最高。两鸡群肺组织中IL-18均保持较平稳态势。随日龄增长,两鸡群PBL中 IL-18呈下降趋势,15~35日龄期间各时间点IL-18转录水平均较14日龄显著降低(P<0.05),如图3B。
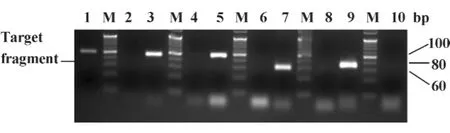
图1 重组质粒的PCR鉴定Fig.1 PCR identification of recombinant plasmid
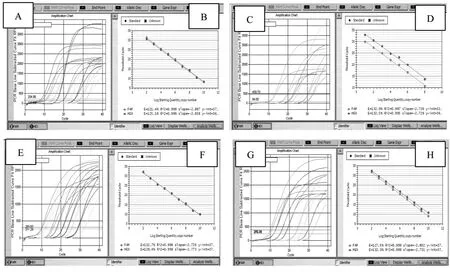
图2 各目的基因质粒与内参基因质粒双重荧光定量PCR反应的扩增曲线和标准曲线Fig.2 Duplex quantitative PCR amplification and standard curves for target gene and reference gene plasmids
2.6 G2和G5系鸡群3种组织中IL-4转录水平的动态变化 两鸡群各被检组织中IL-4转录水平极低,脾脏中IL-4在15日龄时相对较高,其中G2鸡群达到显著水平(P<0.05)。两鸡群肺组织中IL-4转录水平在35日龄时最高,如图3C。
2.7 G2和G5系鸡群3种组织中IL-10转录水平的动态变化 两鸡群PBL中IL-10转录水平随日龄增长呈整体下降趋势,由14日龄高于其它被检组织,到35日龄降至最低。14~16日龄,两鸡群肺组织中IL-10转录水平有所升高,但随后开始下降。14~18日龄,两鸡群脾脏中IL-10转录水平上下波动,18日龄后迅速下降,如图3D。
3 讨论
两鸡群脾脏中IFN-γ转录水平随日龄增长而升高,G5鸡群脾脏中IFN-γ水平高于PBL的结果与文献报道一致[11,12]。脾脏中T细胞的积聚与脾脏的生长和发育有关,T细胞随脾脏的生长而增多,胚胎期增殖较少,孵化后早期增多迅速。可能正因如此,在14~35日龄期间,以35日龄时的转录水平最高,这与T细胞数量增多成正相关。Lowenthal等人在研究孵化后早期鸡脾脏中T细胞数量时发现,孵化后第4天和第7天脾脏中CD3+T细胞含量与孵化后第1天相比分别增长了18倍和73倍,CD4+T细胞分别增加了4.5倍和8倍,CD8+T细胞含量也随着脾脏的发育而增多。Seto比较19胚龄和2~9日龄鸡的免疫功能时发现,8日龄鸡脾脏产生的免疫应答水平高于低日龄的鸡及鸡胚。1~7日龄鸡脾脏中T细胞数量的增加,也与在有丝分裂原的刺激下脾脏中IFN-γ含量的增加有关[11]。本研究中35日龄时,G2和G5鸡群脾脏中IFN-γ转录水平较14日龄分别增长了88.2倍和76.4倍。14日龄时G2鸡群肺组织、脾脏和PBL中IFN-γ转录水平相近,35日龄时出明显差异,即脾脏>肺组织>PBL,说明脾脏作为免疫器官,其区别于其它组织的特性及其特有功能的发挥随发育成熟而表现得日趋明显。
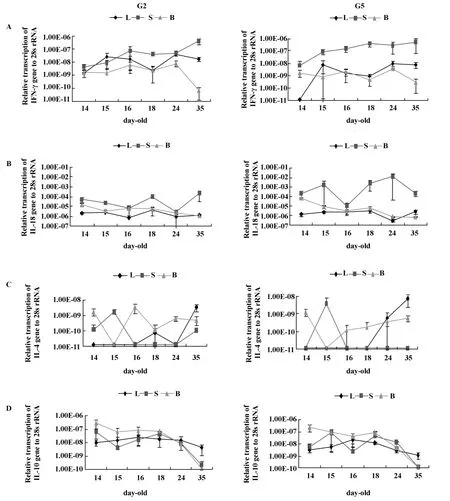
图3 G2和G5系鸡群肺组织、脾脏和外周血淋巴细胞中细胞因子的转录水平Fig.3 Cytokine transcript levels in lungs,spleens and PBL of lines G2 and G5 birds
两鸡群脾脏中IL-18转录水平均高于肺组织和PBL,G2和G5鸡群分别在35和24日龄时水平最高,与 Abdul-Careem等人[12]报道的脾脏中 IL-18 mRNA含量随日龄增大而增多的结果相似,可能与脾脏免疫功能的发挥有关。同时,也说明不同MHC单倍型鸡同一免疫器官的发育或其细胞因子的分泌并非完全一致。然而,PBL中IL-18转录水平随日龄增大呈现下降趋势。
哺乳动物胚胎期和新生期,淋巴器官中的细胞因子种类尚不齐备,但此时Th2型细胞因子含量丰富,鸡胚中IL-4 mRNA含量高于孵化后的鸡[12]。本研究中,两鸡群脾脏中IL-4在15日龄时最高,PBL中IL-10转录水平随日龄增长呈整体下降趋势,肺组织和脾脏中IL-10也均在35日龄时降到最低,与前人的结论一致。此外,IL-4在不同组织中聚集的时期不同,脾脏主要在孵化后早期聚集较多,而肺脏中则出现较晚。
1 Jeurissen S H.Structure and function of the chicken spleen[J].Res Immunol,1991;142(4):352-355.
2 Dunon D,Courtois D,Vainio O et al.Ontogeny of the immune system:gamma/delta and alpha/beta T cells migrate from thymus to the periphery in alternating waves[J].J Exp Med,1997;186(7):977-988.
3 Dunon D,Allioli N,Vainio O et al.Renewal of thymocyte progenitors and emigration of thymocytes during avian development[J].Dev Comp Immunol,1998;22(3):279-287.
4 高彩霞,韩凌霞,韩建林.组织相容性复合体在实验鸡中的应用[J].中国比较医学杂志,2010;20(2):1-5.
5 Schat K A,Xing Z.Specific and nonspecific immune responses to Marek′s disease virus [J].Dev Comp Immunol,2000;24(2-3): 201-221.
6 Avery S,Rothwell L,Degen W D.et al.Characterization of the first nonmammalian T2 cytokine gene cluster:the cluster contains functional single-copy genes for IL-3,IL-4,IL-13,and GM-CSF,a gene for IL-5 that appears to be a pseudogene,and a gene encoding another cytokinelike transcript,KK34[J].J Interferon Cytokine Res,2004; 24(10):600-610.
7 Eldaghayes I,Rothwell L,Williams A et al.Infectious bursal disease virus:strains that differ in virulence differentially modulate the innate immune response to infection in the chicken bursa[J].Viral Immunol,2006;19(1):83-91.
8 Kaiser P,Rothwell L,Galyov E E et al.Differential cytokine expression in avian cells in response to invasion by Salmonella typhimurium,Salmonella enteritidis and Salmonella gallinarum[J].Microbiology,2000;146(12):3217-3226.
9 Kaiser P,Underwood G,Davison F.Differential cytokine responses following Marek’s disease virus infection of chickens differing in resistance to Marek’s disease[J].J Virol,2003;77(1):762-768.
10 Shack L A,Buza J J,Burgess S C.The neoplastically transformed (CD30hi)Marek′s disease lymphoma cell phenotype most closely resembles T-regulatory cells [J].Cancer Immunol Immunother,2008;57(8):1253-1262.
11 Abdul-Careem M F,Hunter D B,Lambourne M D et al.Ontogeny of cytokine gene expression in the chicken spleen [J].Poult Sci,2007;86(7):1351-1355.
12 Abdul-Careem M F,Hunter D B,Lambourne M D et al.Expression of cytokine genes following pre-and post-hatch immunization of chickens with herpesvirus of turkeys[J].Vaccine,2008;26(19): 2369-2377.
[收稿2012-01-10 修回2012-05-28]
(编辑 张晓舟)
The transcription level of four kinds of cytokines in two MHC-B haplotypes chickens in the development
CAI Wen-Bo,LI Hang,WU Yong-Shu,YANG Liu,ZHANG Wei,HAN Ling-Xia.State Key Laboratory of Veterinary Biotechnology,Harbin Veterinary Research Institute,Chinese Academy of Agricultural Sciences,Harbin 150001,China
Objective:To investigate the ontogeny of chicken immune system.MethodsIFN-γ,IL-18,IL-4 and IL-10 mRNA was isolated from lungs,spleens and peripheral blood lymphocytes(PBL)of genetically defined lines G2(B15/B15 haplotype)and G5(B5/B5 haplotype)chickens(14 to 35 days old),and the levels in samples were detected by duplex quantitative real-time reverse transcription polymerase chain(dqRT-PCR)assay.ResultsIFN-γ in spleens was increased with growth,while IL-18 and IL-10 in PBL were in the opposite.IFN-γ in spleens of line G5 was higher than that in lungs and PBL all the time.IL-18 in spleens of both lines was higher than that in lungs and PBL.IL-4 in spleens was higher during the early posthatch period,but later in the lungs.IL-10 in the lungs,spleens and PBL of both lines were declined to the lowest at the 35 days old.ConclusionIFN-γ in spleens of SPF chickens (14 to 35 days old)increased with growth,but no obvious discipline shown in lungs and PBL;IL-18 and IL-10 in PBL decreased with growth.IL-10 in lungs,spleens and PBL was decreased with growing from 18 to 35 days old.The transcription level of cytokines in different MHC-B haplotype chickens were regulated similarly by the age.
IFN-γ;IL-18;IL-4;IL-10;MHC;dqRT-PCR
S852.4
A
1000-484X(2012)08-0722-06
10.3969/j.issn.1000-484X.2012.08.011①本文为中央级公益性科研院所基本科研业务费项目(2009-08)和兽医生物技术国家重点实验室基本科研业务费项目(NKLVBP2008)
蔡文博(1984年-),女,硕士,主要从事动物传染病防治技术研究,E-mail:happybocai2008@163.com;
及指导教师:韩凌霞(1971年-),女,博士,副研究员,硕士生导师,主要从事免疫遗传学研究,E-mail: hlx1993@126.com。
·中医中药与免疫·

